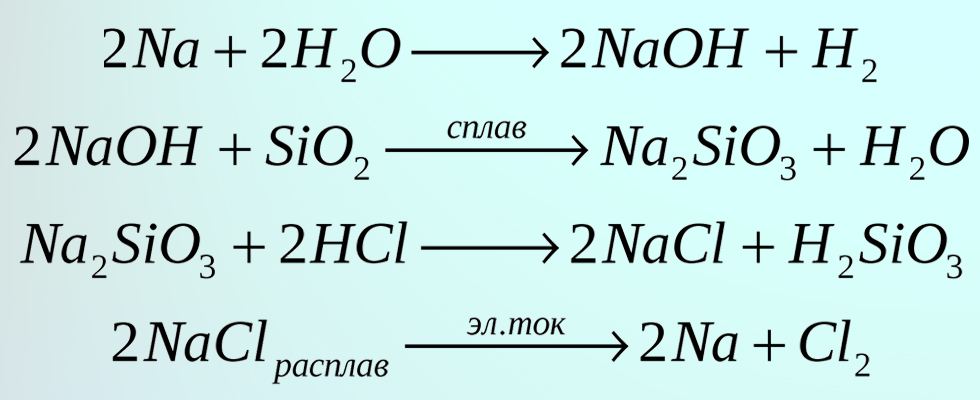урок 14. Уравнения химических реакций
Составлять химические уравнения и производить расчеты по ним нужно, опираясь на закон сохранения массы веществ при химических реакциях. Рассмотрим, как можно составить химическое уравнение, на примере реакции меди с кислородом.
— Слева запишем исходные вещества, справа — продукты реакции. Если веществ два и более, соединяем их знаком «+». Между левой и правой частями пока поставим стрелку.
Подобное выражение называют схемой химической реакции. Запишем эту схему при помощи химических формул:
$\mathrm
— Число атомов кислорода в левой части схемы равно двум, а в правой — одному. Число атомов каждого элемента до реакции должно быть равно числу атомов этих же элементов после реакции. Чтобы уравнять число атомов кислорода в левой и правой частях схемы, перед формулой СuО поставим коэффициент 2:
$\mathrm
— Теперь число атомов меди после реакции (в правой части) равно двум, а до реакции (в левой части) только одному, поэтому перед формулой меди Сu поставим коэффициент 2.
$\mathrm <2Cu+O_<2>\rightarrow 2CuO>$
— В результате произведенных действий число атомов каждого вида в левой и правой частях одинаково, что дает нам основание заменить стрелку на знак «=» (равно). Схема превратилась в уравнение химической реакции.
Обратите внимание: если для протекания реакции требуется повышенная температура, то над знаком равенства нужно поставить значок t (данная реакция протекает при температуре t = 400 — 500 °C).
Это уравнение читается так: два купрум плюс о-два равно два купрум-о.
Урок для 7 класса по химии «Химические уравнения»
Данная работа является полным конспектом урока по химии для 7 класса
Просмотр содержимого документа
«Урок для 7 класса по химии «Химические уравнения»»
Тема урока: Химические уравнения
Цели урока: — формировать понятие «химическое уравнение»;
— пояснить правила составления химических уравнений;
— развивать навыки и умения составления уравнений химических реакций, размещения на коэффициентов в уравнениях реакций основе закона сохранения масс, чтения химических уравнений;
— расширить представления о химических реакциях;
— воспитывать интерес к предмету, ответственность за результаты учебного труда
Оборудование и материала: раздаточный дидактический материал, учебник, презентация «Химические уравнения», периодическая система Д.И. Менделеева
Базовые понятия и термины: химическое уравнение, химические явления, химические реакции
Тип урока – Комбинированный
Методы и приёмы: пояснительно-иллюстративные: беседа, рассказ; практические: выполнение упражнений, частично-поисковые.
Х о д у р о к а
Проверка готовности учащихся к уроку
ПРОВЕРКА ДОМАШНЕГО ЗАДАНИЯ
Сформулируйте закон сохранения массы
(Масса вещества, вступившего в химическую реакцию, равна массе веществ, которые образовались в результате реакции).
. Когда и кем был открыт этот закон?
(1748 р. М. Ломоносовым, 1789 А. Лавуазье).
АКТУАЛИЗАЦИЯ ОПОРНЫХ ЗНАНИЙ
Сообщение темы и цели урока
В чём сущность химической реакции? (Превращение веществ).
Что происходит с атомами во время химической реакции? (Перегруппировка).
ИЗУЧЕНИЕ НОВОГО МАТЕРИАЛА
Химическую реакцию процесса горения серы можно записать в таком виде:
сера + кислород → сернистый газ.
Такая запись даёт мало информации, не указывается химический состав реагентов и продуктов. Поэтому существует другой способ запись — химическая схема реакции, где вместо названий веществ содержатся химические формулы:
Эта схема наглядно показывает, что химические элементы во время химической реакции не меняются. Однако это отображает только качественную характеристику химической реакции. Количественную характеристику реакции отображает закон сохранения массы веществ
В соответствии к этому закону число атомов разных элементов во время химической реакции не меняется. Число атомов одного элемента до и после должны равняться. Это должно быть отображено в схеме химической реакции, тогда она становится химическим уравнением. Число атомов меняют с помощью коэффициентов.
Химическое уравнение — это условное изображение химической реакции с помощью формул и коэффициентов.
Правильность расстановки коэффициентов, и выполнение закона сохранения массы докажем на примере:
4 атома 2 атома
4 • 1 = 4 2 •16 = 32 2 (2 • 1 + 16) = 32
Вывод: число атомов в левой части реакции равно числу атомов в правой части, и обусловленная этим равенство масс веществ является доказательством правильности расположения коэффициентов.
Беседа с комментированием.
Правила написания химических уравнений
1. Нельзя ставить коэффициенты в середину формулы:
2. Нельзя менять индексы в формуле:
3. Нельзя ставить коэффициенты, больше в кратное число раз:
Алгоритм расстановки коэффициентов в химических уравнениях
1. Начинай с большего: Zn + O → ZnO;
ОБОБЩЕНИЕ И СИСТЕМАТИЗАЦИЯ ИЗУЧЕННОГО
Робота в парах. Тренировочные упражнения на написание химических уравнений.
Превратить на химические уравнения такие схемы реакций:
Оценивание учащихся на уроке,
Понравилась ли вам ваша работа на уроке?
Выучить § по учебнику и изучить конспект в тетради
Составить формулы продуктов реакций (учитывая валентность химических элементов) и расставьте коэффициенты в схемах уравнений:
§ 14. Составление уравнений химических реакций
1. Что обозначает схема химической реакции? Чем она отличается от уравнения химической реакции?
Уравнение химической реакции – это условная запись реакции с помощью химических формул и знаков «+», «-», «=».
Схема показывает только формулы исходных и конечных веществ. Между ними ставят стрелку, не расставляют коэффициенты.
2. Почему число атомов каждого элемента в обеих частях химического уравнения должно быть одинаковым?
Составление химических уравнений основано на законе сохранения массы веществ при химических реакциях.
3. Какие из приведенных записей представляют собой схемы химических реакций, а какие — уравнения:
Схемы химических реакция – б, г; уравнения – а, в.
4. Перечислите основные действия, которые необходимо выполнить, чтобы составить уравнение химической реакции.
1. составить формулы исходных и конечных веществ.
2. формулы исходных веществ записать слева, конечных справа.
3. уравнять числа атомов каждого элемента до и после реакции.
4. поставить знак «=».
5. Составьте уравнения химических реакций, приняв во внимание, что в образующихся веществах азот проявляет валентность три, а сера — два: а) магний + азот; б) калий + сера; в) алюминий + азот; г) алюминий + сера.
6. Составьте уравнения химических реакций:
7. Вместо знака вопроса запишите формулы веществ и составьте уравнения химических реакций:
а) HgO → Hg + ?; б) H2O→ O2 + ?; в) P + O2 →?; г) Ca + O2 = ?; д) Fe + ? →FeCl3; е) Al + S → ?.
8. Для остановки кровотечения и дезинфекции раны ее обрабатывают раствором вещества Н2О2 (т. н. перекиси водорода). При контакте с кровью оно превращается в два новых вещества — Н2О и О2. Напишите уравнение соответствующей реакции.
9. Перечислите важнейшие химические реакции, протекающие в: а) природе; б) живых организмах; в) быту; г) промышленности.
а) образование озона при грозе, фотосинтез
б) расщепление питательных веществе с целью получения энергии, пищеварение, свёртываемость крови
в) приготовление творога, брожение сока, горение угля, прокисание молока
г) получение металлов из руд, переработка отходов, получение удобрений
http://kopilkaurokov.ru/himiya/uroki/urok_dlia_7_klassa_po_khimii_khimichieskiie_uravnieniia
http://superresheba.by/resh/54749