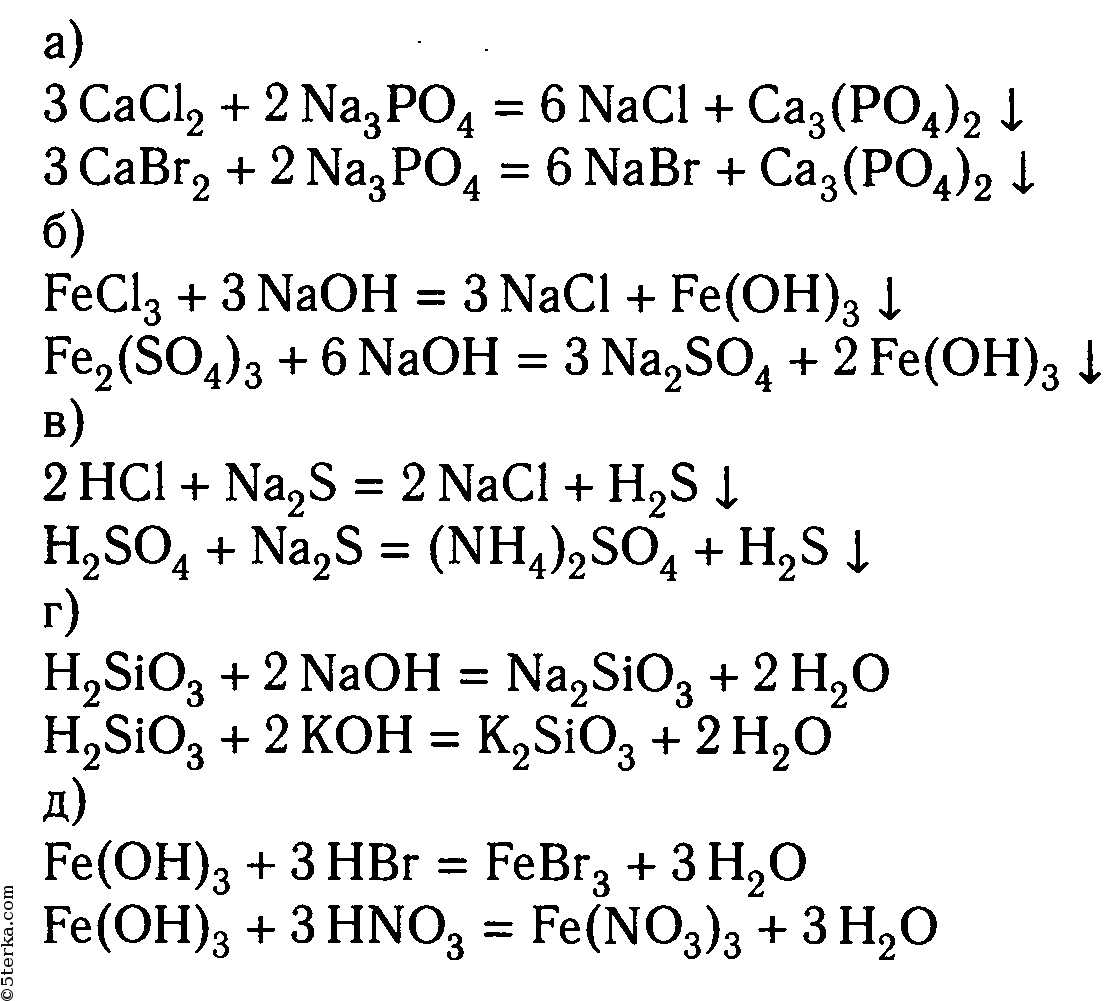5 Приведите по два молекулярных уравнения реакций для следующих ионных:

задача №5
к главе «Глава 6. Растворение. Растворы. Реакции ионного обмена и ОВР. § 37. Ионные уравнения».
Выделите её мышкой и нажмите CTRL + ENTER
Большое спасибо всем, кто помогает делать сайт лучше! =)
Нажмите на значок глаза возле рекламного блока, и блоки станут менее заметны. Работает до перезагрузки страницы.
Приведите по два молекулярных уравнения реакций, соответствующих сокращенным ионным уравнениям: а) Be(OH)2 + 2H+ → Be2+ + 2H2O;
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,299
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,247
- разное 16,834
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Приведите по два молекулярных уравнения реакций для следующих ионных.Прошу, если можно,
Приведите по два молекулярных уравнения реакций для последующих ионных.
Прошу, если можно, то с разъяснением к каждому уравнению как и что куда подставлять и тд. Это очень важно! Даю много баллов! Безотлагательно! Прошу!
- Анатолий Крысенко
- Химия 2019-03-04 22:01:04 0 1
Пояснять практически ничего не надобно, так как, чтобы было легче составлять молекулярные уравнения реакций, надобно сходу уяснить обычное верховодило: реакция идет до конца, если хотя бы один из продуктов реакции покидает обскурантистскую зону, то есть улетучивается в виде газа либо выпадает в осадок, если является плохорастворимым веществом. К примеру:
HSO + NaCO = NaSO + HCO. Также для того, чтобы решать ионное уравнение для тебя пригодится таблица растворимости( обязана быть в конце учебника либо же смотри в вебе). На базе таблицы сочиняют определённые реакции.
Например, перепишем схему реакции ионного размена на листочек.
MgCl + AgNO = Mg(NO) + AgCl
Далее мам нужно подобрать целочисленные коэффициенты перед формулами веществ. Нужно учитывать, что число атомов 1-го и того же элемента должно быть равно в левой и правой долях. Для нашего образца коэффициенты будут расставлены последующим образом:
MgCl + 2AgNO = Mg(NO) + 2AgCl
После того, как коэффициенты были расставлены, нужно определить слабенькие и сильные электролиты. Для этого необходимо знать, что все растворимые соли и основания сильные электролиты, а нерастворимые (они, как верховодило, выпадают в осадок, об этом нам говорит стрелочка вниз после формулы подходящей соли либо основания) слабенькие. К сильным кислотам относят: HBr, HI, HCl, HNO,HSO, HMnO, HCrO, HBrO, HClO, HClO и некие другие; другие кислоты слабенькие (необыкновенно угольная и сернистая: они в момент образования распадаются на, соответственно, углекислый или сернистый газ и воду). К слабеньким относят также металлы и неметаллы, оксиды, а также растворимое в воде основание NHOH гидроксид аммония. Потом подпишите под формулами (сл.) для слабых и (с.) для сильных электролитов. В нашем примере:
MgCl(с) + 2AgNO(с) = Mg(NO)(с) + 2AgCl(сл)
Зная, что сильные электролиты распадаются на ионы, а слабенькие нет, переписываем слабенькие электролиты без изменений, а у сильных показываем диссоциацию на ионы. К примеру:
Mg + 2Cl+ 2Ag + 2NO = Mg + 2NO + 2AgCl
Это и есть полное ионное уравнение.
После этого уменьшаем (зачеркиваем) одинаковые ионы и переписываем, получая сокращенное ионное уравнение:
2Cl + 2Ag = 2AgCl
Если в полученном уравнении можно сократить числовые коэффициенты, непременно это делаем:
Cl + Ag = AgCl
Запомните, что осадок и газ не подписываются в ионной форме, а остаются такими как были, добавляется только в зависимости от вещества стрелочка ввысь либо вниз. Вода ВСЕГДА не пишется в ионной и стрелочки ей НИКОГДА не надобно ставить. Так решаются и другие, итак, перейдём к решению Ваших реакций!
А) 2NaPO + 3CaCl = 6NaCl + Ca(PO)
6Na + 2PO + 3Ca + 6Cl = 6Na + 6Cl + Ca(PO)
Б) FeCl + 3NaOH = Fe(OH) + 3NaCl
Fe + 3Cl + 3Na + 3OH = Fe(OH) + 3Na + 3Cl
Fe + 3OH = Fe(OH)
В) KS + 2HCl = 2KCl + HS
2K + S + 2H + 2Cl = 2K + 2Cl + HS
Г) 2NaOH + HSiO = NaSiO + HO
2Na + 2OH + HSiO = 2Na + SiO + HO
2OH + HSiO = SiO + HO
Д) Fe(OH) + 3HCl = FeCl + 3HO
Fe(OH) + 3H+ 3Cl =Fe + 3Cl+ 3HO
Fe(OH) + 3H = Fe + 3H O
http://www.soloby.ru/468578/%D0%BF%D1%80%D0%B8%D0%B2%D0%B5%D0%B4%D0%B8%D1%82%D0%B5-%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D1%8B%D1%85-%D1%81%D0%BE%D0%BE%D1%82%D0%B2%D0%B5%D1%82%D1%81%D1%82%D0%B2%D1%83%D1%8E%D1%89%D0%B8%D1%85-%D1%81%D0%BE%D0%BA%D1%80%D0%B0%D1%89%D0%B5%D0%BD%D0%BD%D1%8B%D0%BC-%D1%83%D1%80%D0%B0%D0%B2%D0%BD%D0%B5%D0%BD%D0%B8%D1%8F%D0%BC
http://obrazovalka.com/qa/ximiya/3495631-privedite-po-dva-molekuljarnyh-uravnenija-reakcij-dlja-sledujushhih-ionnyhproshu-esli-mozhno-.html