Тепловой эффект химической реакции. Термохимические уравнения
Тепловой эффект химической реакции. Термохимические уравнения.
Химические реакции протекают либо с выделением теплоты, либо с поглощением теплоты.
Экзотермические реакции протекают с выделением теплоты (теплота указывается со знаком «+»). Эндотермические реакции – с поглощением теплоты (теплота Q указывается со знаком «–»).
Тепловой эффект химической реакции – это изменение внутренней энергии системы вследствие протекания химической реакции и превращения исходных веществ (реагентов) в продукты реакции в количествах, соответствующих уравнению химической реакции.
При протекании химических реакций наблюдаются некоторые закономерности, которые позволяют определить знак теплового эффекта химической реакции:
- Реакции, которые протекают самопроизвольно при обыных условиях, скорее всего экзотермические. Для запуска экзотермических реакций может потребоваться инициация – нагревание и др.
Например, после поджигания горение угля протекает самопроизвольно, реакция экзотермическая:
- Реакции образования устойчивых веществ из простых веществ экзотермические, реакции разложения чаще всего – эндотермические.
Например, разложение нитрата калия сопровождается поглощением теплоты:
- Реакции, в ходе которых из менее устойчивых веществ образуются более устойчивые, чаще всего экзотермические. И наоборот, образование более устойчивых веществ из менее устойчивых сопровождается поглощением теплоты. Устойчивость можно примерно определить по активности и стабильности вещества при обычных условиях. Как правило, в быту нас окружают вещества сравнительно устойчивые.
Например, горение амиака (взаимодействие активных, неустойчивых веществ — аммиака и кислорода) приводит к образованию устойчивых веществ – азота и воды. Следовательно, реакция экзотермическая:
Количество теплоты обозначают буквой Q, измеряют в кДж (килоджоулях) или Дж (джоулях).
Количество теплоты, выделяющейся в результате реакции, пропорционально количеству вещества, вступившего в реакцию.
В термохимии используются термохимические уравнения . Это уравнение реакции с указанием количества теплоты, выделившейся в ней (на число моль вещества, равное коэффициентам в уравнении).
Например, рассмотрим термохимическое уравнение сгорания водорода:
Из термохимического уравнения видно, что 484 кДж теплоты выделяются при сгорании 2 моль водорода, 1 моль кислорода. Также можно сказать, что при образовании 2 моль воды выделяется 484 кДж теплоты.
Теплота образования вещества – количество теплоты, выделяющееся при образовании 1 моль данного вещества из простых веществ.
Например, при сгорании алюминия:
теплота образования оксида алюминия равна 1675 кДж/моль. Если мы запишем термохимическое уравнение без дробных коэффициентов:
теплота образования Al2O3 все равно будет равна 1675 кДж/моль, т.к. в термохъимическом уравнении приведен тепловой эффект образования 2 моль оксида алюминия.
Теплота сгорания – количество теплоты, выделяющееся при горении 1 моль данного вещества.
Например, при горении метана:
теплота сгорания метана равна 802 кДж/моль.
Разберемся, как решать задачи на термохимические уравнения (задачи на термохимию) из ЕГЭ. Для этого разберем несколько примеров термохимических задач.
1. В результате реакции, термохимическое уравнение которой:
получено 98 л (н.у.) оксида азота (II). Определите количество теплоты, которое затратили при этом (в кДж). (Запишите число с точностью до целых.).
Решение.
Из термохимического уравнения видно, что на образование 2 моль оксида азота (II) потребуется 180 кДж теплоты. 2 моль оксида азота при н.у. занимают объем 44,8 л. Составляем простую пропорцию:
на получение 44,8 л оксида азота (II) затрачено 180 кДж теплоты,
на получение 98 л оксида азота затрачено х кДж теплоты.
Отсюда х= 180*98/44,8 = 393,75 кДж. Округляем ответ до целых, как требуется в условии: Q=394 кДж.
Ответ: потребуется 394 кДж теплоты.
2. В результате реакции, термохимическое уравнение которой
выделилось 1452 кДж теплоты. Вычислите массу образовавшейся при этом воды (в граммах). (Запишите число с точностью до целых.)
Решение.
Из термохимического уравнения видно, что при образовании 2 моль воды выделится 484 кДж теплоты. Масса 2 моль воды равна 36 г. Составляем простую пропорцию:
при образовании 36 г воды выделится 484 кДж теплоты,
при образовании х г воды выделится 1452 кДж теплоты.
Отсюда х= 1452*36/484 = 108 г.
Ответ: образуется 108 г воды.
3. В результате реакции, термохимическое уравнение которой
израсходовано 80 г серы. Определите количество теплоты, которое выделится при этом (в кДж). (Запишите число с точностью до целых).
Решение.
Из термохимического уравнения видно, что при сгорании 1 моль серы выделится 296 кДж теплоты. Масса 1 моль серы равна 32 г. Составляем простую пропорцию:
при сгорании 32 г серы выделится 296 кДж теплоты,
при сгорании 80 г серы выделится х кДж теплоты.
Отсюда х= 80*296/32 = 740 кДж.
Ответ: выделится 740 кДж теплоты.
Особенности термохимических уравнений.
Тепловые эффекты химических реакций
Тепловой эффект реакции —количество теплоты, которое выделяется или поглощается системой в результате протекания химической реакции. Это может быть DН (Р,Т = const) или DU (V,T = const).
Если в результате реакции теплота выделяется, т.е. энтальпия системы понижается (DН 0),называются эндотермическими.
Как и другие функции состояния, энтальпия зависит от количества вещества, поэтому ее велечену (DН) обычно относят к 1 моль вещества и выражают в кДж/моль.
Обычно функции системы определяют при стандартных условиях, в которые, кроме параметров стандартного состояния, входит стандартная температура T = 298,15 К (25°C). Часто температуру указывают в виде нижнего индекса ( 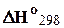
Термохимические уравнения
Термохимические уравнения реакций — уравнения, в которых указан тепловой эффект, условия реакций и агрегатные состояния веществ. Обычно в качестве теплового эффекта указывается энтальпия реакции. Например,
Тепловой эффект можно записать в уравнении реакции:
В химической термодинамике первая форма записи употребляется чаще.
Особенности термохимических уравнений.
1.Тепловой эффект зависит от массы реагирующего вещества, поэ-
тому его обычно рассчитывают на один моль вещества. В связи с этим в термохимических уравнениях можно использовать дробные коэффициенты. Например, для случая образования одного моля хлороводорода термохимическое уравнение записывается так:
или Н2 + Cl2 = 2HСl, DH 0 298 = -184 кДж.
2. Тепловые эффекты зависят от агрегатного состояния реагентов; оно указывается в термохимических уравнениях индексами: ж — жидкое, г — газообразное, т — твердое или к – кристаллическое, р – растворенное.
3.С термохимическими уравнениями можно производить алгебраические действия (их можно складывать, вычитать, умножать на любые коэффициенты вместе с тепловым эффектом).
Термохимические уравнения более полно, чем обычные, отражают происходящие при реакции изменения — они показывают не только качественный и количественный состав реагентов и продуктов, но и количественные превращения энергии, которыми данная реакция сопровождается.
Дата добавления: 2016-07-05 ; просмотров: 7806 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
КАК ВЫЧИСЛИТЬ ТЕПЛОВОЙ ЭФФЕКТ РЕАКЦИИ И СОСТАВИТЬ ЕЕ ТЕРМОХИМИЧЕСКОЕ УРАВНЕНИЕ
Вычислить тепловой эффект реакции важно для того, чтобы правильно организовать многие процессы на промышленных производствах. Это необходимо там, где используется подача энергии или где, наоборот, требуется ее отведение. Поскольку одни виды энергии могут превращаться в другие, то применение теплового эффекта химического взаимодействия позволяет превратить внутреннюю энергию веществ в работу (механическую, электрическую и т.д.).
С выделением или поглощением тепла идут процессы в живых организмах. Точный расчет тепловых эффектов превращения белков, жиров, углеводов и других веществ позволяет организовать правильную диету спортсменам, людям с теми или иными заболеваниями.
Содержание:
Что такое тепловой эффект химической реакции
Химические реакции практически всегда сопровождаются какими-либо тепловыми явлениями.
Так, горение, нейтрализация кислоты щелочью, реакция металла (например, магния) с хлором и т.д. происходят с выделением достаточного количества тепла. А вот, чтобы разложить мел (карбонат кальция), необходимо все время его нагревать. Если нагревание (то есть подвод тепла) прекратить, то и реакция тоже прекратится. Это говорит о том, что разложение карбоната кальция идет с поглощением тепла.
В чем же дело? Любое вещество является продуктом взаимодействия частиц (атомов или ионов). В ходе образования вещества энергия взаимодействия как бы прячется в химических связях (ковалентных, ионных). Это так называемая внутренняя энергия, которая частично высвобождается в ходе химического взаимодействия. Она же – тепловой эффект реакции. Измеряя его, можно судить о том, как изменилась внутренняя энергия вещества.
Тепловой эффект химической реакции обозначают буквой Q и измеряют в кДж (или в ккал в случае, когда речь идет об обеспечении энергией живых организмов).
Если в результате химического взаимодействия теплота выделяется, то это экзотермические реакции (+Q) ; если теплота поглощается – эндотермические (-Q) .
Как вычислить тепловой эффект реакции и
составить термохимическое уравнение
Взаимодействие веществ принято отражать (записывать) с помощью химического уравнения. Если в таком уравнении указан тепловой эффект, то тогда уравнение будет называться термохимическим .
Например, обычное уравнение реакции:
А это уже термохимическое уравнение данной реакции:
Уравнение говорит о том, что при взаимодействии 1 моля PbO с 1 молем СО, идущем с образованием 1 моля Pb и 1 моля CO2, выделяется 64 кДж теплоты.
Особенности термохимических уравнений:
1) указывается агрегатное состояние веществ (однако, если все вещества находятся в одном агрегатном состоянии, то его могут не указывать);
2) указывается тепловой эффект реакции в соответствии с ее стехиометрией (то есть, в соответствии с правильно расставленными коэффициентами);
3) тепловой эффект записывается в левой части уравнения;
4) если речь идет о горении вещества, то уравнение составляется по отношению к 1 молю этого вещества; тепловой эффект такой реакции называется теплотой сгорания:
5) если речь идет об образовании вещества, то уравнение также составляется по отношению к 1 молю этого вещества; тепловой эффект такой реакции будет называться теплотой образования:
А теперь разберем несколько задач, требованием которых является составление термохимического уравнения.
Что нужно сделать для решения таких задач?
1) записать условие задачи;
2) составить уравнение реакции;
3) вычислить ее тепловой эффект;
4) записать полученное значение теплового эффекта в уравнение реакции.
Пример 1. Кальций массой 8 г сгорает с выделением 127 кДж теплоты. Напишите термохимическое уравнение (тху) реакции.
Пример 2. При разложении 6,86 г оксида ртути (II) тратится 3,64 кДж тепловой энергии. Напишите термохимическое уравнение (тху) реакции.
Пример 3. Реакция 6 г углерода с водородом приводит к выделению 37,42 кДж теплоты. Напишите термохимическое уравнение (тху) реакции образования метана.
Расчеты по термохимическим уравнениям
В термохимических расчетах чаще используются уже готовые термохимические уравнения. Требуется найти массы/объемы образующихся/исходных веществ, количество выделившейся/поглощенной теплоты.
Рассмотрим несколько примеров.
Пример 4. По термохимическому уравнению: N2(г.) + O2(г.) = 2NO(г.) – 180,7 кДж вычислите тепловой эффект реакции, в которой участвует азот объемом 5,6 л (при н.у.).
Поскольку реакция эндотермическая, то поглотится 45,2 кДж энергии.
Пример 5. Тепловой эффект реакции горения этилена составляет 1400 кДж (в расчете на 1 моль этилена). Сколько этилена (при н.у.) необходимо сжечь, чтобы получить 560 кДж теплоты?
Пример 6. Пользуясь термохимическим уравнением сгорания пропана
определите количество выделившейся теплоты, если в реакцию вступит кислород: а) массой 16 г; б) объемом 67,2 л; в) количеством вещества 2,5 моль. Сколько оксида углерода (IV) по объему и по массе получится, если при горении пропана выделится 277,5 кДж теплоты?
Если вы готовитесь к выпускному экзамену ( ЕГЭ по химии ), то имейте ввиду, что вычислить тепловой эффект реакции требует задание № 27 (версия 2022 года ).
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
Пожалуйста, оцените публикацию 
http://poznayka.org/s29355t1.html
http://himzadacha.ru/vychislit-teplovoj-effekt-reakcii/














