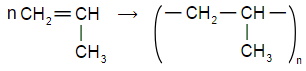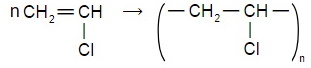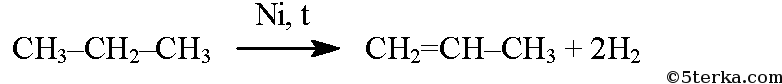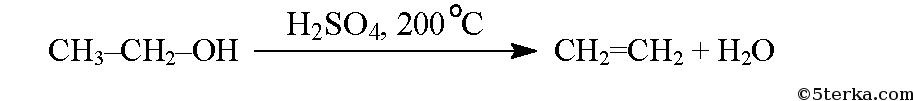Приведите уравнения химических реакций иллюстрирующих взаимопревращения
FOR-DLE.ru — Всё для твоего DLE 😉
Привет, я Стас ! Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
Задание 1
Определите молекулярную формулу алкена, молярная масса которого в три раза больше, чем у этилена.
Дано: M(CnH2n)/M(C2H4)=3
Найти: формулу CnH2n — ?
Решение
M(CnH2n)=3•M(C2H4)=3•28 г/моль=84 г/моль
M(CnH2n)=n • Ar(C)+2n • Ar(H)=n • 12+2n • 1=14 n
Имеем уравнение: 14n=84, n=84:14=6, следовательно формула имеет вид C6H12
Ответ: C6H12
Задание 2
Назовите этиленовый углеводород по международной номенклатуре. 2-метилпропен
Задание 3
Каковы основные источники промышленного получения этиленовых углеводородов? Крекинг нефти (термический, каталитический) и пиролиз (сильное нагревание) алканов.
Задание 5
Как отличить друг от друга этан и этилен? Этилен, в отличие от этана, обесцвечивает бромную воду и раствор перманганата калия.
Напишите уравнение реакции.
CH2=CH2 + Br2 H₂O ⟶ BrCH2 — CH2Br
CH2=CH2 + [O] + H2O ⟶ CH2OH — CH2OH
Задание 6
В чём состоит основное отличие химических свойств предельных и непредельных углеводородов? Непредельные углеводороды, в отличие от предельных, способны к реакциям присоединения по кратной связи.
Задание 7
Напишите уравнения реакций пропена с водородом, бромом, хлороводородом и водой. Помните, что присоединение несимметричных реагентов происходит по правилу Марковникова.
CH3 — CH=CH2 + H2 кат. ⟶ CH3 — CH2 — CH3
CH3 — CH=CH2 + Br2 ⟶ CH3 — CHBr — CH2Br
CH3 — CH=CH2 + HCl ⟶ CH3 — CHCl — CH3
Задание 8
С каким жидким веществом при обычных условиях реагируют как алканы, так и алкены? С бромом.
Чем отличаются эти реакции? Реакция брома с алканами является реакцией замещения, а с алкенами — реакцией присоединения.
Задание 9
Объясните, почему химические свойства полиэтилена отличаются от свойств этилена. Полиэтилен, в отличие от этилена, не содержит кратных связей, поэтому для него характерны химические свойства предельных алканов.
Задание 10
Напишите уравнение реакции полимеризации:
а) пропена;
б) 1-хлорэтена.
Задание 11
Используя Интернет, подготовьте сообщение об областях применения и свойствах одного из полимеров:
1) полиэтилен,
Применение: производство плёнки, различной тары, труб, электроизоляции, термоклея, брони.
Свойства: малопрозрачное вещество, значительно легче воды (плотность примерно 0,92 г/см 3 ) , плохо проводит теплоту и электрический ток, при нагревании размягчается (80°C—120°C) , на ошупь немного жирный, напоминает парафин.
2) полипропилен,
Применение: производство мешков, тары, труб, деталей технической аппаратуры, пластиковых стаканчиков, плёнки для парников, теплиц, предметов домашнего обихода, нетканых материалов, электроизоляционного материала, в строительстве для вибро- и шумоизоляции.
Свойства: обладает большей механической прочностью (стойкий к стиранию) , более термостойкий (начинает размягчаться при 140°С, температура плавления 175°С) , почти не подвергается коррозионному растрескиванию.
3) поливинилхлорид.
Применение: производство линолеума, изоляционной ленты, непромокаемых плащей, искусственных кож, поливинилхлоридного волокна, грязезащитных ковриков, обувных пластикатов, мебельной кромки.
Свойства: отличается химической стойкостью к щелочам, минеральным маслам, многим кислотам и растворителям, в чистом виде не поддерживает горение на воздухе, обладает малой морозостойкостью (-15°C) и нагревостойкостью (66°C) .
Задание 12
При взаимодействии этилена с бромом образовалось 37,6 г дибромэтана. Какой объём этилена (н.у.) вступил в реакцию?
Дано: m(C2H4Br2)=37,6 г
Найти: V(C2H4)-?
Решение
1-й способ
Mr(C2H4Br2)=2•Ar(C)+4•Ar(H)+2•Ar(Br)= 2•12+4•1+2•80= 188, поэтому M(C2H4Br2)=1 88 г/моль
n( C2H4Br2 )=m( C2H4Br2 )/M( C2H4Br2 )=37,6 г : 188 г/моль=0,2 моль
Составляем уравнение реакции: C2H4 + Br2 ⟶ C2H4Br2
По уравнению реакции n(C2H4)/1=n(C2H4Br2)/1, поэтому
n( C2H4 )=n( C2H4Br2 )=0,2 моль
V( C2H4 )=n( C2H4 )•Vm=0,2 моль • 22,4 л/моль=4,48 л
2-й способ
1. Составим химическое уравнение:
х л 37,6 г
C2H4 + Br2 ⟶ C2H4Br2
22,4 л 188 г
Над формулами соединений C2H4 и C2H4Br2 записываем неизвестный объем этилена (х л) и приведенную в условии задачи массу дибромэтана (37,6 г), а под формулами соединений ― массу и объём соответствующего количества вещества согласно коэффициентам в химическом уравнении. При н.у. 1 моль газа при н.у. занимает объем 22,4 л.
Mr(C2H4Br2)=2•Ar(C)+4•Ar(H)+2•Ar(Br)= 2•12+4•1+2•80= 188, поэтому M(C2H4Br2)=1 88 г/моль
2. Объём этилена рассчитываем с помощью пропорции:
х л / 22,4 л = 37,6 г / 188 г, отсюда
х=V( C2H4 )=22,4 л • 37,6 г : 188 г=4,48 л
Ответ: V( C2H4 )=4,48 л
Конспект урока в 10 классе на тему «Взаимосвязь и взаимопревращения гомологических рядов углеводородов»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Тема урока. Взаимосвязь и взаимопревращения гомологических рядов углеводородов.
Цель: обобщить и систематизировать знания по теме «Углеводороды»; о взаимосвязи состава – строения – свойств органических веществ на примере углеводородов и их гомологических рядов; развивать умения анализировать, сравнивать, выделять главное, делать выводы, устанавливать причинно — следственную генетическую взаимосвязь между углеводородами и их гомологическими рядами, работать по алгоритму и с другими источниками знаний; проводить классификацию; развивать способность учащихся к химическому прогнозированию и умению решать задачи с применением генетической взаимосвязи; раскрыть мировоззренческие идеи о взаимосвязи состава, строения, свойств веществ ; познавательную активность, используя нестандартные задания; воспитывать интеллектуально развитую личность, культуру общения, умения высказывать свои взгляды и суждения, работать в группе; чувство ответственности за полученные знания, коммуникабельность.
Оборудование: ноутбук, мультимедийный проектор, презентация, карточки с заданиями, учебные пособия, схемы.
Тип урока : урок обобщения и систематизации полученных знаний.
объяснительно-иллюстративные:
– фронтальная беседа;
– объяснение учителя.
практические:
– составление схем превращений и их выполнение.
дедуктивные:
– от известного к неизвестному;
– от простого к сложному.
работа по карточкам.
Углеводороды – все такие разные –
Жидкие и твердые, и газообразные.
Почему так много их в природе?
Дело – в ненасытном углероде!
Взаимное приветствие друг друга, фиксация отсутствующих, проверка готовности к уроку.
2. Актуализация опорных знаний.
Учитель. Мы закончили изучение темы «Углеводороды». На прошлом уроке мы сравнили состав, строение, свойства изученных классов углеводородов и заполнили обобщающую таблицу. Давайте вспомним основные вопросы изученной темы.
Прием «Мозговой штурм»
1. Какие органические вещества относят к углеводородам?
2.Какова валентность углерода в органических соединениях?
3.Какие углеродные цепи существуют в молекулах углеводородов?
4.Какие виды углерод — углеродных связей существуют в молекулах углеводородов?
Задание. Распределить по классам в правильной последовательности указанные углеводороды и записать их общие формулы.
Предельные Непредельные Циклические
Алкадиены Алканы Циклоалканы Алкины Арены Алкены
Сравните составленную схему с указанной на слайде
Предельные Непредельные Циклические
№15. Согласно схеме 2 приведите уравнения химических реакций.
При взаимодействии предельных углеводородов с галогенами образуются галогенопроизводные углеводородов:
Галогенопроизводные углеводородов реагируют с натрием, при этом образуются предельные углеводороды, содержащие в молекуле вдвое больше атомов углерода, чем исходное галогенопроизводное (реакция Вюрца):
При отщеплении водорода от предельных углеводородов образуются углеводороды ряда этилена, или алкены (реакция дегидрирования):
При присоединении водорода к алкенам образуются предельные углеводороды (реакция гидрирования):
Под действием спиртового раствора щелочи от галогенопроизводных отщепляется галогеноводород, при этом образуются непредельные углеводороды:
При присоединении галогеноводородов к непредельным углеводородам образуются галогенопроизводные, присоединение протекает по правилу Марковникова:
В присутствии кислот алкены присоединяют воду, при этом образуются спирты. Присоединение воды также происходит по правилу Марковникова:
При сильном нагревании в присутствии серной кислоты от спиртов отщепляется вода, при этом образуются алкены:

задача №15
к главе «Глава IV. Непредельные углеводороды (алкены, алкадиены и алкины) §1 (стр. 39) Вопросы».
http://infourok.ru/konspekt-uroka-v-klasse-na-temu-vzaimosvyaz-i-vzaimoprevrascheniya-gomologicheskih-ryadov-uglevodorodov-3646918.html
http://5terka.com/node/4503