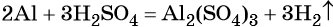Химическая реакция. Условия и признаки протекания химических реакций. Химические уравнения. Сохранение массы веществ при химических реакциях
Химической реакцией называют взаимодействия, приводящие к изменению химической природы участвующих в них частиц. При этом происходит изменение их состава и (или) строения. В химических реакциях могут участвовать атомы, молекулы, ионы и радикалы.
В ходе химических реакций атомные ядра не затрагиваются и число атомов каждого химического элемента сохраняется.
Химические реакции протекают при определённых условиях (температура, давление, наличие или отсутствие растворителя, катализа, ультрафиолетовое излучение).
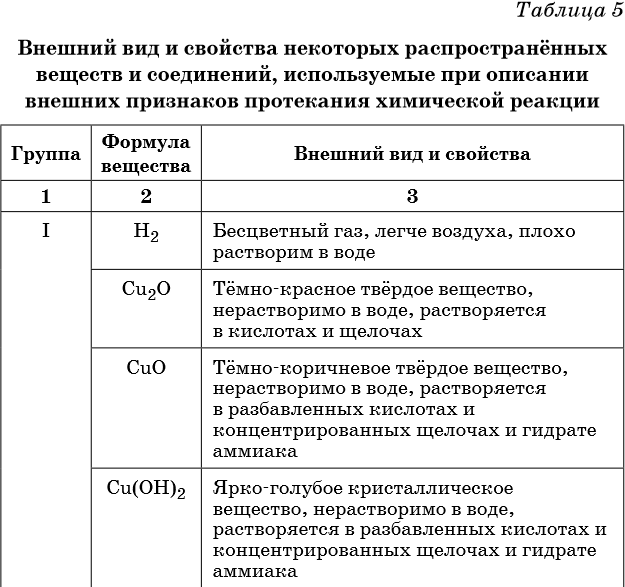
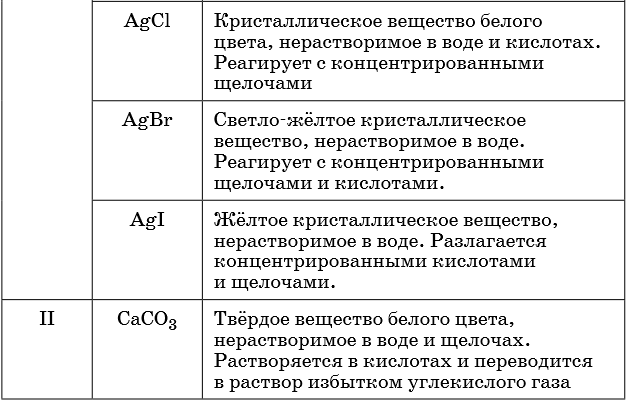
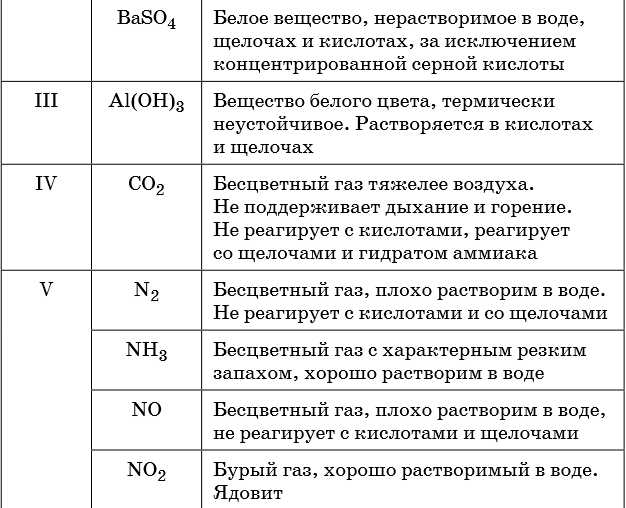
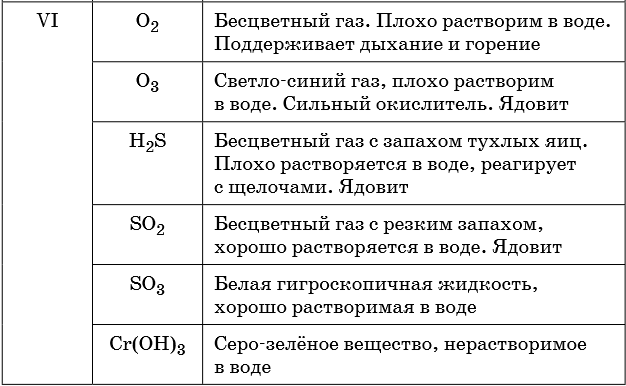
Признаками протекания химических реакций являются выделение или поглощение газа, образование или растворение осадка, изменение цвета, выделение или поглощение теплоты.
Описание качественных реакций, используемых для определения некоторых катионов и анионов, приводится в приложении в конце урока.
В таблице 5 представлены сведения о внешнем виде и свойствах некоторых распространённых веществ и соединений, используемых при описании внешних признаков протекания химической реакции.
Для описания химических реакций используют химические уравнения, в левой части которых указывают исходные вещества, а в правой — продукты реакции. Обе части химического уравнения соединяют стрелкой (в случае необратимых химических превращений), а если химическая реакция является обратимой, то это показывают с помощью прямой и обратной стрелок.
В неорганической химии, если количество атомов химических элементов в левой и правой частях уравнено с помощью стехиометрических коэффициентов, части уравнения часто соединяют знаком равенства.
Стехиометрией называют учение о количественных соотношениях между реагентами и продуктами реакции.
Коэффициенты стехиометрические — действительные натуральные (то есть положительные, как правило, целые) числа, стоящие перед формулой химического вещества в уравнении реакции. Коэффициенты показывают минимальное количество структурных единиц вещества (атомов, молекул, ионов, радикалов), участвующих в данной реакции.
В вышеприведённой реакции два атома алюминия реагируют с тремя молекулами серной кислоты, в результате чего образуется одна молекула сульфата алюминия (коэффициент, равный одному, перед формулой не ставят) и три молекулы водорода.
В соответствии с законом сохранения массы (закон Ломоносова — Лавуазье) масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции.
Этот закон подтверждает, что атомы являются неделимыми и в ходе химических реакций не изменяются. Молекулы при реакциях претерпевают изменения, но общее число атомов каждого вида не изменяется, и поэтому общая масса веществ в процессе реакции сохраняется.
Тренировочные задания
1. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) растворение осадка
2) выделение чёрного осадка
3) отсутствие внешних признаков
4) выделение синего осадка
2. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) растворение осадка
3) выделение белого осадка
4) выделение синего осадка
3. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение жёлто-зелёного газа
3) выделение жёлтого осадка
4) растворение осадка
4. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) появление оранжевой окраски
2) выделение газа с характерным запахом
3) растворение осадка
4) отсутствие внешних признаков
5. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) отсутствие внешних признаков
3) выделение белого осадка
4) выделение чёрного осадка
6. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) AgNO3 и NaI
Б) Zn и KOH
В) HCl и FeS
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) выделение газа с характерным запахом
3) выделение бесцветного газа
4) выделение чёрного осадка
7. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение газа с характерным запахом
3) выделение белого осадка
4) растворение осадка
8. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
9. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение синего осадка
2) растворение осадка
3) выделение белого осадка
4) выделение бурого осадка
10. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) AgNO3 и NaI
Б) Al и NaOH
В) HCl и K2SO3
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение жёлтого осадка
11. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) отсутствие внешних признаков
12. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) Cu и HNO3 (конц.)
Б) Cu и H2SO4 (конц.)
В) BaCO3 и HCl
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение бесцветного газа
13. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
14. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого осадка
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
15. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа
3) выделение белого осадка
4) выделение чёрного осадка
16. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
17. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение чёрного осадка
18. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа с характерным запахом
3) выделение белого осадка
4) растворение осадка
19. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа с характерным запахом
3) выделение белого осадка
4) выделение студенистого бесцветного осадка
20. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение жёлтого осадка
Химические реакции: типы, свойства, уравнения
Содержание:
Характеристика реакций
Химические реакции, их свойства, типы, условия протекания и прочая, являются одним из краеугольных столпов интересной науки под названием химия. Попробуем же разобрать что такое химическая реакция, и какова ее роль. Итак, химической реакцией в химии принято считать превращение одного либо нескольких веществ, в другие вещества. При этом ядра атомов у них не меняются (в отличие от реакций ядерных), зато происходит перераспределение электронов и ядер, и, разумеется, появляются новые химические элементы.
Реакции в природе и быту
Мы с вами окружены химическими реакциями, более того мы сами их регулярно осуществляем различными бытовыми действиями, когда например, зажигаем спичку. Особенно много химических реакций сами того не подозревая (а может и подозревая) делают повара, когда готовят еду.
Разумеется, и в природных условиях проходит множество химических реакций: извержение вулкана, фотосинтез листвы и деревьев, да что там говорить, практически любой биологический процесс можно отнести к примерам химических реакций.
Типы реакций
Все химические реакции можно условно разделить на простые и сложные. Простые химические реакции, в свою очередь, разделяются на:
- реакции соединения,
- реакции разложения,
- реакции замещения,
- реакции обмена.
Далее мы подробно остановимся на каждом из этих видов химических реакций, известных химии.
Реакция соединения
По весьма меткому определению великого химика Д. И. Менделеева реакция соединения имеет место быть когда «их двух веществ происходит одно». Примером химической реакции соединения может быть нагревание порошков железа и серы, при которой из них образуется сульфид железа – Fe+S=FeS. Другим ярким примеров этой реакции является горение простых веществ, таких как сера или фосфор на воздухе (пожалуй, подобную реакцию можно также назвать тепловой химической реакцией).
Реакция разложения
Тут все просто, реакция разложения является противоположностью реакции соединения. При ней из одного вещества получается два или более веществ. Простым примером химической реакции разложения может быть реакция разложение мела, в ходе которой из собственно мела образуется негашеная известь и углекислый газ.
Реакция замещения
Реакция замещения осуществляется при взаимодействии простого вещества со сложным. Приведем пример химической реакции замещения: если опустить стальной гвоздь в раствор с медным купоросом, то в ходе этого простого химического опыта мы получим железный купорос (железо вытеснит медь из соли). Уравнение такой химической реакции будет выглядеть так:
Реакция обмена
Реакции обмена проходят исключительно между сложными химическими веществами, в ходе которых они меняются своими частями. Очень много таких реакций имеют место быть в различных растворах. Нейтрализация кислоты желчью – вот хороший пример химической реакции обмена.
Так выглядит химическое уравнение этой реакции, при ней ион водорода из соединения HCl обменивается ионом натрия из соединения NaOH. Следствием этой химической реакции является образование раствора поваренной соли.
Признаки реакций
По признакам протекания химических реакций можно судить прошла ли химическая реакция между реагентами или нет. Приведем примеры признаков химических реакций:
- Изменение цвета (светлое железо, к примеру, во влажном воздухе покрывается бурым налетом, как результат химической реакции взаимодействия железа и кислорода).
- Выпадение осадка (если вдруг через известковый раствор пропустить углекислый газ, то получим выпадение белого нерастворимого осадка карбоната кальция).
- Выделение газа (если Вы капнете на пищевую соду лимонной кислотой, то получите выделение углекислого газа).
- Образование слабодиссоциированных веществ (все реакции, в результате которых образуется вода).
- Свечение раствора (примером тут могут служить реакции, происходящие с раствором люминола, излучающего при химических реакциях свет).
В целом, трудно выделить какие признаки химических реакций являются основными, для разных веществ и разных реакций характерны свои признаки.
Как определить признак реакции
Определить признак химической реакции можно визуально (при изменении цвета, свечении), или по результатам этой самой реакции.
Скорость реакции
Под скоростью химической реакции обычно понимают изменение количества одного из реагирующих веществ за единицу времени. Притом, скорость химической реакции всегда положительная величина. В 1865 году химиком Н. Н. Бекетовым был сформулирован закон действия масс гласящий, что «скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведенным в степени, равные их стехиометрическим коэффициентам».
К факторам скорости химической реакции можно отнести:
- природу реагирующих веществ,
- наличие катализатора,
- температуру,
- давление,
- площадь поверхности реагирующих веществ.
Все они имеют самое прямое влияние на скорость протекания химической реакции.
Равновесие реакции
Химическим равновесием называют такое состояние химической системы, при котором протекает несколько химических реакций и скорости в каждой паре прямой и обратной реакции равны между собой. Таким образом, выделяется константа равновесия химической реакции – это та величина, которая определяет для данной химической реакции соотношение между термодинамическими активностями исходных веществ и продуктов в состоянии химического равновесия. Зная константу равновесия можно определить направление протекания химической реакции.
Условия возникновения реакций
Чтобы положить начало химических реакций, необходимо для этого создать соответствующие условия:
- приведение веществ в тесное соприкосновение.
- нагревание веществ до определенной температуры (температура химической реакции должна быть подходящей).
Тепловой эффект химической реакции
Так называют изменение внутренней энергии системы как результат протекания химической реакции и превращения исходных веществ (реактантов) в продукты реакции в количествах, соответствующих уравнению химической реакции при следующих условиях:
- единственно возможной работой при этом есть только лишь работа против внешнего давления.
- исходные вещества и продукты, полученные в результате химической реакции, имеют одинаковую температуру.
Видео
И в завершение интересно видео про самые удивительные химические реакции.
Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.
Эта статья доступна на английском языке – Chemical Reactions.
Похожие посты:
4 комментария
Спасибо за статью, хотелось бы также больше узнать про химические реакции ферментов и необратимые химические реакции.
Пожалуй эти темы заслуживают отдельной статьи.
1. Вы пишете: “Зная константу равновесия можно определить направление протекания химической реакции.” Одного знания константы равновесия бывает недостаточно. В общем случае, необходимо знать еще концентрации веществ.
2. Про тепловой эффект реакции сразу видно, что переписан без пояснений соответствующий абзац из учебника. Может даже не школьного. Но народу будет не до конца понятно.
3. В начале статьи вы заикаетесь о биохимических реациях и далее даже говорите о том, что есть сложные реакции. И далее не слова про них. Интуитивно понятно, что сложные реакции это совокупность нескольких. Но по хорошему надо бы хотя бы обозначить определение. И пару предложений сказать про биохимические реакции
4. Вы пишете: “К факторам скорости химической реакции можно отнести:
природу реагирующих веществ,
наличие катализатора,
температуру,
давление,
площадь поверхности реагирующих веществ.
Все они имеют самое прямое влияние на скорость протекания химической реакции.” Перфекционисту, такое утверждение будет резать слух. Например, вы ничего не говорите о концентрациях, а также не разделяете гомогенные и гетерогенные реакции-для них немного разный набор влияющих факторов. Некоторые из указанных вами факторов не так сильно влияют на скорость (если влияют вообще).
4. Указывая признаки протекания химической реакции вы выделяете яркие, заметные но не всегда проявляемые факторы, а также не эти признаки являются фундаментальным признаком протекания химической реакции. Таковым является изменение количества(концентрации) реагирующих веществ. И именно эти изменения фиксируют, т.н. кинетические кривые, снимаемые по ходу реакции графики зависимости какого-либо параметра от количества вещества.
5. Если уж вас спросили в комментариях, и вы сами вкратце касаетесь понятия химического равновесия и т.н. константы равновесия можете в дальнейшем указать, что необратимые это те реакции, у которых очень большое значение константы равновесия.
И еще предложение “При этом ядра атомов у них не меняются (в отличие от реакций ядерных), зато происходит перераспределение электронов и ядер, и, разумеется, появляются новые химические элементы.” Перечитайте! Кто отличает ядерные реакции от химических (условно говоря, 90% школьников) им это предложение ни к чему. А кто захочет разобраться (те самые 10% кто не различает ядерные и химические реакции) они ничего не поймут!
Протекание химических реакций
Содержание:
К условиям возникновения и протекания химической реакции относится: приведение реагирующих веществ в соприкосновение (контакт реагирующих веществ); нагревание до определённой температуры; освещение. Для того чтобы вещества вступили в химическую реакцию, они должны соприкасаться друг с другом.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Признаки и условия протекания химических реакций
Химической реакцией называют взаимодействия, приводящие к изменению химической природы участвующих в них частиц. При этом происходит изменение их состава и (или) строения. В химических реакциях могут участвовать атомы, молекулы, ионы и радикалы.
В ходе химических реакций атомные ядра не затрагиваются и число атомов каждого химического элемента сохраняется.
Химические реакции протекают при определённых условиях (температура, давление, наличие или отсутствие растворителя, катализа, ультрафиолетовое излучение).
Признаками протекания химических реакций являются выделение или поглощение газа, образование или растворение осадка, изменение цвета, выделение или поглощение теплоты.
Описание качественных реакций, используемых для определения некоторых катионов и анионов, приводится в приложении в конце урока.
Превращения энергии при химических реакциях
Химические реакции протекают с выделением или с поглощением энергии. Обычно эта энергия выделяется или поглощается в виде теплоты. Так, горение, соединение металлов с серой или с хлором, нейтрализация кислот щелочами сопровождаются выделением значительных количеств теплоты. Наоборот, такие реакции, как разложение карбоната кальция, образование оксида азота(II) из азота и кислорода, требуют для своего протекания непрерывного притока теплоты извне и тотчас же приостанавливаются, если нагревание прекращается. Ясно, что эти реакции протекают с поглощением теплоты.
Выделение теплоты при взаимодействии различных веществ заставляет признать, что эти вещества еще до реакции в скрытой форме обладали определенной энергией. Такая форма энергии, скрытая в веществах и освобождающаяся при химических, а также при некоторых физических процессах (например, при конденсации пара в жидкость или при кристаллизации жидкости), называется внутренней энергией вещества (см. также § 66).
При химических превращениях освобождается часть содержащейся в веществах энергии. Измеряя количество теплоты, выделяющееся при реакции (так называемый тепловой эффект реакции), мы можем судить об изменении этого запаса.
При некоторых реакциях наблюдается выделение или поглощение лучистой энергии. Обычно в тех случаях, когда при реакции выделяется свет, внутренняя энергия превращается в излучение не непосредственно, а через теплоту. Например, появление света при горении угля является следствием того, что за счет выделяющейся при реакции теплоты уголь раскаляется и начинает светиться. Но известны процессы, в ходе которых внутренняя энергия превращается в лучистую непосредственно. Эти процессы носят название холодного свечения или люминесценции. Большое значение имеют процессы взаимного превращения внутренней и электрической энергии (см. § 98). При реакциях, протекающих со взрывом, внутренняя энергия превращается в механическую — частью непосредственно, частью переходя сперва в теплоту.
Итак, при химических реакциях происходит взаимное превращение внутренней энергии веществ, с одной стороны, и тепловой, лучистой, электрической или механической энергии, с другой. Реакции, протекающие с выделением энергии, называют экзотермическими, а реакции, при которых энергия поглощается, — эндотермическими.
Термохимия
Энергетические изменения, сопровождающие протекание химических реакций, имеют большое практическое значение. Иногда они даже важнее, чем происходящее при данной реакции образование новых веществ. В качестве примера достаточно вспомнить реакции горения топлива. Поэтому тепловые эффекты реакций уже давно тщательно изучаются. Раздел химии, посвященный количественному изучению тепловых эффектов реакций, получил название термохимии.
В конце XVIII века было установлено, что если при образовании какого-либо соединения выделяется (или поглощается) некоторое количество теплоты, то при разложении этого соединения в тех же условиях такое же количество теплоты поглощается (или выделяется). Это положение вытекает из закона сохранения энергии; из него следует, что чем больше теплоты выделяется при образовании того или иного соединения, тем больше энергии надо затратить на его разложение. Поэтому вещества, при образовании которых выделяется большое количество теплоты, весьма прочны и трудно разлагаются.
Результаты термохимических измерений — тепловые эффекты реакций — принято относить к одному молю образующегося вещества. Количество теплоты, которое выделяется при образовании одного моля соединения из простых веществ, называется теплотой образования данного соединения. Например, выражение «теплота образования жидкой воды равна 285,8 кДж/моль» означает, что при образовании 18 г жидкой воды из 2 г водорода и 16 г кислорода выделяется 285,8 кДж.
Если элемент может существовать в виде нескольких простых веществ, то при расчете теплоты образования этот элемент берется в виде того простого вещества, которое при данных условиях наиболее устойчиво. Теплоты образования наиболее устойчивых при данных условиях простых веществ принимаются равными нулю. Теплоты же образования менее устойчивых простых веществ равны теплотам их образования из устойчивых. Например, при обычных условиях наиболее устойчивой формой кислорода является молекулярный кислород О2, теплота образования которого считается равной нулю. Теплота же образования озона О3 равна —142 кДж/моль, поскольку при образовании из молекулярного кислорода одного моля озона поглощается 142 кДж.
Тепловые эффекты можно включать в, уравнения реакций. Химические уравнения, в которых указано количество выделяющейся или поглощаемой теплоты, называются термохимическими уравнениями. Величина теплового эффекта указывается обычно в правой части уравнения со знаком плюс в случае экзотермической реакции и со знаком минус в случае эндотермической реакции. Например, термохимическое уравнение реакции образования жидкой воды имеет вид:
Теплота образования оксида азота(II) отрицательна и равна —90,25 кДж/моль. Соответствующее термохимическое уравнение имеет вид:
Важнейшей характеристикой веществ, применяемых в качестве топлива, является их теплота сгорания. Эту величину также принято относить к одному молю вещества. Таким образом, выражение «теплота сгорания ацетилена равна 1300 кДж/моль» эквивалентно термохимическому уравнению:
Величина теплового эффекта зависит от природы исходных веществ и продуктов реакции, их агрегатного состояния и температуры. Для удобства сравнения различных реакций по величинам их тепловых эффектов последние обычно указывают для случая, когда температура исходных веществ и продуктов реакции равна 25°С*. При этом также подразумевается, что участвующие в реакции вещества находятся в том агрегатном состоянии, которое устойчиво при этой, так называемой стандартной температуре. Если, однако, представляет интерес теплота образования вещества находящегося в другом агрегатном состоянии, чем то, в котором оно устойчиво при 25 °С, то это состояние указывается в уравнении реакции. При этом кристаллическое состояние обозначается знаком (к) около формулы вещества, жидкое—(ж), газообразное — (г). Так, теплота образования водяного пара равна 241,8 кДж/моль; соответствующее термохимическое уравнение имеет вид:
* Все тепловые эффекты, приводимые в данной книге, в том числе теплоты образования веществ, относятся к 25 °С,
Ясно, что разность между теплотой образования жидкой воды (285,8 кДж/моль) и водяного пара (241,8 кДж/моль) представляет собой отнесенную к одному молю (18 г) теплоту испарения воды при 25 °С.
Термохимические расчеты
Основной принцип, на котором основываются все термохимические расчеты, установлен в 1840 г. русским химиком акад. Г. И. Гессом. Этот принцип, известный под названием закона Гесса и являющийся частным случаем закона сохранения энергии, можно сформулировать так:
Тепловой эффект реакции зависит только от начального и конечного состояния веществ и не зависит от промежуточных стадий процесса.
Рассмотрим пример, поясняющий закон Гесса. Раствор сульфата натрия можно приготовить из растворов серной кислоты и гидроксида натрия двумя способами:
1. Смешать раствор, содержащий два моля NaOH, с раствором, содержащим один моль H2SO4.
2. Смешать раствор, содержащий один моль NaOH, с раствором, содержащим один моль H2SO4, и к полученному раствору кислой соли (NaHSO4) добавить раствор, содержащий еще один моль NaOH.
Запишем термохимические уравнения этих реакций.
Символ (водн.) означает, что вещество взято в виде водного раствора.
Согласно закону Гесса, тепловой эффект в обоих случаях должен быть одним и тем же. Действительно, складывая тепловые эффекты, отвечающие двум стадиям второго способа, получаем тот же суммарный тепловой эффект, который наблюдается при первом способе проведения процесса: 61,7 + 69,7 = =131,4 кДж.
Таким образом, подобно обычным уравнениям химических реакций, термохимические уравнения можно складывать.
Закон Гесса дает возможность вычислять тепловые эффекты реакции в тех случаях, когда их непосредственное измерение почему-либо неосуществимо. В качестве примера такого рода расчетов рассмотрим вычисление теплоты образования оксида углерода (II) из графита и кислорода. Измерить тепловой эффект реакции
очень трудно, потому что при сгорании графита в ограниченном количестве кислорода получается не оксид углерода (II), а его смесь с диоксидом углерода. Но теплоту образования СО можно вычислить, зная его теплоту сгорания (283,0 кДж/моль) и теплоту образования диоксида углерода (393,5 кДж/моль).
Горение графита выражается термохимическим уравнением:
Для вычисления теплоты образования СО запишем эту реакцию в виде двух стадий
и сложим термохимические уравнения, отвечающие этим стадиям. Получим суммарное уравнение:
С(графит) + О2 = СО2 + (х + 283,0) кДж
Согласно закону Гесса, тепловой эффект этой суммарной реакции равен тепловому эффекту реакции непосредственного сгорания графита, т. е. х + 283,0 = 393,5. Отсюда х = 110,5 кДж или
Рассмотрим еще один пример применения закона Гесса. Вычислим тепловой эффект реакции сгорания метана СН4, зная теплоты образования метана (74,9 кДж/моль) и продуктов его сгорания — диоксида углерода (393,5 кДж/моль) и воды (285,8 кДж/моль). Для вычисления запишем реакцию горения метана сначала непосредственно, а затем разбив на стадии. Соответствующие термохимические уравнения будут иметь вид:
Складывая последние три термохимические уравнения, отвечающие проведению реакции по стадиям, получим суммарное уравнение горения метана:
Согласно закону Гесса, —74,9 + 393,5 + 571,6 — х, откуда теплота сгорания метана х = 890,2 кДж.
Рассмотренный пример иллюстрирует практически важное следствие закона Гесса: тепловой эффект химической реакции равен сумме теплот образования получающихся веществ за вычетом суммы теплот образования исходных веществ. Оба суммирования производятся с учетом числа молей участвующих в реакции веществ в соответствии с ее уравнением.
Скорость химической реакции
Химические реакции протекают с различными скоростями. Некоторые из них полностью заканчиваются за малые доли секунды, другие осуществляются за минуты, часы, дни; известны реакции, требующие для своего протекания несколько лет, десятилетий и еще более длительных отрезков времени. Кроме того, одна и та же реакция может в одних условиях, например, при повышенных температурах, протекать быстро, а в других, — например, при охлаждении, — медленно; при этом различие в скорости одной и той же реакции может быть очень большим.
Знание скоростей химических реакций имеет очень большое научное и практическое значение. Например, в химической промышленности при производстве того или иного вещества от скорости реакции зависят размеры и производительность аппаратуры, количество вырабатываемого продукта.
При рассмотрении вопроса о скорости реакции необходимо различать реакции, протекающие в гомогенной системе (гомогенные реакции), и реакции, протекающие в гетерогенной системе (гетерогенные реакции).
Системой в химии принято называть рассматриваемое вещество или совокупность веществ. При этом системе противопоставляется внешняя среда. — вещества, окружающие систему. Обычно система физически отграничена от среды.
Различают гомогенные и гетерогенные системы. Гомогенной называется система, состоящая из одной фазы, гетерогенной— система, состоящая из нескольких фаз. Фазой называется часть системы, отделенная от других ее частей поверхностью раздела, при переходе через которую свойства изменяются скачком.
Примером гомогенной системы может служить любая газовая смесь (все газы при не очень высоких давлениях неограниченно растворяются друг в друге), хотя бы смесь азота с кислородом. Другим примером гомогенной системы может служить раствор нескольких веществ в одном растворителе, например раствор хлорида натрия, сульфата магния, азота и кислорода в воде. В каждом из этих двух случаев система состоит только из одной фазы: из газовой фазы в первом примере и из водного раствора во втором.
В качестве примеров гетерогенных систем можно привести следующие системы: вода со льдом, насыщенный раствор с осадком, уголь и сера в атмосфере воздуха. В последнем случае система состоит из трех фаз: двух твердых и одной газовой.
Если реакция протекает в гомогенной системе, то она идет во всем объеме этой системы. Например, при сливании (и перемешивании) растворов серной кислоты и тиосульфата натрия помутнение, вызываемое появлением серы, наблюдается во всем объеме раствора:
Если реакция протекает между веществами, образующими гетерогенную систему, то она может идти только на поверхности раздела фаз, образующих систему. Например, растворение металла в кислоте
может протекать только на поверхности металла, потому что только здесь соприкасаются друг с другом оба реагирующих вещества. В связи с этим скорость гомогенной реакции и скорость гетерогенной реакции определяются различно.
Скоростью гомогенной реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени в единице объема системы.
Скоростью гетерогенной реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице площади поверхности фазы *.
* Площадь поверхности твердого тела не всегда легко измерить. Поэтому иногда скорость гетерогенной реакции относят не к единице площади поверхности, а к единице массы или объема твердой фазы.
Оба эти определения можно записать в математической форме. Введем обозначения: vгомог—скорость реакции в гомогенной системе; vгетерог — скорость реакции в гетерогенной системе; п — число молей какого-либо из получающихся при реакции веществ; V — объем системы; t — время; S— площадь поверхности фазы, на которой протекает реакция; ∆ — знак приращения (∆n = п2 — п1, ∆t = t2 — t1). Тогда:
Первое из этих уравнений можно упростить. Отношение количества вещества (п) к объему (V) системы представляет собою молярную концентрацию (С) данного вещества: n/V = C, откуда ∆n/V = ∆С и окончательно
Последнее уравнение является математическим выражением другого определения скорости реакции в гомогенной системе; скоростью реакции в гомогенной системе называется изменение концентрации какого-либо из веществ, вступающих в реакцию или образующихся при реакции, происходящее за единицу времени.
Как уже говорилось, при практическом использовании химических реакций весьма важно знать, с какой скоростью будет протекать данная реакция в тех или иных условиях, и как нужно изменить эти условия для того, чтобы реакция протекала с требуемой скоростью. Раздел химии, изучающий скорости химических реакций, называется химической кинетикой.
К важнейшим факторам, влияющим на скорость реакции, относятся следующие: природа реагирующих веществ, их концентрации, температура, присутствие в системе катализаторов. Скорость некоторых гетерогенных реакций зависит также от интенсивности движения жидкости или газа около поверхности, на которой происходит реакция.
Зависимость скорости реакции от концентраций реагирующих веществ
Необходимым условием того, чтобы между частицами (молекулами, ионами) исходных веществ произошло химическое взаимодействие, является их столкновение друг с другом (соударение). Точнее говоря, частицы должны сблизиться друг с другом настолько, чтобы атомы одной из них испытывали бы действие электрических полей, создаваемых атомами другой. Только при этом станут возможны те переходы электронов и перегруппировки атомов, в результате которых образуются молекулы новых веществ — продуктов реакции. Поэтому скорость реакции пропорциональна числу соударений, которые претерпевают молекулы реагирующих веществ.
Число соударений, в свою очередь, тем больше, чем выше концентрация каждого из исходных веществ или, что то же самое, чем больше произведение концентраций реагирующих веществ. Так, скорость реакции
пропорциональна произведению концентрации вещества А на концентрацию вещества В. Обозначая концентрации веществ А и В соответственно через [А] и [В], можно написать
где k — коэффициент пропорциональности, называемый константой скорости данной реакции.
Полученное соотношение выражает закон действия масс для химической реакции, протекающей при столкновении двух частиц: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ. Этот закон открыт опытным путем К. Гульдбергом и П. Вааге (Норвегия) в 1867 г.
Гораздо реже реакция осуществляется в результате одновременного столкновения трех реагирующих частиц. Например, реакция типа
может протекать путем тройного столкновения:
Тогда в соответствии с законом действия масс можно записать:
Как видно, в этом случае концентрация каждого из реагирующих веществ входит в выражение скорости реакции в степени, равной соответствующему коэффициенту в уравнении реакции.
Вероятность одновременного столкновения более чем трех частиц крайне мала. Поэтому сложные реакции, уравнения которых содержат большое число частиц, представляют собой совокупность последовательно или параллельно протекающих процессов, каждый из которых происходит, как правило, при столкновении двух частиц или в результате распада отдельной частицы. В подобных случаях закон действия масс применим только к каждой отдельной стадии реакции, но не к реакции в целом.
Величина константы скорости k зависит от природы реагирующих веществ, от температуры и от присутствия катализаторов, но не зависит от концентраций веществ.
В качестве примера приложения закона действия масс можно привести уравнение зависимости скорости реакции окисления оксида азота (II)
от концентраций NO и О2:
В случае гетерогенных реакций в уравнения закона действия масс входят концентрации только тех веществ, которые находятся в газовой фазе или в растворе. Концентрация вещества, находящегося в твердой фазе, обычно представляет собой постоянную величину и поэтому входит в константу скорости. Например, для реакции горения угля
закон действия масс запишется так:
Зависимость скорости реакции от температуры и от природы реагирующих веществ
Молекулярно-кинетическая теория газов и жидкостей дает возможность подсчитать число соударений между молекулами тех или иных веществ при определенных условиях. Если воспользоваться результатами таких подсчетов, то окажется, что число столкновений между молекулами веществ при обычных условиях столь велико, что все реакции должны протекать практически мгновенно. Однако в действительности далеко не все реакции заканчиваются быстро. Это противоречие можно объяснить, если предположить, что не всякое столкновение молекул реагирующих веществ приводит к образованию продукта реакции. Для того чтобы произошла реакция, т. е. чтобы образовались новые молекулы, необходимо сначала разорвать или ослабить связи между атомами в молекулах исходных веществ. На это надо затратить определенную энергию. Если сталкивающиеся молекулы не обладают такой энергией, то столкновение будет неэффективным— не приведет к образованию новой молекулы. Если же кинетическая энергия сталкивающихся молекул достаточна для ослабления или разрыва связей, то столкновение может привести к перестройке атомов и к образованию молекулы нового вещества.
Избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию нового вещества, называется энергией активации данной реакции. Энергию активации выражают в кДж/моль. Молекулы, обладающие такой энергией, называются активными молекулами.
С ростом температуры число активных молекул возрастает. Отсюда следует, что и скорость химической реакции должна увеличиваться с повышением температуры. Действительно, при возрастании температуры химические реакции протекают быстрее.
Для того чтобы лучше понять ускоряющее действие температуры на химические реакции, рассмотрим, как распределяются молекулы вещества по величине их энергии. В качестве примера на рис. 63 показано такое распределение для газа, находящегося при постоянной температуре. По горизонтальной оси отложена энергия Е одной молекулы газа, а по вертикальной — доля общего числа молекул, обладающих энергией, лежащей в узком интервале от Е до Е + ∆Е, деленная на величину этого интервала ∆Е. Если общее число молекул газа обозначать через N, а их долю, обладающую энергией, лежащей в указанном интервале, через ∆N/N, то откладываемая по оси ординат величина будет равна ∆N /( N∆Е).
Рассмотрим столбик шириной ∆Е и высотой, равной ординате кривой (см. рис. 63). Площадь такого столбика будет равна ∆Е * ∆N/(N∆Е) = ∆N/N,т. е. доле молекул, энергия которых лежит в интервале ∆Е. Аналогично площадь, ограниченная кривой, двумя ординатами (например, ординатами, отвечающими значениям энергии Е1 и Е2) и осью абсцисс (участок Е1АВЕ2 на рис. 63), равна доле молекул газа, энергия которых лежит в данном промежутке — в нашем случае в промежутке от Е1; до Е2. Точно так же площадь, лежащая под кривой и ограниченная слева ординатой (например, ординатой, отвечающей Е3), равна доле молекул, энергия которых превышает значение Е3 (участок па рис. 63, покрытый сеткой). Площадь, ограниченная всей кривой и осью абсцисс, равна единице.
Кривая на рис. 63 показывает, что молекулы газа, находящегося при постоянной температуре, обладают различной энергией. Наибольшая часть их имеет энергию, равную некоторой средней величине Еср или близкую к ней. Но имеются молекулы, энергия которых больше или меньше Еср. При этом, чем сильнее отличается энергия от Еср, т. е. чем дальше от максимума расположена точка кривой, тем меньшая доля молекул газа обладает такой энергией.
Как изменится кривая при изменении температуры? На рис. 64 показаны две кривые, отвечающие одному и тому же количеству газа, находящегося при температуре Т1 и Т2 (Т2>Т1). Видно, что кривая, относящаяся к температуре Т2, смещена вправо — в сторону более высоких энергий.
Если на рис. 64 отметить энергию активации Еа какой-либо реакции, протекающей с участием данного газа, то будет видно, что доля молекул газа, энергия которых превышает Еа, резко возрастает с повышением температуры.
Рис. 63. Распределение молекул газа по кинетической энергии.
Площадь участка Е1АВЕ2 равна доле молекул, энергия которых находится в интервале от Е1 до Е2. Площадь участка, покрытого сеткой, равна доле молекул, энергия которых превышает Е3.
Рис. 64. Распределение молекул газа по кинетической энергии для двух температур Т1 и Т2 (Т2> Т1).
Еа— энергия активации. Площади заштрихованных участков выражают доли активных молекул при температурах Т1 и Т2.
Возрастание скорости реакции с ростом температуры принято характеризовать температурным коэффициентом скорости реакции — числом, показывающим, во сколько раз возрастает скорость данной реакции при повышении температуры системы на 10 градусов. Температурный коэффициент различных реакций различен. При обычных температурах его значение для большинства реакций лежит в пределах от 2 до 4. Это на первый взгляд небольшое значение температурного коэффициента обусловливает, однако, большое возрастание скорости реакции при значительном повышении температуры. Например, если температурный коэффициент равен 2,9, то при возрастании температуры на 100 градусов скорость реакции увеличивается в 2,9 10 , т. е. приблизительно в 50 000 раз.
Энергия активации различных реакций различна. Ее величина является тем фактором, посредством которого сказывается влияние природы реагирующих веществ на скорость реакции. Для некоторых реакций энергия активации мала, для других, наоборот, велика.
Если энергия активации очень мала (меньше 40 кДж/моль), то это означает, что значительная часть столкновений между частицами реагирующих веществ приводит к реакции. Скорость такой реакции велика. Примером реакций, энергия активации которых ничтожно мала, могут служить ионные реакции в растворах, сводящиеся обычно к взаимодействию разноименно заряженных ионов; опыт показывает, что такие реакции протекают практически мгновенно.
Напротив, если энергия активации реакции очень велика (больше 120 кДж/моль), то это означает, что лишь очень малая часть столкновений взаимодействующих частиц приводит к протеканию химической реакции. Скорость подобной реакции очень мала. Примером реакции, имеющей высокую энергию активации, является реакция синтеза аммиака:
Эта реакция при обычных температурах протекает столь медленно, что заметить ее протекание практически невозможно.
Наконец, если энергия активации реакции не очень мала и не очень велика (40—120 кДж/моль), то такая реакция будет протекать не очень быстро и не очень медленно. Скорость такой реакции можно измерить. Примером реакции, протекающей с измеримой скоростью, может служить приведенная выше реакция разрушения тиосульфата натрия серной кислотой.
Реакции, требующие для своего протекания заметной энергии активации, начинаются с разрыва или с ослабления связей между атомами в молекулах исходных веществ. При этом вещества переходят в неустойчивое промежуточное состояние, характеризующееся большим запасом энергии. Это состояние называется активированным комплексом. Именно для его образования и необходима энергия активации. Неустойчивый активированный комплекс существует очень короткое время. Он распадается с образованием продуктов реакции; при этом энергия выделяется.
В простейшем случае активированный комплекс представляет собою конфигурацию атомов, в которой ослаблены старые связи и образуются новые. Примером может служить схема реакции синтеза йодоводорода:
Активированный комплекс возникает в качестве промежуточного состояния в ходе как прямой, так и обратной реакции. Энергетически он отличается от исходных веществ на величину энергии активации прямой реакции, а от конечных — на энергию активации обратной реакции. Эти соотношения показаны на рис. 65; видно, что разность энергий активации прямой и обратной реакции равна тепловому эффекту реакции.
Катализ
Вещества, не расходующиеся в результате протекания реакции, во влияющие на ее скорость, называются катализаторами. Явление изменения скорости реакции под действием таких веществ называется катализом. Реакции, протекающие под действием катализаторов, называются каталитическими.
В большинстве случаев действие катализатора объясняется тем, что он снижает энергию активации реакции. В присутствии катализатора реакция проходит через другие промежуточные стадии, чем без него, причем эти стадии энергетически более доступны. Иначе говоря, в присутствии, катализатора возникают другие активированные комплексы, причем для их образования требуется меньше энергии, чем для образования активированных комплексов, возникающих без катализатора. Таким образом, энергия активации реакции понижается; некоторые молекулы, энергия которых была недостаточна для активных столкновений, теперь оказываются активными.
Соотношения между энергиями активации реакции в присутствии катализатора и без него показаны на рис. 66. Из рис. 66 ясно, что катализатор снижает энергию активации прямой и обратной реакции на одну и ту же величину. Отсюда следует, что катализатор в одно и то же число раз ускоряет и прямую, и обратную реакции.
Рис. 65. Энергетическая схема реакции:
И. В. — исходные вещества; А К.— активированный комплекс; П. Р. — продукты реакции; Еа,пр — энергия активации прямой реакции; Еа,обр — энергия активации обратной реакции.
Рис. 66. Энергетическая схема реакции, протекающей с участием катализатора:
И. В.—исходные вещества; А. К. —активированный комплекс без катализатора; А. К’.—активированный комплекс в присутствии катализатора; П. Р. —продукты реакции; Еа,пр — энергия активации прямой реакции без катализатора; Еа,пр‘ — то же в присутствии катализатора; Еа,обр — энергия активации обратной реакции без катализатора; Еа,обр‘ — то же в присутствии катализатора.
Соотношение между количеством активных молекул в присутствии и в отсутствие катализатора показано на рис. 67.
Рис. 67. Влияние катализатора на число активных молекул:
Еа —энергия активации без катализатора; Еа‘ —то же в присутствии катализатора. Площадь заштрихованного участка правее Еа равна доле активных молекул без катализатора, площадь участка правее Еа‘ — доле активных молекул в присутствии катализатора.
Для ряда реакций промежуточные соединения изучены; как правило, они представляют собою весьма активные нестойкие продукты.
В химической промышленности катализаторы применяются весьма широко. Под влиянием катализаторов реакции могут ускоряться в миллионы раз и более. В некоторых случаях под действием катализаторов могут возбуждаться такие реакции, которые без них в данных условиях практически не протекают.
Различают гомогенный и гетерогенный катализ.
В случае гомогенного катализа катализатор и реагирующие вещества образуют одну фазу (газ или раствор). В случае гетерогенного катализа катализатор находится в системе в виде самостоятельной фазы.
Примером гомогенного катализа может служить каталитическое разложение пероксида водорода в водном растворе на воду и кислород. Ионы 


Широкое применение в химической промышленности находит гетерогенный катализ. Большая часть продукции, вырабатываемой в настоящее время этой промышленностью, получается с помощью гетерогенного катализа. При гетерогенном катализе реакция протекает на поверхности катализатора. Отсюда следует, что активность катализатора зависит от величины и свойств его поверхности. Для того чтобы иметь большую («развитую») поверхность, катализатор должен обладать пористой структурой или находиться в сильно раздробленном (высокодисперсном) состоянии. При практическом применении катализатор обычно наносят на носитель, имеющий пористую структуру (пемза, асбест и др.).
Как и в случае гомогенного катализа, при гетерогенном катализе реакция протекает через активные промежуточные соединения. Но здесь эти соединения представляют собой поверхностные соединения катализатора с реагирующими веществами. Проходя через ряд стадий, в которых участвуют эти промежуточные соединения, реакция заканчивается образованием конечных продуктов, а катализатор в результате не расходуется.
В качестве примеров гетерогенно-каталитических реакций можно указать на окисление диоксида серы в триоксид при контактном методе производства серной кислоты, синтез аммиака, окисление аммиака при производстве азотной кислоты.
Очень большую роль играет катализ в биологических системах. Большинство химических реакций, протекающих в пищеварительной системе, в крови п в клетках животных и человека, являются каталитическими реакциями. Катализаторы, называемые в этом случае ферментами, представляют собой простые или сложные белки. Так, слюна содержит фермент птиалин, который катализирует превращение крахмала в сахар. Фермент, имеющийся в желудке, — пепсин — катализирует расщепление белков. В организме человека находится около 30 000 различных ферментов; каждый из них служит эффективным катализатором соответствующей реакции.
Скорость реакции в гетерогенных системах
Гетерогенные реакции имеют большое значение в технике. Достаточно вспомнить, что к ним принадлежат, например, горение твердого топлива, коррозия металлов и сплавов.
Рассматривая гетерогенные реакции, нетрудно заметить, что они тесно связаны с процессами переноса вещества. В самом деле, для того, чтобы реакция, например, горения угля могла протекать, необходимо, чтобы диоксид углерода, образующийся при этой реакции, все время удалялся бы от поверхности угля, а новые количества кислорода подходили бы к ней. Оба процесса (отвод СО2 от поверхности угля и подвод О2 к ней) осуществляются путем конвекции (перемещения массы газа или жидкости) и диффузии.
Таким образом, в ходе гетерогенной реакции можно выделить по меньшей мере три стадии:
- Подвод реагирующего вещества к поверхности;
- Химическая реакция на поверхности;
- Отвод продукта реакции от поверхности.
При установившемся режиме реакции все три стадии ее протекают с равными скоростями. При этом во многих случаях энергия активации реакции невелика, н вторая стадия (собственно химическая реакция) могла бы протекать очень быстро, если бы подвод реагирующего вещества к поверхности и отвод продукта от нее тоже происходили бы достаточно быстро. Следовательно, скорость таких реакций определяется скоростью переноса вещества. Можно ожидать, что при усилении конвекции скорость их будет возрастать. Опыт подтверждает это предположение. Так, реакция горения угля
химическая стадия которой требует небольшой энергии активации, протекает тем быстрее, чем интенсивнее подается к углю кислород (или воздух).
Однако не во всех случаях скорость гетерогенной реакции определяется скоростью переноса вещества. Определяющей стадией реакций, энергия активации которых велика, является вторая стадия— собственно химическая реакция. Естественно, что скорость протекания таких реакций не будет возрастать при усилении перемешивания. Например, реакция окисления железа кислородом влажного воздуха не ускоряется при увеличении подачи воздуха к поверхности металла, поскольку здесь энергия активации химической стадии процесса значительна.
Стадия, определяющая скорость протекания реакции, называется лимитирующей стадией. В первом примере лимитирующей стадией является перенос вещества, во втором — собственно химическая реакция.
Цепные реакции
До сих пор мы рассматривали химические реакции, протекающие сравнительно просто. В таких реакциях каждый элементарный акт взаимодействия — каждое столкновение между активными молекулами реагирующих веществ — протекает независимо от результатов предшествующих элементарных актов. Образование макроскопических количеств продукта реакции является здесь результатом большого количества этих независящих друг от друга актов.
Существует, однако, обширная группа реакций, протекающих более сложно. В этих реакциях возможность протекания каждого элементарного акта сопряжена с успешным исходом предыдущего акта и, в свою очередь, обусловливает возможность последующего. Здесь образование макроскопических количеств продукта реакции представляет собой результат цепи элементарных актов взаимодействия. Такие реакции называются цепными.
Цепные реакции протекают с участием активных центров — атомов, ионов или радикалов (осколков молекул), обладающих неспаренными электронами и проявляющих, вследствие этого, очень высокую реакционную активность. Роль активных центров могут играть, например, атомы 



При актах взаимодействия активных центров с молекулами исходных веществ образуются молекулы продукта реакции, а также новые активные частицы — новые активные центры, способные к акту взаимодействия. Таким образом, активные центры служат создателями цепей последовательных превращений веществ.
Простым примером цепной реакции может служить реакция синтеза хлороводорода
Эта реакция вызывается действием света. Поглощение кванта лучистой энергии hv молекулой хлора приводит к ее возбуждению— к появлению в ней энергичных колебаний атомов. Если энергия колебаний превышает энергию связи между атомами, то молекула распадается. Этот процесс фотохимической диссоциации можно выразить уравнением:
Образующиеся атомы хлора легко реагируют с молекулами водорода:
Атом водорода, в свою очередь, легко реагирует с молекулой хлора:
Эта последовательность процессов продолжается дальше: в рассматриваемом случае число звеньев может достигать 100 000. Иначе говоря, один поглощенный квант света приводит к образованию до ста тысяч молекул HCl. Заканчивается цепь при столкновении свободного атома со стенкой сосуда, в котором происходит реакция. Цепь может закончиться также при таком соударении двух активных частиц и одной неактивной, в результате которого активные частицы соединяются в молекулу, а выделяющаяся энергия уносится неактивной частицей. В подобных случаях происходит обрыв цепи.
Таков механизм цепной неразветвленной реакции: при каждом элементарном взаимодействии один активный центр образует кроме молекулы продукта реакции один новый активный центр.
* Обычно при обозначении активных частиц указывают точками только неспаренные электроны, например:
В двадцатых годах XX века Н. Н. Семенов* совместно с сотрудниками, изучая кинетику различных процессов, открыл явления, необъяснимые на основе существовавших в то время представлений о механизме химических реакций. Для их объяснения II. Н. Семенов выдвинул теорию разветвленных цепных реакций, в ходе которых взаимодействие свободного радикала с молекулой исходного вещества приводит к образованию не одного, а двух или большего числа новых активных центров. Один из них продолжает старую цепь, а другие дают начало новым; цепь разветвляется, и реакция прогрессивно ускоряется.
* Николай Николаевич Семенов (род. в 1896 г.) советский академик, лауреат Ленинской, Государственной и Нобелевской премий, Герой Социалистического Труда. Им разработана и экспериментально обоснована теория цепных реакций и создана на ее основе теория воспламенения и взрывов, имеющая большое практическое значение.
К разветвленном цепным реакциям относится, например, реакция образования воды из простых веществ. Экспериментально установлен и подтвержден расчетами следующий механизм этой реакции. В смеси водорода с кислородом при нагревании или пропускании электрического разряда происходит взаимодействие молекул этих газов с образованием двух гидроксильных радикалов:
Радикалы 
что приводит к образованию молекулы воды и свободного атома водорода. Последний реагирует с молекулой О2, давая уже две новых активных частицы:
Атом кислорода, реагируя с молекулой Н2, в свою очередь, может породить два новых активных центра:
Таким образом происходит прогрессивное увеличение числа активных частиц и, если обрывы цепей не препятствуют этому процессу, скорость реакции резко возрастает.
По цепному механизму протекают такие важные химические реакции, как горение, взрывы, процессы окисления углеводородов (получение спиртов, альдегидов, кетонов, органических кислот) и реакции полимеризации. Поэтому теория цепных реакции служит научной основой ряда важных отраслей техники и химической технологии.
К цепным процессам относятся и ядерные цепные реакции, протекающие, например, в атомных реакторах или при взрыве атомной бомбы. Здесь роль активной частицы играет нейтрон, проникновение которого в ядро атома может приводить к его распаду, сопровождающемуся выделением большой энергии и образованием новых свободных нейтронов, продолжающих цепь ядерных превращений.
Необратимые и обратимые реакции. Химическое равновесие
Все химические реакции можно разбить на две группы; необратимые и обратимые реакции. Необратимые реакции протекают до конца — до полного израсходования одного из реагирующих веществ. Обратимые реакции протекают не до конца; при обратимой реакции ни одно из реагирующих веществ не расходуется полностью. Это различие связано с тем, что необратимая реакция может протекать только в одном направлении. Обратимая же реакция может протекать как в прямом, так и в обратном направлениях.
Рассмотрим два примера.
Пример 1. Взаимодействие между цинком и концентрированной азотной кислотой протекает согласно уравнению:
При достаточном количестве азотной кислоты реакция закончится только тогда, когда весь цинк растворится. Кроме того, если попытаться провести эту реакцию в обратном направлении — пропускать диоксид азота через раствор нитрата цинка, то металлического цинка и азотной кислоты не получится—данная реакция не может протекать в обратном направлении. Таким образом, взаимодействие цинка с азотной кислотой — необратимая реакция.
Пример 2. Синтез аммиака протекает согласно уравнению:
Если смешать один моль азота с тремя молями водорода, осуществить в системе условия, благоприятствующие протеканию реакции, и по истечении достаточного времени произвести анализ газовой смеси, то результаты анализа покажут, что в системе будет присутствовать не только продукт реакции (аммиак), но и исходные вещества (азот и водород). Если теперь в те же условия в качестве исходного вещества поместить не азото-водородную смесь, а аммиак, то можно будет обнаружить, что часть аммиака разложится на азот и водород, причем конечное соотношение между количествами всех трех веществ будет такое же, как в том случае, когда исходили из смеси азота с водородом. Таким образом, синтез аммиака — обратимая реакция.
В уравнениях обратимых реакций вместо знака равенства можно ставить стрелки; они символизируют протекание реакции как в прямом, так и обратном направлениях.
На рис. 68 показано изменение скоростей прямой и обратной реакций с течением времени. Вначале, при смешении исходных веществ, скорость прямой реакции велика, а скорость обратной реакции равна пулю. По мере протекания реакции исходные вещества расходуются и их концентрации падают. В результате этого уменьшается скорость прямой реакции. Одновременно появляются продукты реакции, и их концентрация возрастает. Вследствие этого начинает идти обратная реакция, причем ее скорость постепенно увеличивается. Когда скорости прямой и обратной реакций становятся одинаковыми, наступает химическое равновесие. Так, в последнем примере устанавливается равновесие между азотом, водородом н аммиаком.
Рис. 68. Изменение скорости прямой (v1) и обратной (v2) реакций с течением времени (t).
Химическое равновесие называют динамическим равновесием. Этим подчеркивается, что при равновесии протекают и прямая, и обратная реакции, но их скорости одинаковы, вследствие чего изменений в системе не заметно.
Количественной характеристикой химического равновесия служит величина, называемая константой химического равновесия. Рассмотрим ее на примере реакции синтеза йодоводорода:
Согласно закону действия масс, скорости прямой (v1) и обратной (v2) реакций выражаются уравнениями *:
* Система рассматривается при повышенных температурах, когда йод находится в состоянии пара.
При равновесии скорости прямой и обратной реакций равны друг другу, откуда
Отношение констант скорости прямой и обратной реакций тоже представляет собой константу. Она называется константой равновесия данной реакции (К):
В левой части этого уравнения стоят те концентрации взаимодействующих веществ, которые устанавливаются при равновесии— равновесные концентрации. Правая же часть уравнения представляет собой постоянную (при постоянной температуре) величину.
Можно показать, что в общем случае обратимой реакции
константа равновесия выразится уравнением:
Здесь большие буквы обозначают формулы веществ, а маленькие— коэффициенты в уравнении реакции.
Таким образом, при постоянной температуре константа равновесия обратимой реакции представляет собой постоянную величину, показывающую то соотношение между концентрациями продуктов реакции (числитель) и исходных веществ (знаменатель), которое устанавливается при равновесии.
Уравнение константы равновесия показывает, что в условиях равновесия концентрации всех веществ, участвующих в реакции, связаны между собою. Изменение концентрации любого из этих веществ влечет за собою изменения концентраций всех остальных веществ; в итоге устанавливаются новые концентрации, но соотношение между ними вновь отвечает константе равновесия.
Численное значение константы равновесия в первом приближении характеризует выход* данной реакции. Например, при 
* Выходом реакции называется отношение количества получаемого вещества к тому его количеству, которое получилось бы при протекании реакции до конца
т. е. при равновесии концентрации продуктов реакции много больше концентраций исходных веществ, а это и означает, что выход реакции велик. При 
В случае гетерогенных реакций в выражение константы равновесия, так же как и в выражение закона действия масс (см. § 58), входят концентрации только тех веществ, которые находятся в газовой или жидкой фазе. Например, для реакции
константа равновесия имеет вид:
Величина константы равновесия зависит от природы реагирующих веществ и от температуры. От присутствия катализаторов она не зависит. Как уже сказано, константа равновесия равна отношению констант скорости прямой и обратной реакции. Поскольку катализатор изменяет энергию активации и прямой, и обратной реакций на одну и ту же величину (см. § 60), то на отношение констант их скорости он не оказывает влияния. Поэтому катализатор не влияет на величину константы равновесия и, следовательно, не может ни увеличить, ни снизить выход реакции. Он может лишь ускорить или замедлить наступление равновесия.
Смещение химического равновесия. Принцип Ле Шателье
Если система находится в состоянии равновесия, то она будет пребывать в нем до тех пор, пока внешние условия сохраняются постоянными. Если же условия изменятся, то система выйдет из равновесия — скорости прямого и обратного процессов изменятся неодинаково — будет протекать реакция. Наибольшее значение имеют случаи нарушения равновесия вследствие изменения концентрации какого-либо из веществ, участвующих в равновесии, давления или температуры.
Рассмотрим каждый из этих случаев.
Нарушение равновесия вследствие изменения концентрации какого-либо из веществ, участвующих в реакции. Пусть водород, йодоводород и пары йода находятся в равновесии друг с другом при определенных температуре и давлении. Введем в систему дополнительно некоторое количество водорода. Согласно закону действия масс, увеличение концентрации водорода повлечет за собой увеличение скорости прямой реакции — реакции синтеза HI, тогда как скорость обратной реакции не изменится. В прямом направлении реакция будет теперь протекать быстрее, чем в обратном. В результате этого концентрации водорода и паров йода будут уменьшаться, что повлечет за собою замедление прямой реакции, а концентрация HI будет возрастать, что вызовет ускорение обратной реакции. Через некоторое время скорости прямой и обратной реакций вновь сравняются— установится новое равновесие. Но при этом концентрация HI будет теперь выше, чем она была до добавления Н2, а концентрация 12 — ниже.
Процесс изменения концентраций, вызванный нарушением равновесия, называется смещением или сдвигом равновесия. Если при этом происходит увеличение концентраций веществ, стоящих в правой части уравнения (и, конечно, одновременно уменьшение концентраций веществ, стоящих слева), то говорят, что равновесие смещается вправо, т. е. в направлении течения прямой реакции; при обратном изменении концентраций говорят о смещении равновесия влево — в направлении обратной реакции. В рассмотренном примере равновесие сместилось вправо. При этом то вещество (Н2), увеличение концентрации которого вызвало нарушение равновесия, вступило в реакцию — его концентрация понизилась.
Таким образом, при увеличении концентрации какого-либо из веществ, участвующих в равновесии, равновесие смещается в сторону расхода этого вещества; при уменьшении концентрации какого-либо из веществ равновесие смещается в сторону образования этого вещества.
Нарушение равновесия вследствие изменения давления (путем уменьшения или увеличения объема системы). Когда в реакции участвуют газы, равновесие может нарушиться при изменении объема системы.
Рассмотрим влияние давления на реакцию между монооксидом азота и кислородом:
Пусть смесь газов NO, О2 и NO2 находится в химическом равновесии при определенной температуре и давлением. Не изменяя температуры, увеличим давление так, чтобы объем системы уменьшился в 2 раза. В первый момент парциальные давления и концентрации всех газов возрастут вдвое, но при этом изменится соотношение между скоростями прямой и обратной реакций — равновесие нарушится.
В самом деле, до увеличения давления концентрации газов имели равновесные значения [NO]равн, [О2]равн. и [NO2]равн, а скорости прямой и обратной реакций были одинаковы и определялись уравнениями:
В первый момент после сжатия концентрации газов увеличатся вдвое по сравнению с их исходными значениями и будут равны соответственно 2 [NO]равн, 2[О2]равн и 2[NO2]равн. При этом скорости прямой и обратной реакций будут определяться уравнениями:
Таким образом, в результате увеличения давления скорость прямой реакции возросла в 8 раз, а обратной — только в 4 раза. Равновесие в системе нарушится — прямая реакция будет преобладать над обратной. После того как скорости сравняются, вновь установится равновесие, но количество NO2 в системе возрастет — равновесие сместится вправо.
Нетрудно видеть, что неодинаковое изменение скоростей прямой и обратной реакций связано с тем, что в левой и в правой частях уравнения рассматриваемой реакции различно число молекул газов: одна молекула кислорода и две молекулы монооксида азота (всего три молекулы газов) превращаются в две молекулы газа — диоксида азота. Давление газа есть результат ударов его молекул о стенки сосуда; при прочих равных условиях давление газа тем выше, чем больше молекул заключено в данном объеме газа. Поэтому реакция, протекающая с увеличением числа молекул газов, приводит к возрастанию давления, а реакция, протекающая с уменьшением числа молекул газов, — к его понижению. Помня об этом, вывод о влиянии давления на химическое равновесие можно сформулировать так:
При увеличении давления путем сжатия системы равновесие сдвигается в сторону уменьшения числа молекул газов, т. е. в сторону понижения давления; при уменьшении давления равновесие сдвигается в сторону возрастания числа молекул газов, т. е. в сторону увеличения давления.
В том случае, когда реакция протекает без изменения числа молекул газов, равновесие не нарушается при сжатии или при расширении системы. Например, в системе
равновесие не нарушается при изменении объема; выход HI не зависит от давления.
Нарушение равновесия вследствие изменения температуры. Равновесие подавляющего большинства химических реакции сдвигается при изменении температуры. Фактором, который определяет направление смещения равновесия, является при этом знак теплового эффекта реакции. Можно показать, что при повышении температуры равновесие смещается в направлении эндотермической, а при понижении — в направлении экзотермической реакции.
Так, синтез аммиака представляет собой экзотермическую реакцию
Поэтому при повышении температуры равновесие в системе Н2—N2—NH3 сдвигается влево — в сторону разложения аммиака, так как этот процесс идет с поглощением теплоты.
Наоборот, синтез оксида азота (II) представляет собой эндотермическую реакцию:
Поэтому при повышении температуры равновесие в системе N2—О2—NO сдвигается вправо — в сторону образования NO.
Закономерности, которые проявляются в рассмотренных примерах нарушения химического равновесия, представляют собою частные случаи общего принципа, определяющего влияние различных факторов на равновесные системы. Этот принцип, известный под названием принципа Ле Шателье, в применении к химическим равновесиям можно сформулировать так:
Если на систему, находящуюся в равновесии, оказать какое-либо воздействие, то в результате протекающих в ней процессов равновесие сместится в таком направлении, что оказанное воздействие уменьшится.
Действительно, при введении в систему одного из веществ, участвующих в реакции, равновесие смещается в сторону расхода этого вещества. При повышении давления оно смещается так, что давление в системе снижается; при повышении температуры равновесие смещается в сторону эндотермической реакции — температура в системе падает.
Принцип Ле Шателье распространяется не только на химические, но и на различные физико-химические равновесия. Смещение равновесия при изменении условий таких процессов, как кипение, кристаллизация, растворение, происходит в соответствии с принципом Ле Шателье.
Факторы, определяющие направление протекания химических реакций
В предыдущих параграфах мы рассмотрели несколько примеров, показывающих, что при определенных условиях каждая химическая реакция самопроизвольно протекает в определенном направлении. Так, при низких температурах экзотермическая реакция образования парообразной воды
практически нацело протекает в прямом направлении *. Но при высоких температурах эта реакция начинает идти в обратном направлении: водяной пар разлагается па водород и кислород. Во всех случаях в результате реакции может быть достигнуто состояние устойчивого химического равновесия, но само положение равновесия при разных условиях оказывается различным.
* В отсутствие катализатора скорость этой реакции при обычных условиях крайне мала. Однако при наличии катализатора (например, платинированного асбеста) процесс образования воды протекает с большой скоростью.
Возникает вопрос: в чем причина определенной направленности химических процессов, какие факторы обусловливают то или иное состояние химического равновесия?
Известно, что в механических системах устойчивое равновесие соответствует минимуму потенциальной энергии системы. Так, шарик самопроизвольно скатывается из положения а на наклонной поверхности (рис. 69), причем его потенциальная энергия переходит сначала в кинетическую энергию движения шарика как целого, а затем в энергию теплового движения молекул. В положении б шарик находится в равновесии.
Естественно предположить, что и химические процессы должны самопроизвольно протекать в направлении уменьшения внутренней энергии системы, т. е. в направлении, отвечающем положительному тепловому эффекту реакции. Действительно, опыт показывает, что при обычных условиях самопроизвольно протекают преимущественно экзотермические реакции.
Однако попытка объяснить направленность химических процессов только стремлением к минимуму внутренней энергии приводит к противоречиям с фактами. Так, уже при обычных температурах самопроизвольно протекают эндотермические процессы растворения многих солей и некоторые эндотермические химические реакции. С повышением температуры все большее число реакций начинает самопроизвольно протекать в направлении эндотермического процесса; примерами таких реакций могут служить упомянутое выше разложение воды или протекающий при высоких температурах синтез оксида азота(II):
Более того, принцип стремления к минимуму внутренней энергии требует, чтобы все экзотермические реакции доходили до конца, т. е. исключает возможность обратимых реакций; однако такие реакции реально существуют.
Вспомним теперь, что среди механических систем имеются такие, поведение которых тоже нельзя описать только направленностью процессов к достижению минимума потенциальной энергии. Это системы, состоящие из очень большого числа частиц. Например, молекулы, входящие в состав воздуха, распределяются вокруг Земли в виде атмосферы многокилометровой толщины, но не падают на Землю, хотя минимуму потенциальной энергии каждой молекулы соответствует наиболее низкое ее положение.
Из громадного числа частиц состоят и химические системы. Поэтому неудивительно, что и здесь тенденция к достижению минимума внутренней энергии не является единственным фактором, определяющим их поведение.
Для того чтобы составить представление о втором факторе, влияющем на направление реакций, рассмотрим какой-либо самопроизвольно протекающий процесс, не сопровождающийся тепловым эффектом. Примером такого процесса может служить расширение разреженного газа.
Пусть в части А сосуда, разделенного на две части (рис. 70), находится разреженный газ. В таком газе среднее расстояние между молекулами велико; при этом условии внутренняя энергия газа не зависит от степени его разрежения. Вторая половина сосуда (Б) газа не содержит. Если открыть кран, соединяющий обе части сосуда, то газ самопроизвольно распространится по всему сосуду. Внутренняя энергия газа при этом не изменится; тем не менее, самопроизвольно произойдет именно процесс расширения газа, а обратный процесс — самопроизвольное сжатие газа — не происходит.
Рис. 69. Шарик самопроизвольно скатывается из положения а в положение б.
Рис. 70. Сосуд, состоящий из двух частей: в части А находится разреженный газ, в части Б — вакуум.
Причины такой направленности процесса можно понять, если сначала рассмотреть систему, содержащую небольшое число молекул. Пусть в сосуде находятся всего две молекулы, которые обозначим 1 и 2. Равномерное распределение газа между обеими частями сосуда, соответствующее определенному макросостоянию газа *, может осуществиться двумя микросостояниями:
* Макросостояние — состояние вещества, характеризующееся определенными значениями его макроскопических свойств (температура, давление, объем и т. д.); микросостояние — состояние вещества, характеризующееся определенным состоянием каждой частицы (молекулы, атомы). Одно и то же макросостояние соответствует большому числу различных микросостояний.
Макросостояние, при котором весь газ сосредоточен в одной из частей сосуда (например, в части А), осуществляется единственным микросостоянием:
Очевидно, что то или иное макросостояние системы тем более вероятно, чем большим числом микросостояний оно может осуществиться. В рассматриваемом случае (две молекулы) равномерное распределение газа по сосуду вдвое вероятнее, чем переход всего газа в часть сосуда А.
Пусть теперь в сосуде находится четыре молекулы, которые мы вновь пронумеруем. Переходу всего газа в часть сосуда А по-прежнему соответствует единственное микросостояние:
Между тем, равномерное распределение газа между обеими частями сосуда может теперь осуществляться шестью различными микросостояниями
Теперь, следовательно, вероятность равномерного распределения молекул газа по всему объему сосуда оказывается заметно более высокой, чем вероятность их перехода в одну из его частей. Естественно, что равномерное распределение газа будет наблюдаться гораздо чаше, чем полное его сосредоточение в части сосуда.
Если в сосуде находится шесть молекул, то переходу их в одну из частей сосуда (т. е. самопроизвольному сжатию газа до половины занимаемого им первоначального объема), как и раньше, соответствует только одно микросостояние. Но равномерному распределению газа между обеими частями сосуда отвечает уже 20 возможных комбинаций молекул, т. е. 20 различных микро-состояний:
Теперь явление самопроизвольного сжатия газа, т е. сосредоточения всех его молекул в одной из частей сосуда, будет наблюдаться еще реже; равномерное же распределение газа по всему сосуду становится еще более вероятным.
Таким образом, с ростом числа молекул вероятность беспорядочного, равномерного распределения газа в сосуде очень быстро возрастает, а самопроизвольное сжатие газа становится все менее вероятным процессом. Если мы вспомним теперь, что макроскопические количества газа содержат огромное число молекул, то станет ясно, что в реальном опыте самопроизвольное сжатие газа представляет собой процесс практически невозможный, и что самопроизвольно будет протекать обратный процесс расширения газа, приводящий к равномерному, беспорядочному распределению его молекул по всему объему сосуда.
Рассмотренное нами явление расширения газа представляет собой пример проявления принципа направленности процессов к наиболее вероятному состоянию, т. е. к состоянию, которому соответствует максимальная беспорядочность распределения частиц. Направление самопроизвольного протекания химических реакций и определяется совокупным действием двух факторов: тенденцией к переходу системы в состояние с наименьшей внутренней энергией и тенденцией к достижению наиболее вероятного состояния.
Так, в приведенном примере с воздухом тенденция к минимуму потенциальной энергии заставляет молекулы, входящие в состав воздуха, падать на Землю, а тенденция к максимальной вероятности заставляет их беспорядочно распределяться в пространстве. В результате создается некоторое равновесное распределение молекул, характеризующееся более высокой их концентрацией у поверхности Земли и все большим разрежением по мере удаления от Земли.
В системах соль — вода минимум внутренней энергии в большинстве случаев соответствует кристаллическому состоянию соли. Однако наиболее вероятное состояние системы достигается при беспорядочном распределении соли в жидкой воде. В результате совместного действия этих двух факторов устанавливается равновесие, соответствующее определенной концентрации насыщенного раствора соли.
При химических реакциях в силу принципа направленности процессов к минимуму внутренней энергии атомы соединяются в такие молекулы, при образовании которых выделяется наибольшее количество энергии. В силу же принципа направленности процессов к наиболее вероятному состоянию протекают такие реакции, в ходе которых возрастает число частиц (например, реакции разложения молекул на атомы) или чисто возможных состояний атомов.
Так, в случае реакции
минимальной внутренней энергии системы соответствует аммиак, образующийся при протекании реакции до конца вправо. Однако наиболее вероятному состоянию системы отвечает азото-водородная смесь, образующаяся при полном разложении аммиака, ибо при этом в 2 раза возрастает число молекул газов. Вследствие действия обоих фактором в системе устанавливается равновесие, отвечающее определенному при данной температуре соотношению концентраций всех веществ.
В случае реакции
минимальной внутренней энергии отвечает азото-кислородная смесь, образующаяся при полном разложении оксида азота. Поскольку в ходе этой реакции число частиц не изменяется, то протекание реакции до конца как в прямом, так и в обратном направлении не увеличивает вероятности состояния системы. Не изменяется при этом и число возможных состояний атомов: в исходных веществах каждый атом и азота, и кислорода связан с атомом того же элемента (молекулы N2 и О2), а в продукте реакции каждый атом связан с атомом другого элемента (молекула NO). Иначе обстоит дело при частичном протекании процесса в прямом или в обратном направлении. В результате частичного прохождения реакции, т. е. при сосуществовании исходных веществ и продуктов реакции, атомы азота и кислорода находятся в двух состояниях: часть их связана в молекулы N2 и О2, а часть — в молекулы NO. Таким образом, число возможных микросостояний рассматриваемой системы, а следовательно, и вероятность соответствующего ее макросостояния возрастают при частичном протекании реакции. Итак, тенденция к уменьшению внутренней энергии способствует протеканию данной реакции до конца в обратном направлении, а тенденция к увеличению вероятности состояния вызывает ее частичное протекание в прямом направлении. Вследствие одновременного действия обоих факторов часть азото-кислородной смеси при нагревании превращается в NO и устанавливается равновесие между исходными веществами и продуктом реакции.
Тенденция к переходу в состояние с наименьшей внутренней энергией проявляется при всех температурах в одинаковой степени. Тенденция же к достижению наиболее вероятного состояния проявляется тем сильнее, чем выше температура. Поэтому при низких температурах в большинстве случаев практически сказывается только влияние первой из этих тенденций, в результате чего самопроизвольно протекают экзотермические процессы. По мере возрастания температуры равновесие в химических системах все больше и больше сдвигается в сторону реакций разложения или увеличения числа состояний атомов. При этом каждой температуре отвечает состояние равновесия, характеризующееся определенным соотношением концентраций реагирующих веществ и продуктов реакции.
Оба рассмотренных фактора, а также результат их совместного действия можно выразить количественно. Величины, с помощью которых это делается, изучаются в разделе физики — термодинамике и называются термодинамическими величинами. К ним относятся, в частности, внутренняя энергия, энтальпия, энтропия и энергия Гиббса.
Термодинамические величины. Внутренняя энергия и энтальпия
Внутренняя энергия U вещества (или системы) — это полная энергия частиц, составляющих данное вещество (см. также § 54). Она слагается из кинетической и потенциальной энергий частиц. Кинетическая энергия — это энергия поступательного, колебательного и вращательного движения частиц; потенциальная энергия обусловлена силами притяжения и отталкивания, действующими между частицами.
Внутренняя энергия зависит от состояния вещества. Изменение внутренней энергии системы ∆U при том или ином процессе можно определять. Пусть в результате какого-нибудь процесса система переходит из начального состояния 1 в конечное состояние 2, совершая при этом работу А и поглощая из внешней среды теплоту Q*. Ясно, что внутренняя энергия системы уменьшится на величину А, возрастет на величину Q и в конечном состоянии будет равна
где U1 и U2 — внутренняя энергия системы в начальном (1) и в конечном (2) состояниях. Если обозначить разность U2— U1 через ∆U, то уравнение можно представить в виде:
* В термохимических уравнениях (см. § 55) положительной принято считать теплоту, выделенную системой. В уравнениях термодинамики принято обратное условие: положительной считается теплота, поглощенная системой.
Это уравнение выражает закон сохранения энергии, согласно которому изменение внутренней энергии не зависит от способа проведения процесса, а определяется только начальным и конечным состояниями системы. Однако какая часть энергии пойдет на совершение работы, а какая превратится в теплоту — зависит от способа проведения процесса: соотношение между работой и теплотой может быть различным. В частности, если в ходе процесса не производится никакой работы, в том числе работы расширения против внешнего давления, т. е., если объем системы не изменяется, то
де Qv — теплота, поглощенная системой в условиях постоянного объема.
Последнее уравнение дает возможность определять изменение внутренней энергии при различных процессах. Например, в случае нагревания вещества при постоянном объеме изменение внутренней энергии определяется по теплоемкости этого вещества:
Здесь Cv— молярная теплоемкость вещества при постоянном объеме; п — количество вещества; ∆Т — разность между конечной и начальной температурами.
В случае химической реакции, протекающей без изменения объема системы, изменение внутренней энергии равно взятому с обратным знаком тепловому эффекту этой реакции.
Энтальпия. Однако чаще в химии приходится иметь дело с процессами, протекающими при постоянном давлении. При этом удобно пользоваться величиной энтальпии Н, определяемой соотношением:
При постоянном давлении и при условии, что в ходе процесса совершается только работа расширения (А = P∆V) *
* Работа (А) против силы внешнего давления равна величине этой силы (F), умноженной на путь (∆l), т. е. А = F∆l. Но сила равна давлению (Р), умноженному на ту площадь (S), на которую оно действует: F = PS, откуда А = PS∆l или А = Р∆V.
Сравнивая последнее уравнение с уравнением внутренней энергии
видим, что при указанных условиях
где QP— теплота, поглощенная системой при постоянном давлении.
Последнее уравнение дает возможность определять изменение энтальпии при различных процессах. Такие определения аналогичны определениям внутренней энергии, с той разницей, что все измерения должны проводиться в условиях постоянного давления. Так, при нагревании вещества изменение его энтальпии определяется по теплоемкости этого вещества при постоянном давлении
где п— количество вещества; Ср—молярная теплоемкость вещества при постоянном давлении.
При изменениях агрегатного состояния вещества и при аллотропных переходах изменение энтальпии равно по величине, но обратно по знаку теплоте соответствующего превращения (плавление, кипение, превращение из одной модификации в другую). Наконец, в случае химической реакции изменение энтальпии равно взятому с обратным знаком тепловому эффекту реакции, проведенной при постоянной температуре и постоянном давлении.
Энтальпия, как и внутренняя энергия, характеризует энергетическое состояние вещества, но включает энергию, затрачиваемую на преодоление внешнего давления, т. е. на работу расширения. Подобно внутренней энергии, энтальпия определяется состоянием системы и не зависит от того, каким путем это состояние достигнуто. В случае газов различие между ∆U и ∆Н в ходе того или иного процесса может быть значительным. В случае систем, не содержащих газов, изменения внутренней энергии и энтальпии, сопровождающие процесс, близки друг к другу. Это объясняется тем, что изменения объема (∆V) при процессах, претерпеваемых веществами в конденсированных (т. е. в твердом или в жидком) состояниях, обычно очень невелики, и величина Р∆V мала в сравнении с ∆Н.
Термодинамические величины. Энтропия и энергия Гиббса
Как уже говорилось в § 65, макросостояние системы тем более вероятно, чем большим числом микросостояний оно может осуществиться. Обычно число микросостояний, отвечающих тому или иному макросостоянию системы, очень велико. Это связано с тем, что в макроскопических количествах вещества число частиц колоссально велико, а их положения и скорости при обычных температурах чрезвычайно разнообразны.
Характеризовать в этом смысле состояние системы оказалось удобнее не самой вероятностью осуществления данного макросостояния, а величиной, пропорциональной ее логарифму. Эта величина называется энтропией, Энтропия (S) связана с числом (W) равновероятных микроскопических состояний, которыми можно реализовать данное макроскопическое состояние системы, уравнением
где k— коэффициент пропорциональности.
Наименьшую энтропию имеют идеально правильно построенные кристаллы при абсолютном нуле. Энтропия кристалла, в структуре которого имеются какие-либо неправильности, уже при абсолютном нуле несколько больше, так как нарушения идеальности могут реализоваться не единственным способом. С повышением температуры энтропия всегда возрастает, так как возрастает интенсивность движения частиц, а следовательно, растет число способов их расположения. Возрастает она также при превращении вещества из кристаллического состояния в жидкое и, в особенности, при переходе из жидкого состояния в газообразное. Изменяется энтропия и при протекании химических процессов. Эти изменения обычно особенно велики в случае реакций, приводящих к изменению числа молекул газов: увеличение числа газовых молекул приводит к возрастанию энтропии, уменьшение — к ее понижению.
Подобно внутренней энергии и энтальпии, энтропия зависит только от состояния системы. Но, в отличие от этих двух функций, связь изменения энтропии с теплотой зависит от способа проведения процесса — от его скорости.
Как уже говорилось, в ходе того или иного процесса соотношение между теплотой и производимой работой может быть различным. Только разность этих величин, равная изменению внутренней энергии системы, не зависит от способа осуществления процесса. При быстром его проведении работа бывает малой, а при медленном она возрастает. При бесконечно медленном осуществлении процесса — при проведении его бесконечно малыми шагами от одного состояния равновесия к следующему, бесконечно близкому к предыдущему, — работа принимает максимально возможное значение. Такое проведение процесса называется термодинамически обратимым, или просто обратимым *.
В ряде случаев к обратимому проведению процесса можно приблизиться в экспериментальных условиях с высокой точностью. В лаборатории можно практически обратимо проводить окислительно-восстановительные реакции в гальванических элементах (см. § 98), плавление твердого тела, испарение жидкости.
Если процесс проводится обратимо и при постоянной температуре (изотермически), то изменение энтропии связано с поглощаемой теплотой уравнением
где Qобр — количество теплоты, поглощенной системой в изотермическом обратимом процессе; Т — абсолютная температура.
С помощью этого уравнения можно определить, например, изменение энтропии при плавлении и кипении веществ.
Последнее уравнение показывает, что при поглощении некоторого количества теплоты энтропия системы возрастает тем сильнее, чем ниже температура, при которой поглощается теплота. Это можно пояснить следующим образом. Подведем одно и то же количество теплоты к двум одинаковым порциям данного вещества. При этом пусть одна из порций находится при низкой температуре, например 1 К, а другая — при высокой температуре, например 1000 К. Ясно, что относительное возрастание скорости движения частиц и увеличение степени их неупорядоченности, а следовательно, и возрастание энтропии в первом случае будет больше, чем во втором.
Энтропия имеет размерность энергии, деленной на температуру; выражают ее обычно в Дж/К.
Как показывается в термодинамике, можно ввести такие функции, которые отражают влияние на направление протекания процесса как тенденции к уменьшению внутренней энергии, так и тенденции к достижению наиболее вероятного состояния системы. Знак изменения подобной функции при той или иной реакции может служить критерием возможности самопроизвольного протекания реакции. Для изотермических реакций, протекающих при постоянном давлении, такой функцией является энергия Гиббса* G,называемая также изобарно-изотермическим потенциалом, изобарным потенциалом или свободной энергией при постоянном давлении.
*Джозайя Уиллард Гиббс (1839—1903)—выдающийся американский физик, один из основателей химической термодинамики и статистической физики.
Энергия Гиббса связана с энтальпией, энтропией и температурой соотношением:
Если реакция осуществляется при постоянных давлении и температуре (такой процесс называется изобарно-изотермическим), то изменение энергии Гиббса при реакции будет равно:
При обратимом и изотермическом проведении процесса ∆G равно по абсолютной величине, но обратно по знаку максимальной полезной работе, которую система производит в данном процессе:
Полезной работой называется вся производимая в ходе процесса работа за вычетом работы расширения Р∆V.
Можно показать, что в условиях постоянства температуры и давления реакции протекают самопроизвольно в сторону уменьшения энергии Гиббса. Поскольку ∆G равно по величине, но обратно по знаку максимальной полезной работе процесса, то сказанное можно сформулировать иначе: самопроизвольно могут протекать только те реакции, за счет энергии которых можно совершать полезную работу.
Для грубой оценки того, в каком направлении может протекать та или иная реакция при низких и при высоких температурах, можно воспользоваться приближенными уравнениями для изменения энергии Гиббса. При низких температурах множитель Т мал и абсолютное значение произведения Т∆S тоже мало. В этом случае для реакций, имеющих значительный тепловой эффект, 
вторым членом можно пренебречь. При этом получим
При достаточно высоких температурах (множитель Т велик) имеем обратное соотношение:
Пренебрегая теперь первым членом в выражении энергии Гиббса, получим
Эти приближенные равенства показывают, что при низких температурах критерием направления самопроизвольного протекания реакции в первом приближении может служить знак теплового эффекта реакции, а при высоких-знак изменения энтропии. Это означает, что при низких температурах самопроизвольно протекать могут экзотермические реакции, а при высоких — реакции, сопровождающиеся увеличением энтропии.
К сказанному необходимо добавить, что отрицательное значение ∆G той или иной реакции указывает именно только на возможность ее протекания. В действительности реакция может при этом и не наблюдаться. Дело в том, что скорость ее может быть малой; тогда, несмотря на соблюдение условия ∆G 0 , стандартное изменение энтальпии — ∆Н°, стандартное изменение энергии Гиббса — ∆G°.
Стандартное изменение энергии Гиббса реакции связано с константой равновесия реакции уравнением:
При подстановке значения R = 8,314 Дж/(моль*К) величина ∆G° выразится формулой
Это уравнение дает возможность, зная ∆G 0 , вычислять константу равновесия и, наоборот, по экспериментально найденному значению константы равновесия определять ∆G 0 реакции. Оно справедливо для любой температуры, но чаще применяется для 25°С (298 К); эта температура принимается в качестве стандартной. Температура указывается при этом нижним индексом
При вычислении стандартных изменений энтальпии и энергии Гиббса реакций обычно используют стандартные энтальпии и энергии Гиббса образования веществ. Эти величины представляют собой ∆Н 0 и ∆G 0 реакций образования данного вещества из простых при стандартных условиях. При этом, если элемент образует несколько простых веществ, то берется наиболее устойчивое из них (при данных условиях). Энтальпия образования и энергия Гиббса образования наиболее устойчивых простых веществ принимаются равными нулю.
Согласно закону Гесса, стандартное изменение энтальпии реакции (сокращенно: стандартная энтальпия реакции) равно сумме стандартных энтальпий образования продуктов реакции за вычетом суммы стандартных энтальпий образования исходных веществ. Аналогично стандартное изменение энергии Гиббса реакции (сокращенно: стандартная энергия Гиббса реакции) равно сумме стандартных энергий Гиббса образования продуктов реакции за вычетом суммы стандартных энергий Гиббса образования исходных веществ. При этом все суммирования производятся с учетом числа молей участвующих в реакции веществ в соответствии с ее уравнением.
Таблица 7. Стандартная энтальпия образования и стандартная энергия Гиббса образования некоторых веществ при 298 К (25 °С)
Сокращенные обозначения агрегатного состояния веществ: г—газообразное, ж —жидкое, к — кристаллическое.
В табл. 7 приведены значения стандартных энтальпий и энергий Гиббса образования некоторых веществ при 25°С (298 К), Более полные данные этого рода можно найти в справочниках, например, в «Кратком справочнике физико-химических величин» под редакцией А. А. Равделя и А. М. Пономаревой (издание восьмое, 1983 г.) *.
* В этом и в некоторых других справочниках приводятся значения стандартной энтальпии образования 


Пример 1. Вычислить 

Вычисление 

Поскольку изменение энтальпии реакции равно по величине, но обратно по знаку ее тепловому эффекту при постоянных температуре и давлении, то термохимическое уравнение реакции запишется следующим образом:
При низких температурах знак изменения энтальпии реакции может служить для ориентировочного определения возможного направления реакции. Полученное для рассматриваемой реакции отрицательное значение ∆Н° указывает на возможность ее самопроизвольного протекания при достаточно низких температурах; при этом большое абсолютное значение ∆Н° позволяет с достаточной вероятностью предполагать, что в условиях, не очень сильно отличающихся от стандартных, эта реакция тоже может протекать в прямом направлении.
Вычисление 

Полученное отрицательное значение 




Большое абсолютное значение 

Пример 2. Вычислить 

Вычисление реакции. Находим в табл. 7 
Полученное значение 
Вычисление 

Полученное значение 
В данном примере разные знаки 

Пример 3. Вычислить константу равновесия реакции:
Прежде всего определим 

Теперь найденное значение 
Большое значение найденной нами константы показывает, что при стандартной температуре равновесие
сильно смещено вправо; иначе говоря, при 25 С С хлорид аммония—устойчивое соединение.
Услуги по химии:
Лекции по химии:
Лекции по неорганической химии:
Лекции по органической химии:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
http://www.poznavayka.org/himiya/himicheskie-reaktsii-tipyi-svoystva-uravneniya/
http://natalibrilenova.ru/protekanie-himicheskih-reaktsij/