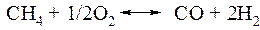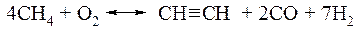Получение химических продуктов на основе
синтез газа (СО + Н2)
Впервые синтез-газ был получен газификацией каменного угля ещё в 30-е годы XIX века в Англии с целью получения горючих газов (водорода, метана, монооксида углерода). Этот процесс широко использовался многими странами до 50-х годов XX века, а затем был вытеснен методами, использующими в качестве сырья нефть и природный газ. Следует отметить, что в последнее время газификация снова становится актуальной в связи с наступающим дефицитом нефти и, в перспективе, природного газа.
В настоящее время промышленная переработка природного газа обязательно включает в себя стадию получения синтез-газа. Синтез на основе СО и Н2 представляет огромный интерес, т. к. позволяет из двух простейших соединений получить ценные химические продукты. Развитие таких синтезов дало новый толчок исследованию катализаторов, способных активировать инертные молекулы СО и Н2 (активация молекул — это перевод их в более реакционноспособное состояние). Широкое развитие в этой области получил катализ комплексами переходных металлов (металлокомплексный) — новый тип катализа.
Смесь Н2 и СО можно получить из природного газа следующими способами:
а) Паровая конверсия природного газа водяным паром.
ΔН298ºС = -206 кДж/моль
б) Окисление природного газа кислородом.
ΔН298ºС = 41,2 кДж/моль
В промышленности часто совмещают эти оба способа.
в) окисление природного газа двуокисью углерода.
ΔН298ºС = -247 кДж/моль
г) Термоокислительный пиролиз метана (без катализаторов, в пламени частично сжигаемого метана) — производство ацетилена.
Экономическую целесообразность конверсии природного газа в синтез-газ и дальнейшей его переработки отражает соотношение стоимости сырьевого природного газа и продуктов его переработки:
Дата добавления: 2016-06-24 ; просмотров: 497 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Продукты переработки природного газа уравнение реакции
Назовите основные продукты химической переработки природного газа и укажите процессы, с помощью которых их получают. Запишите уравнения соответствующих реакций.
Основные продукты химической переработки природного газа
Синтез газ. Получают его с помощью процесса конверсии:
CH4 + H2O t ⟶ CO + 3H2
Из синтез газа получают синтетический бензин и метиловый спирт:
nCO + (2n + 1)H2 кат. ⟶ CnH2n+2 + nH2O
CO + 2H2 кат. ⟶ CH3OH
Углерод (сажу), водород и ацетилен. Получают их с помощью пиролиза:
CH4 t ⟶ C + 2H2
2CH4 t ⟶ C2H2 + 3H2
Продукты переработки природного газа уравнение реакции
FOR-DLE.ru — Всё для твоего DLE 😉
Привет, я Стас ! Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
Задание2
Назовите основные продукты химической переработки природного газа и укажите процессы, с помощью которых их получают. Запишите уравнения соответствующих реакций.
Углерод (сажа), водород и ацетилен. Процесс получения: пиролизом (нагреванием без доступа воздуха)
CH4 t ⟶ C + 2H2↑
2CH4 t ⟶ C2H2 + 3H2↑
Синтез-газ. Процесс получения: конверсия (превращение) водяных паров с метаном:
CH4 + H2O t ⟶ CO + 3H2↑
Бензин и метиловый спирт Процесс получения: промышленный синтез :
nCO + (2n+1) H2 кат. ⟶ CnH2n+2 + nH2O
CO + 2H2 кат. ⟶ CH3OH
Галогенпроизводные. Процесс получения: галогенирование (присоединение галогенов) :
CH4 + Cl2 свет ⟶ CH3Cl + HCl
CH3Cl + Cl2 свет ⟶ CH2Cl2 + HCl
CH2Cl2 + Cl2 свет ⟶ CHCl3 + HCl
CHCl3 + Cl2 свет ⟶ CCl4 + HCl
Задание 2
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) CH4 ⟶ HC≡CH ⟶ CH2=CHCl ⟶ (–CH2–CHCl–)n
2CH4 t ⟶ HC≡CH + 3H2
HC≡CH + HCl ⟶ CH2=CHCl
nCH2=CHCl кат. ⟶ (―CH2―CHCl―)n
б) CH4 ⟶ CH3Cl ⟶ CH3OH ⟶ CO2
CH4 + Cl2 свет ⟶ CH3Cl + HCl
CH3Cl + NaOH ⟶ CH3OH + NaCl
2CH3OH + 3O2 ⟶ 2CO2 + 4H2O
в) CH4 ⟶ CO ⟶ CnH2n+2
CH4 + H2O t ⟶ CO + 3H2
CO + 2H2 кат. ⟶ CnH2n+2 + nH2O
Задание 3
Укажите важнейшие месторождения природного газа в Российской Федерации. Найдите их на карте полезных ископаемых нашей страны. Уренгой, Ямбург, Бованенковское, Штокмановское, Ленинградское, Русановское, Заполярное, Медвежье, Астраханское, Западно-Камчатский шельф, Сахалин, Среднеботуобинское нефтегазоконденсатное месторождение, Оренбургское газоконденсатное месторождение, Игримское, Ледовое, Ковыктинское.
Задание 4 Объёмные доли алканов в природном газе некоторого месторождения равны: метан – 82%, этан – 12%, пропан – 6%. Определите их массовые доли.
Дано: φ(CH4)=82%, φ(C2H6)=12%, φ(C3H8)=6%
Найти: ω(CH4)-?, ω(C2H6)-?, ω(C3H8)-?
Решение
1. Допустим имеется 1 л природного газа. Вычисляем объём каждого газа в смеси природного газа:
V(CH4)=φ(CH4)•V(смеси) : 100%=82% • 1 л : 100%= 0,82 л
V(C2H6)=φ(C2H6)•V(смеси) : 100%=12% • 1 л : 100%= 0,12 л
V(CH4)=φ(C3H8)•V(смеси) : 100%=6% • 1 л : 100%= 0,06 л
2. Вычисляем массу каждого газа.
M(CH4)=16 г/моль, M(C2H6)=30 г/моль, M(C3H8)=44 г/моль
m(CH4)=V(CH4)•M(CH4):Vm=0,82 л • 16 г/моль : 22,4 л/моль = 0,586 г
m(C2H6)=V(C2H6)•M(C2H6):Vm=0,12 л • 30 г/моль : 22,4 л/моль = 0,161 г
m(C3H8)=V(C3H8)•M(C3H8):Vm=0,06 л • 44 г/моль : 22,4 л/моль = 0,118 г
3. Вычисляем массу смеси природного газа:
m(смеси)=m(CH4)+m(C2H6)+m(C3H8)=0,586 г + 0,160 г + 0,118 г = 0,864 г
4. Определяем массовые доли каждого газа в смеси природного газа.
ω(CH4)=(m(CH4):m(смеси)) •100% =(0,586 г : 0,864 г) • 100% = 67,8%
ω( C2H6 )=(m( C2H6 ):m(смеси)) •100% =(0,161 г : 0,864 г) • 100% = 18,6 %
ω( C3H8 )=(m( C3H8 ):m(смеси)) •100% =(0,118 г : 0,864 г) • 100% = 13,6 %
Ответ: ω(CH4)=67,8%, ω(C2H6)=18,6%, ω(C3H8)=13,6%
Задание 5 Рассчитайте объём воздуха (содержащего 20% кислорода), необходимого для сжигания 100 м 3 природного газа (н.у.), в котором объёмные доли метана, этана, пропана и азота равны соответственно 80%, 12%, 6% и 2%.
Дано: φ(O2)=20%, V(смеси)=100 м 3 , φ(CH4)=80%, φ(C2H6)=12%, φ(C3H8)=6%, φ(N2)=2%
Найти: V(воздуха)-?
Решение
В смеси природного газа азот не поддерживает горение.
1. Вычисляем объём метана, этана и пропана в смеси природного газа:
V(CH4)=φ(СН4)•V(смеси):100%=80%•100 м 3 :100%=80 м 3
V(C2H6)=φ(C2H6)•V(смеси):100%=12%•100 м 3 :100%=12 м 3
V(C3H8)=φ(С3Н8)•V(смеси):100%=6%•100 м 3 :100%=6 м 3
2. Составляем химические уравнения сжигания метана, этана и пропана:
СН4 + 2О2 → СО2 + 2Н2О (1)
2С2Н6 + 7О2 → 4СО2 + 6Н2О (2)
2С3Н8 + 10О2 → 6СО2 + 8Н2О (3)
Согласно закону объёмных отношений Гей-Люссака по уравнению реакции (1) имеем V(СН4):V1(О2)=1:2 , поэтому
V1(О2)=2•V(CH4)=2•80 м 3 =160 м 3
Согласно закону объёмных отношений Гей-Люссака п о уравнению реакции (2) имеем V(С2Н6):V2(О2)=2:7 , отсюда по свойству пропорции имеем 2•V(O2)=7•V(C2H6), поэтому V2(О2)=7•V(C2H6):2=7•12 м 3 : 2=42 м 3
Согласно закону объёмных отношений Гей-Люссака п о уравнению реакции (3) имеем V(С3Н8):V3(О2)=2:10=1:5 , поэтому
V3(О2)=5•V(C3H8)=5•6 м 3 =30 м 3
3. Рассчитываем общий объём кислорода, необходимый для сжигания 100 м 3 природного газа:
http://gomolog.ru/reshebniki/10-klass/gabrielyan-2019/8/1.html
http://gdz.cool/h10_gos_2019/881-h10_gos_2019______8.html