Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
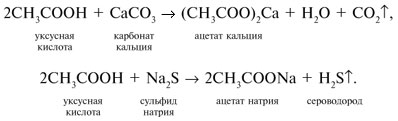
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Урок 27. Химические свойства карбоновых кислотРассмотрим химические свойства карбоновых кислот на примере уксусной кислоты.
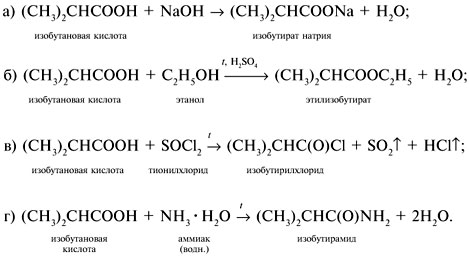
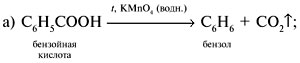
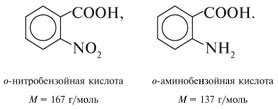
Если М = а = 90, то у = (3,26 – 0,03•90)/14 = 0,56/14 = 0,04 моль, что не соответствует условию задачи, где х + у = 0,03 моль. Если М = а = 104, то у = (3,26 – 0,03•104)/14 = 0,01 моль. Следующий гомолог: М = а = 118 г/моль не подходит, т.к. тогда количество вещества у = (3,26 – 0,03•118)/14 = –0,02 моль – отрицательная величина. Ответ. В состав смеси входили кислоты НООССН2СООН (0,02 моль) и НООССН2СН2СООН УПРАЖНЕНИЯ. 1. Составьте уравнения реакций бензойной кислоты С6Н5СООН со следующими реагентами: 2. Запишите уравнения реакций бензойной кислоты, в которых происходит расщепление связи 3. Составьте уравнения реакций, с помощью которых изобутановую кислоту (СН3)2СНСООН можно превратить в следующие соединения: а) изобутират натрия (СН3)2СНСООNa; 4. Составьте уравнения реакций: а) декарбоксилирование бензойной кислоты С6Н5СООН до бензола под действием горячего раствора КМnО4; б) восстановление бензольного кольца бензойной кислоты (Н2, Ni, 20 °С, 1 атм) с образованием циклогексанкарбоновой кислоты; 5. Неизвестная кислота может быть либо орто-нитробензойной кислотой (tпл = 147 °С), либо орто-аминобензойной (антраниловой) кислотой (tпл = 146 °С). При нейтрализации 0,201 г образца этой кислоты расходуется 12,4 мл раствора щелочи с концентрацией 0,098 моль/л NaOH. Какая это кислота? 6. К 24,4 г смеси уксусной и муравьиной кислот прибавили 227,3 мл 10%-го раствора гидроксида натрия (плотность – 1,1 г/мл). Для связывания избытка щелочи с образованием кислой соли потребовалось 2,8 л (н.у.) оксида серы(IV). Определите состав исходной смеси кислот. 7. После прокаливания натриевой соли пропионовой кислоты RCOONa получен белый остаток, растворимый в воде. Этот остаток изменяет окраску влажного красного лакмуса в синий цвет и реагирует с разбавленной соляной кислотой с выделением пузырьков газа. Какой возможный состав остатка? Напишите уравнение реакции термического разложения натриевой соли пропионовой кислоты во влажном воздухе. Ответы на упражнения к теме 2Урок 271. а) С6Н5СООН + КОН 2. 3. 4. 5. Найдем количество вещества NaOH в объеме V = 12,4 мл (0,0124 л) раствора с молярной концентрацией cмол(NaOH) = 0,098 моль/л:
Количества веществ одноосновной кислоты RCOOH и щелочи NaOH, расходуемые в реакции нейтрализации, одинаковые, т.е. Ответ. орто-Нитробензойная кислота. 6. Масса NaOH, содержащегося в заданном объеме V = 227,3 мл с концентрацией c(NaOH) = 10% и плотностью Избыток щелочи (m*) найдем из уравнения реакции: В реакции со смесью кислот НСООН и СН3СООН израсходовалось 20 г NaOH.
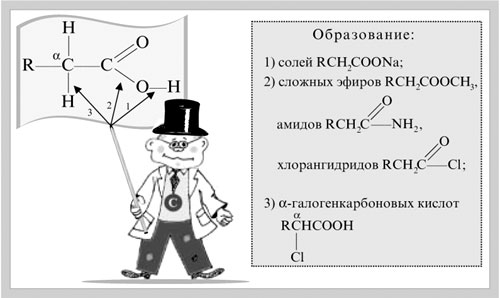
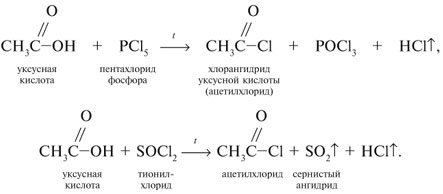
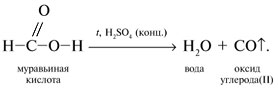
Запишем уравнения реакций: Расход количества вещества щелочи в реакциях (1) и (2) такой же, как у кислот. Зная общую массу смеси кислот (m(смеси) = 24,4 г) и расход щелочи (20 г), составим систему двух уравнений с двумя неизвестными: Решая систему, найдем: у = 0,1 моль, z = 0,4 моль. По массе это составляет: m(CH3COOH) = 0,1•60 = 6 г, Концентрация в процентах по массе: Ответ. Состав исходной смеси кислот – 6 г (24,6%) СН3СООН и 18,4 г (75,4%) НСООН. 7. Уравнение реакции термического разложения натриевой соли пропионовой кислоты во влажном воздухе: Белый остаток после прокаливания – это сода Na2CO3. В воде сода растворяется и гидролизуется: Образующаяся щелочь NaOH окрашивает красный лакмус в синий цвет. Сода реагирует с кислотой НСl с выделением газа СО2: Уксусной кислоты с хлоридом фосфора 5. Химические свойстваКарбоновые кислоты образуют разнообразные производные (сложные эфиры, ангидриды, амиды и др.), которые участвуют во многих важных реакциях. Общая формула производных карбоновых кислот: где ацильный радикал может быть связан с остатками (Х ) спирта, аммиака, карбоновой кислоты и других соединений, образуя соответствующие производные. 4.2.2.1 ГАЛОГЕНАНГИДРИДЫ – (ацилгалогениды) кислот рассматривают функциональные производные, которые получаются замещением ОН -группы карбоксила на галоген. Простейшие галогенангидриды карбоновых кислот представляют собой жидкости с резким запахом. Они энергично реагируют с водой, образуя соответствующие карбоновые кислоты. Вследствие малой подвижности ОН -группы в карбоксиле это замещение осуществляют при взаимодействии карбоновых кислот с галогенидами фосфора или хлористым тионилом как более сильными нуклеофилами. 1. Взаимодействие с хлоридом фосфора (V):2. Взаимодействие с тионилхлоридом:Характеристика реакционной способности. Галогенангидриды относятся к соединениям с высокой реакционной способностью. Они легко обменивают галоген на нуклеофильные группы, поскольку на реакционном центре (С -атоме карбонильной группы) имеется дефицит электронов, эти превращения могут быть отнесены к S N реакциям. Для ацилгалогенидов характерна большая полярность связей, что вызвано электроноакцепторным действием атома галогена. Электронная плотность на углеродном атоме карбоксильной группы сильно занижена. Ацилгалогениды обладают сильными электрофильными свойствами. Химические свойства. Хлорангидриды применяются в качестве ацилирующих средств для введения ацильного радикала в различные классы органических соединений. 1. Гидролиз:5. Получение пероксидов ацилов. Перекись ацила образуется при взаимодействии растворов хлористого ацетила в эфире или пентане с пероксидом водорода и гидроксидом натрия или с пероксидами металлов (пероксидами натрия или бария): 6. Реакции с алкоголятом натрия и ацетатом серебра: 4.2.2.2 АНГИДРИДЫ КИСЛОТ –ангидриды кислот можно рассматривать как продукты межмолекулярной дегидратации кислот. Однако реакция дегидратации протекает только в жестких условиях, и чаще всего ангидриды получают реакцией ацилирования солей карбоновых кислот хлорангидридами, при этом может быть получен и смешанный ангидрид. Ангидриды карбоновых кислот – бесцветные жидкости или кристаллические вещества. Ангидриды низших карбоновых кислот – жидкости с резким запахом, кипящие при температуре более высокой, чем соответствующие им кислоты. Ангидриды плохо растворимы в воде. Водный раствор уксусного ангидрида медленно гидролизируется. Ацидолиз карбоновых кислот: 1. Использование ангидридов как ацилирующих средств. Ангидриды, как и галогенангидриды, обладают большой химической активностью, являются хорошими ацилирующими средствами (часть 1, глава 8.5.2, часть 2, глава 2, 3.3, часть 3, глава 1), вступая в те же реакции, что и галогенангидриды, однако менее энергично: 4.2.2.3 АМИДЫ КАРБОНОВЫХ КИСЛОТ – функциональные производные кислот, в которых гидроксил карбоксильной группы замещен на аминогруппу. У амидов в аминогруппе атомы водорода могут быть замещены на углеводородные радикалы. В таком случае их называют N -алкил- или N -ариламидами. Амиды также можно рассматривать как производные аммиака, у которого атом водорода замещен на ацильный остаток. Амиды представляют собой бесцветные кристаллические вещества или жидкости, растворяющиеся в воде и органических растворителях. Амиды, в молекулах которых имеются связи N–Н , ассоциированы вследствие образования межмолекулярных водородных связей и имеют более высокие температуры кипения. В амидной группе связи делокализованы благодаря плоскому строению и наличию n ,π -сопряженной системы. Это приводит к перераспределению электронной плотности: на атоме азота электронная плотность по сравнению с аммиаком и аминами понижается, а на углеродном атоме по сравнению с альдегидами и кетонами повышается. Амиды с низкой молекулярной массой высокополярны и хорошо растворимы в воде. Их часто используют в качестве растворителей. В молекулах амидов осуществляется значительное взаимодействие между НЭП атома азота и π -электронной системой двойной связи С=О . Образуется сопряженная система связей, изменяются природа связей С–N и С–О и распределение электронной плотности. В результате связь С–N становится короче, а связь С=О несколько длиннее по сравнению с несопряженными соединениями: Сравнение основных свойств аминов и амидов. Основность амидов меньше, чем у аммиака и алифатических аминов. В молекуле амида есть два основных центра электрофильной атаки – атомы азота и кислорода, к которым может присоединяться протон. На атоме азота электронная плотность понижена и более выгодной является атака протона по кислороду, при которой сохраняется стабильная сопряженная система связей. Амиды, содержащие N – H связи, обладают слабокислыми свойствами, но являются более сильными кислотами, чем аммиак. В водном растворе амиды дают нейтральную реакцию. Однако, при взаимодействии с активными металлами амиды, содержащие N – H связи, отщепляют протон, так как при этом образуется стабилизированный делокализацией отрицательного заряда амид-анион. потеря сопряженной системы сопряженная система сохраняется У циклических амидов (имидов) кислотность выражена более ярко, так как атом азота находится под влиянием двух карбонильных групп. По сравнению с аминами амиды карбоновых кислот являются слабыми основаниями ввиду сильного взаимодействия неподеленной электронной пары атома азота с карбонильной группой. Способы получения амидов CH3COOH + PCl5 = CH3COCl(ацтилхлорид) + POCl3(хлороокись фосфора) + HCl. Вы находитесь на странице вопроса «написать уравнение реакции. а)пропиловой кислоты с гидроксидом натрия б)уксусная кислота с хлоридом фосфора (5) в). Текст доступен по лицензии Creative Commons Attribution-ShareAlike ; в отдельных случаях могут действовать дополнительные условия. Карбоновые кислоты обладают всеми свойствами обычных кислот. Вопросы — лидеры Кто знает или сможет создать очень вонючий и стойкий запах, которым можно было побрызгать или помазать и запах не провет 1 ставка. Материал из Википедии — свободной энциклопедии. Ацетилирование ацетилхлоридом часто проводят в присутствии неорганический оснований гидроксид, карбонат или ацетат натрия — реакция Шоттена-Баумана либо третичных аминов пиридинтриэтиламин — модификация Айнхорна активируют ацетилхлорид за счёт образования ацетиламмонийных солей и нейтрализуют образующийся HCl. Взаимодействие с хлоридом фосфора V: Вследствие электроноакцепторного влияния карбоксильной группы СООН атомы водорода при углероде в -положении довольно подвижные и могут замещаться на атомы хлора или брома:. Методы синтеза В промышленности ацетилхлорид синтезируют реакцией уксусной кислоты с хлоридами фосфора треххлористым или пятихлористым фосфором: Органическая плз помогите вн koko channel Ученикзакрыт 6 лет назад Дополнен 6 лет. По сравнению с аминами амиды карбоновых кислот являются слабыми основаниями ввиду сильного взаимодействия неподеленной электронной пары атома азота с карбонильной группой. Обозначим количества веществ уксусной кислоты и муравьиной кислоты:. Амиды представляют собой бесцветные кристаллические вещества или жидкости, растворяющиеся в воде и органических растворителях. В промышленности ацетилхлорид синтезируют реакцией уксусной кислоты с хлоридами фосфора треххлористым или пятихлористым фосфором:. Ирина Рудерфер Высший разум 6 лет назад при взаимодействии уксусной кислоты с металлическим натрием: Подскажите, как решить данные неравенства 1 ставка. Общая формула производных карбоновых кислот: 1. Роял рц точка biz; Ацетилхлорид также используется для ацетилирования ароматических соединений по Фриделю-Крафтсу. Белый остаток после прокаливания — это сода Na 2 CO 3. Запишите уравнения реакций бензойной кислоты, в которых происходит расщепление связи С-ОН в карбоксильной группе. Хлорангидриды получают действием хлорида фосфора V на кислоты: Обозначим количества веществ уксусной кислоты и муравьиной кислоты:. В промышленности ацетилхлорид синтезируют реакцией уксусной кислоты с хлоридами фосфора треххлористым или пятихлористым фосфором:. При нагревании амидов с водоотнимающими средствами например, с пентаоксидом фосфора Р 2 О 5 образуются нитрилы карбоновых кислот:. Химические свойства. ПолучениеАцетилхлорид — это Что такое Ацетилхлорид?АцетилхлоридА. С 2 Н 5 СОН Б. НСООН В. С 2 Н 5 СООСН 3 Г. СН 3 ОН 2. Напишите уравнения реакция: A. Этанола с пропионовой кислотой Б. Окисления муравьиного альдегида гидроксидом меди (II). B. Этилового эфира Уксусной кислоты с гидроксидом натрия. СН 4 → С 2 Н 2 → СН 3 СОН → СН 3 СООН → (CH 3 COO) 2 Mg. 4. Рассчитайте массу кислоты, полученной при нагревании 55 г 40% -го раствора этаналя с избытком гидроксида меди (II) Самостоятельная работа по теме «Кислородсодержащие органические соединения» 11 класс 1. Определите классы соединений, дайте названия веществ, формулы которых: А. СН 2 ОН-СНОН-СН 2 ОН Б. С 6 Н 5 -СН 2 ОН В. СН 3 ОСН 3 Г. СН 3 СОО СН 3 A. Пропионовой кислоты с гидроксидом натрия. Б. Уксусной кислоты с хлоридом фосфора (5). B. Гидролиза пропилового эфира уксусной кислоты (пропилэтаноата). Укажите их тип, условия осуществления и назовите исходные вещества и продукты реакций. 3. Напишите уравнения реакций, при помощи которых можно осуществить превращения по СН 4 → СН 3 С1 → СН 3 ОН → НСОН → НСООН. Укажите условия осуществления реакций и названия всех веществ. 4. Вычислите массу 60%-й уксусной кислоты, затраченной на нейтрализацию 120 г 25% -го раствора гидроксида натрия. Самостоятельная работа по теме «Кислородсодержащие органические соединения» 11 класс 1. Определите классы соединений, дайте названия веществ, формулы которых: А. С 3 Н 7 СООН. Б. С 2 Н 5 ОН В. НСООСН 3 . Г. С 6 Н 5 ОН. 2. Напишите уравнения реакций: A. Муравьиной кислоты с оксидом магния. Б. Межмолекулярной дегидратации спирта пропанол-1. B. Гидролиза тристеаринового жира. Укажите их тип, условия осуществления и назовите исходные вещества и продукты реакций. 3. Напишите уравнения реакций, при помощи которых можно осуществить превращения С 2 Н 6 →С 2 Н 5 Вr → С 2 Н 5 ОН → СН 3 СОН →СН 3 СООН. Укажите условия осуществления реакций и названия всех веществ. 4. Вычислите массу металлического серебра, полученного при окислении 600 г 40% -го раствора формалина избытком аммиачного раствора оксида серебра. Способы получения . 1 . Окисление альдегидов и первичных спиртов — общий способ получения карбоновых кислот. В качестве окислителей применяются />K М n О 4 и K 2 С r 2 О 7 . 2 Другой общий способ — гидролиз галогензамещенных углеводородов, содержащих, три атома галогена у одного атома углерода. При этом образуются спирты, содержащие группы ОН у одного атома углерода — такие спирты неустойчивы и отщепляют воду с образованием карбоновой кислоты:/>
3 . Получение карбоновых кислот из цианидов (нитрилов) — это важный способ, позволяющий наращивать углеродную цепь при получении исходного цианида. Дополнительный атом углерода вводят в состав молекулы, используя реакцию замещения галогена в молекуле галогенуглеводорода цианидом натрия, например:/> СН 3 -В r + NaCN → CH 3 — CN + NaBr . Образующийся нитрил уксусной кислоты (метилцианид) при нагревании легко гидролизуется с образованием ацетата аммония: CH 3 CN + 2Н 2 О → CH 3 COONH 4 . При подкислении раствора выделяется кислота: CH 3 COONH 4 + HCl → СН 3 СООН + NH 4 Cl . 4 . Использование реактива Гриньяра по схеме:/> Н 2 О 5 . Гидролиз сложных эфиров:/> R — COOR 1 + КОН → R — COOK + R ‘ OH , R — COOK + HCl → R — COOH + KCl . 6 . Гидролиз ангидридов кислот:/> (RCO ) 2 O + Н 2 О → 2 RCOOH . 7 . Для отдельных кислот существуют специфические способы получения./> Муравьиную кислоту получают нагреванием оксида углерода ( II ) с порошкообразным гидроксидом натрия под давлением и обработкой полученного формиата натрия сильной кислотой: Уксусную кислоту получают каталитическим окислением бутана кислородом воздуха: 2С 4 Н 10 + 5 O 2 → 4СН 3 СООН + 2Н 2 О. Для получения бензойной кислоты можно использовать окисление монозамешенных гомологов бензола кислым раствором перманганата калия: 5С 6 Н 5 -СН 3 + 6 KMnO 4 + 9 H 2 SO 4 = 5С 6 Н 5 СООН + 3 K 2 SO 4 + 6 MnSO 4 + 14 H 2 O . Кроме того, бензойную кислоту можно получить из бензальдегида с помощью реакции Канниццаро . В этой реакции бензальдегид обрабатывают 40-60%-ным раствором гидроксида натрия при комнатной температуре. Одновременное окисление и восстановление приводит к образованию бензойной кислоты и соответственно фенилметанола (бензилового спирта): Химические свойства . Карбоновые кислоты — более сильные кислоты, чем спирты, поскольку атом водорода в карбоксильной группе обладает повышенной подвижностью благодаря влиянию группы СО. В водном растворе карбоновые кислоты диссоциируют:/> RCOOH Тем не менее из-за ковалентного характера молекул карбонов ых кислот указанное выше равновесие диссоциации достаточно сильно сдвинуто влево. Таким образом, карбоновые кислоты — это, как правило, слабые кислоты. Например, этановая (уксусная) кислота характеризуется константой диссоциации К а = 1,7*10 -5 . /> Заместители, присутствующие в молекуле карбоновой кислоты, сильно влияют на ее кислотность вследствие оказываемого ими индуктивного эффекта . Такие заместители, как хлор или фенильный радикал оттягивают на себя электронную плотность и, следовательно, вызывают отрицательный индуктивный эффект (-/). Оттягивание электронной плотности от карбоксильного атома водорода приводит к повышению кислотности карбоновой кислоты. В отличие от этого такие заместители, как алкильные группы, обладают электронодонорными свойствами и создают положительный индуктивный эффект, +I. Они понижают кислотность. Влияние заместителей на кислотность карбоновых кислот наглядно проявляется в значениях констант диссоциации K a для ряда кислот. Кроме того, на силу кислоты оказывает влияние наличие сопряженной кратной связи. Карбоновые кислоты Формула K a Пропионовая CH 3 CH 2 COOH 1,3*10 -5 Масляная CH 3 CH 2 CH 2 COOH 1,5*10 -5 Уксусная CH 3 COOH 1,7*10 -5 Кротоновая CH 3 — CH = CH — COOH 2,0*10 -5 Винилуксусная CH 2 =CH-CH 2 COOH 3,8*10 -5 Акриловая CH 2 =CH-COOH 5,6*10 -5 Муравьиная HCOOH 6,1*10 -4 Бензойная C 6 H 5 COOH 1,4*10 -4 Хлоруксусная CH 2 ClCOOH 2,2*10 -3 Тетроновая CH 3 — C ≡ C — COOH 1,3*10 -3 Дихлоруксусная CHCl 2 COOH 5,6*10 -2 Щавелевая HOOC — COOH 5,9*10 -2 Трихлоруксусная CCl 3 COOH 2,2*10 -1 Взаимное влияние атомов в молекулах дикарбоновых кислот приводит к тому, что они являются более сильными, чем одноосновные. 2. Образование солей. Карбоновые кислоты обладают всеми свойствами обычных кислот. Они реагируют с активными металлами, основными оксидами, основаниями и солями слабых кислот: 2 RCOOH + М g → (RCOO ) 2 Mg + Н 2 , 2 RCOOH + СаО → (RCOO ) 2 Ca + Н 2 О, RCOOH + NaOH → RCOONa + Н 2 О, RCOOH + NaHCO 3 → RCOONa + Н 2 О + СО 2 . Карбоновые кислоты — слабые, поэтому сильные минеральные кислоты вытесняют их из соответствующих солей: CH 3 COONa + HCl → СН 3 СООН + NaCl . Соли карбоновых кислот в водных растворах гидролизованы: СН 3 СООК + Н 2 О Отличие карбоновых кислот от минеральных заключается в возможности образования ряда функциональных производных. 3 . Образование функциональных производных карбоновых кислот. При замещении группы ОН в карбоновых кислотах различными группами (/>X ) образуются функциональные производные кислот, имеющие общую формулу R -СО- X ; здесь R означает алкильную либо арильную группу. Хотя нитрилы имеют другую общую формулу ( R — CN ), обычно их также рассматривают как производные карбоновых кислот, поскольку они могут быть получены из этих кислот. Хлорангидриды получают действием хлорида фосфора ( V ) на кислоты: R-CO-OH + РС l 5 → R-CO- Cl + РОС l 3 + HCl . источники: http://him.1sept.ru/2004/36/10.htm http://slovarslov.ru/uksusnoi-kisloty-s-hloridom-fosfora-5-himicheskie-svoistva.html |

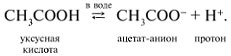
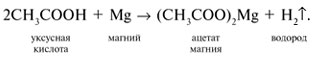
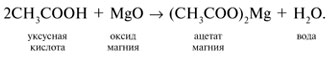
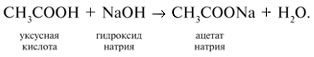
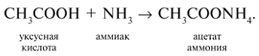
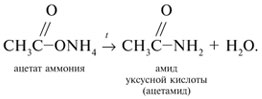
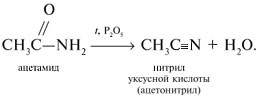
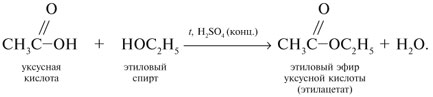
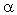 -положении довольно подвижные и могут замещаться на атомы хлора или брома:
-положении довольно подвижные и могут замещаться на атомы хлора или брома: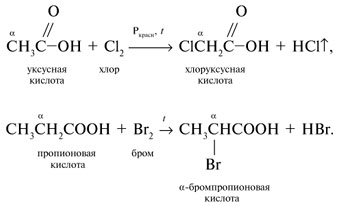
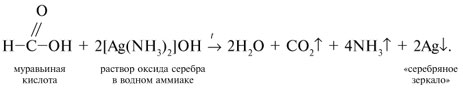
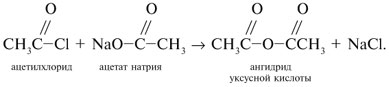
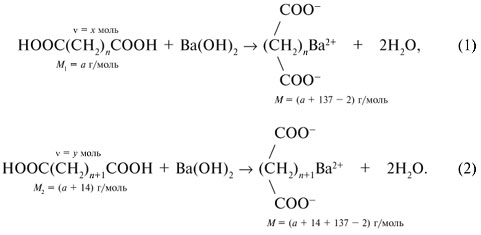
 = х моль других участвующих в реакции (1) веществ – Ва(ОН)2 и (СН2)n(СОО)2Ва. Аналогично в реакции (2):
= х моль других участвующих в реакции (1) веществ – Ва(ОН)2 и (СН2)n(СОО)2Ва. Аналогично в реакции (2): С6Н5СООК + Н2О;
С6Н5СООК + Н2О;  ;
; 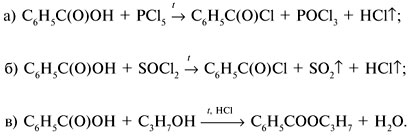
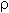 = 1,1 г/мл, составляет:
= 1,1 г/мл, составляет: 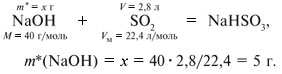
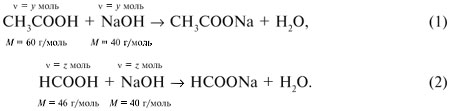
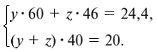
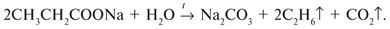














 RCOO — + Н +
RCOO — + Н +