Урок 14. Расчеты по уравнениям химических реакций
В уроке 14 «Расчеты по уравнениям химических реакций» из курса «Химия для чайников» мы научимся решать задачи, используя уравнения химических реакций.
Вещества вступают в химические реакции в определенных массовых и количественных соотношениях. Следовательно, при проведении реакций в лабораториях и на химических заводах расходуются определенные массы исходных веществ для получения заданной массы продуктов реакции.
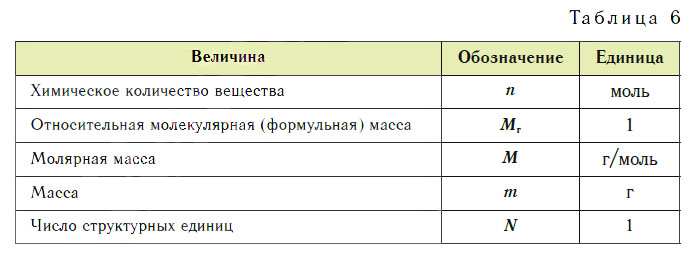
Эти расчеты проводят по уравнениям реакций. Единицы величин, которыми пользуются в химии, представлены в таблице 6.
При проведении любого вычисления по уравнению реакции нужно внимательно прочитать условие задачи. Особое в нимание обратите на расстановку коэффициентов, так как соотношение числа структурных единиц реагирующих веществ и получающихся продуктов реакции выражается в уравнениях коэффициентами так же, как и мольные отношения.
Для решения расчетной задачи необходим определенный порядок действий. Рассмотрим его на нескольких примерах.
Пример 1. Железо масс о й 224 г полностью прореагировало с хлором. Рассчитайте массу образовавшегося вещества FeCl3.
Расчеты по химическим уравнением
Разделы: Химия
Чему бы ты ни учился, ты
учишься для себя.
Петроний
Цели урока:
- познакомить учащихся с основными способами решения задач по химическим уравнениям:
- находить количество, массу и объём продуктов реакции по количеству, массе или объёму исходных веществ,
- продолжить формирование навыков работы с текстом задачи, умение аргументировано выбирать способ решения учебной задачи, умения составлять уравнения химических реакций.
- развивать умения анализировать, сравнивать, выделять главное, составлять план действия, делать выводы.
- воспитывать терпимость к другим, самостоятельность в принятии решений, умение объективно оценить результаты своего труда.
Формы работы: фронтальная, индивидуальная, парная, групповая.
Тип урока: комбинированный с применением ИКТ
Ход и содержание урока
I Организационный момент.
Здравствуйте ребята. Сегодня, мы с вами научимся решать задачи по уравнениям химических реакций. Слайд 1 (cм. презентацию).
Цели урока Слайд 2.
II.Актуализация знаний, умений, навыков.
Химия очень интересная и в то же время сложная наука. Для того чтобы знать и понимать химию, надо не только усваивать материал, но и уметь применять полученные знания. Вы узнали какие признаки указывают на протекание химических реакций, научились составлять уравнения химических реакций. Я надеюсь, что вы хорошо усвоили эти темы и без труда ответите на мои вопросы
Какое явление не является признаком химических превращений:
а) появление осадка; в) изменение объема;
а) уравнения реакций соединения
б) уравнения реакций замещения
в) уравнения реакций разложения Слайд 4
- Новая тема.
Для того, чтобы научиться решать задачи, необходимо составить алгоритм действий, т.е. определить последовательность действий.
Алгоритм для расчета по химическим уравнениям (у каждого учащегося на столе)
Для того, чтобы решить расчетную задачу по химии, можно воспользоваться следующим алгоритмом – сделать пять шагов:
1. Составить уравнение химической реакции.
2. Над формулами веществ записать известные и неизвестные величины с соответствующими единицами измерения (только для чистых веществ, без примесей). Если по условию задачи в реакцию вступают вещества, содержащие примеси, то сначала нужно определить содержание чистого вещества.
3. Под формулами веществ с известными и неизвестными записать соответствующие значения этих величин, найденные по уравнению реакций.
4. Составить и решить пропорцию.
5. Записать ответ.
Приступаем к решению задач, применяя алгоритм
Вычисление массы вещества по известной массе другого вещества, участвующего в реакции
Вычислите массу кислорода, выделившегося в результате разложения
порции воды массой 9 г.
Найдем молярную массу воды и кислорода:
Запишем уравнение химической реакции:
Над формулой в уравнении реакции запишем найденное
значение количества вещества, а под формулами веществ —
стехиометрические соотношения, отображаемые
Вычислим количество вещества, массу которого требуется найти.
Для этого составляем пропорцию
откуда х = 0,25 моль Слайд 7
Следовательно, n(O2)=0,25 моль
Найдем массу вещества, которую требуется вычислить
m(O2) = 0,25 моль • 32 г/моль = 8 г
Ответ: m(О2) = 8 г Слайд 8
Вычисление объема вещества по известной массе другого вещества, участвующего в реакции
Вычислите объем кислорода (н. у.), выделившегося в результате разложения порции воды массой 9 г.
Vm=22,4л/моль Слайд 9
Запишем уравнение реакции. Расставим коэффициенты
Над формулой в уравнении реакции запишем найденное значение количества вещества, а под формулами веществ — стехиометрические соотношения, отображаемые химическим уравнением
Вычислим количество вещества, массу которого требуется найти. Для этого составим пропорцию
откуда х = 0,25 моль
Найдем объем вещества, который требуется вычислить
Ответ: 5,6 л Слайд 11
III.Закрепление изученного материала.
Задачи для самостоятельного решения:
1.При восстановлении углем оксидов Fe2O3 и SnO2 получили по 20 г Fe и Sn. Сколько граммов каждого оксида было взято?
2.В каком случае образуется больше воды:
а) при восстановлении водородом 10 г оксида меди (I) (Cu2O) или
б) при восстановлении водородом 10 г оксида меди(II) (CuO)? Слайд 12
Проверим решение задачи 1
M(Fe)=56г/моль,
m(Fe2O3)=
Проверим решение задачи 2
4.
х моль = 0,07моль,
m (H2O) = 
n(CuO) = 10г/ 80г/моль = 0,125 моль
х моль = 0,125моль, n(H2O)=0,125 моль
Ответ: 2,25г Слайд 15
Домашнее задание: изучить материал учебника с. 45-47, решить задачу
Какую массу оксида кальция и какой объм углекислого газа (н.у.)
можно получить при разложении карбоната кальция массой 250г?
CaCO3 = CaO + CO Cлайд 16.
1. Габриелян О.С. Программа курса химии для 8-11 классов общеобразовательных учреждений. М. Дрофа 2006г.
2. Габриелян О.С. Химия. 8 класс. Учебник для общеобразовательных учреждений. Дрофа. М. 2005г.
3. Горбунцова С.В. Тесты по основным разделам школьного курса хииии. 8 — 9 классы.ВАКО, Москва,2006г.
4. Горковенко М.Ю.Поурочные разработки по химии. К учебникам О.С.Габриеляна, Л.С.Гузея, В.В.Сорокина, Р.П.Суровцевой и Г.Е.Рудзитиса, Ф.Г.Фельдмана. 8 класс.ВАКО, Москва, 2004г.
5. Габриелян О.С. Химия. 8 класс: Контрольные и проверочные работы. – М.: Дрофа, 2003.
6.Радецкий А.М., Горшкова В.П. Дидактический материал по химии для 8-9 классов: Пособие для учителя. – М.: Просвещение, 2000
Расчеты по химическим уравнениям
Для того, чтобы решить расчетную задачу по химии, можно воспользоваться следующим алгоритмом – сделать пять шагов:
1. Составить уравнение химической реакции.
2. Над формулами веществ записать известные и неизвестные величины с соответствующими единицами измерения (только для чистых веществ, без примесей). Если по условию задачи в реакцию вступают вещества, содержащие примеси, то сначала нужно определить содержание чистого вещества.
3. Под формулами веществ с известными и неизвестными записать соответствующие значения этих величин, найденные по уравнению реакций.
4. Составить и решить пропорцию.
5. Записать ответ.
Соотношение некоторых физико-химических величин и их единиц
Масса (m) : г ; кг ; мг
Кол-во в-ва (n) : моль ; кмоль ; ммоль
Молярная масса (M): г/моль ; кг/кмоль ; мг/ммоль
Объём (V) : л ; м 3 /кмоль; мл
Молярный объём(Vm) : л/моль ; м 3 /кмоль; мл/ммоль
Число частиц (N): 6•1023 (число Авагадро – NA); 6•1026 ; 6•1020
§ 29. Расчёты по химическим уравнениям
По химическим уравнениям можно рассчитать массу, объём и количество реагирующих и образующихся веществ.
Для расчётов очень важно выбрать соответствующие друг другу единицы измерения массы, объёма и количества веществ. С этой целью можно воспользоваться таблицей 7.
Таблица 7
Соотношение некоторых единиц физико-химических величин
Для того чтобы решить расчётную задачу по химии, можно воспользоваться следующим алгоритмом.
- Составить уравнение химической реакции.
- Перевести данные задачи (массу или объём) в количество вещества (моль, кмоль, ммоль).
Если по условию задачи в реакцию вступают вещества, содержащие примеси, то сначала надо определить массу чистого вещества, а затем рассчитать его количество; если в задаче речь идёт о растворе, то сначала надо вычислить массу растворённого вещества, которое затем перевести в количество вещества.
Задача 1. Рассчитайте объём водорода (н. у.), который потребуется для взаимодействия с 480 кг оксида железа (III). Вычислите количество вещества воды, которое при этом образуется.
2. а) Для того чтобы найти количество вещества оксида железа (III), сначала рассчитаем его молярную массу (в данном случае киломолярную, так как масса оксида железа (III) дана в килограммах (см. табл. 7)):
б) Найдём количество вещества оксида железа (III) в ки-ломолях, так как исходное данное в задаче предложено в килограммах:
3. Над формулой исходного вещества — оксида железа (III) — в уравнении реакции запишем найденное количество вещества — 3 кмоль, а количества веществ водорода и воды обозначим над их формулами соответственно через х и у:
4. а) Согласно уравнению реакции 1 кмоль оксида железа (III) взаимодействует с 3 кмоль водорода. Следовательно, 3 кмоль оксида железа (III) соответствует в три раза большее количество вещества водорода, т. е. х = 9 кмоль.
б) Рассчитаем объём водорода по найденному количеству вещества:
5. Согласно уравнению реакции из 1 кмоль оксида железа (III) образуется 3 кмоль воды, а из 3 кмоль оксида железа (III) — в три раза большее количество вещества воды, т. е. у = 9 моль.
Ответ: V(Н2) = 201,6 м 3 ; n(Н2O) = 9 кмоль.
Задача 2. Какой объём воздуха (н. у.) потребуется для взаимодействия с 270 г алюминия, содержащего 20% примесей? Какое количество вещества оксида алюминия при этом получится?
3. Над формулой алюминия в уравнении реакции запишем найденное количество — 8 моль, а количества кислорода и оксида алюминия обозначим соответственно через х и у:
4. Согласно уравнению реакции 4 моль алюминия взаимодействует с 3 моль кислорода, в результате чего получается 2 моль оксида алюминия. Следовательно, 8 моль алюминия соответствуют 6 моль кислорода и 4 моль оксида алюминия.
5. Рассчитаем объём кислорода по найденному количеству вещества:
V(O2) = б моль • 22,4 л/моль = 134,4 л.
6. Однако в задаче требуется найти объём не кислорода, а воздуха. В воздухе содержится 21% кислорода по объёму. Преобразуя формулу φ = V(O2)/V(возд), найдём объём воздуха:
Ответ: V(возд) = 640 л; n(Аl2O3) = 4 моль.
Задача 3. Какой объём водорода (н. у.) выделится при взаимодействии 730 г 30%-й соляной кислоты с необходимым по реакции количеством вещества цинка? Каково это количество вещества?
3. Над формулой хлороводорода в уравнении реакции запишем найденное количество вещества — 6 моль, а количество веществ цинка и водорода обозначим соответственно через х и у:
4. Согласно уравнению реакции 2 моль хлороводорода взаимодействует с 1 моль цинка, в результате чего получается 1 моль водорода. Следовательно, 6 моль хлороводорода соответствуют 3 моль цинка и 3 моль водорода.
5. Рассчитаем объём водорода по найденному количеству:
V(H2) = 3 моль • 22,4 л/моль = 67,2 л.
Ответ: V(H2) = 67,2 л; n(Zn) = 3 моль.
Ключевые слова и словосочетания
- Единицы важнейших величин.
- Алгоритм вычисления по уравнению реакции.
Работа с компьютером
- Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания.
- Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и словосочетаниям следующего параграфа.
Вопросы и задания
- Какой объём водорода (н. у.) и количество вещества соли образуется при взаимодействии соляной кислоты с 540 мг алюминия, содержащего 4% примесей?
- Какая масса оксида кальция получится при разложении 250 кг карбоната кальция, содержащего 20% примесей? Какой объём (н. у.) оксида углерода (IV) при этом выделится?
- Сколько молекул кислорода и какой объём водорода (н. у.) образуется при разложении 180 г воды?
- Придумайте условие задачи, в которой необходимо использовать приведённое ниже уравнение, и решите её:
Н3РO5 + 3NaOH = Na3PO4 + 3H2O.
Придумайте и решите задачу, в условиях которой была бы дана масса раствора вещества с определённой массовой долей растворённого вещества, а требовалось бы найти количество вещества одного из веществ и объём другого. При составлении задачи используйте уравнение реакции:
http://urok.1sept.ru/articles/612236
http://tepka.ru/himiya_8/29.html