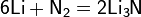Реакции с простыми веществами



Чтобы получить из пероксида оксид, пероксид восстанавливают металлом:
Со средними и малоактивными металлами реакция происходит при нагревании:
- С азотом реагируют только самые активные металлы, при комнатной температуре взаимодействует только литий, образуя нитриды:
- С серой реагируют все металлы, кроме золота и платины:
Железо взаимодействует с серой при нагревании, образуя сульфид:
- С водородом реагируют только самые активные металлы, то есть металлы IA и IIA групп, кроме Be. Реакции осуществляются при нагревании, при этом образуются гидриды. В реакциях металл выступает как восстановитель, степень окисления водорода −1:
- С углеродом реагируют только наиболее активные металлы. При этом образуются ацетилениды или метаниды. Ацетилениды при взаимодействии с водой дают ацетилен, метаниды — метан.
Получение и применение щелочных металловМеталлы, относящиеся к 1-й группе, в промышленности получают электролизом расплавов их галогенидов и других природных соединений. При разложении под действием электрического тока положительные ионы на катоде присоединяют электроны и восстанавливаются до свободного металла. На противоположном электроде происходит окисление аниона.
При электролизе расплавов гидроксидов на аноде окисляются частицы OH — , выделяется кислород и получается вода. Еще один метод заключается в термическом восстановлении щелочных металлов из расплавов их солей кальцием. Простые вещества и соединения элементов 1-й группы имеют практическое значение. Литий служит сырьем в атомной энергетике, используется в ракетной технике. В металлургии применяется для удаления остатков водорода, азота, кислорода, серы. Гидроксидом дополняют электролит в щелочных аккумуляторах.
Натрий необходим для атомной энергетики, металлургии, органического синтеза. Цезий и рубидий используются при изготовлении фотоэлементов. Широкое применение находят гидроксиды и соли, особенно хлориды, нитраты, сульфаты, карбонаты щелочных металлов. Катионы обладают биологической активностью, особенно важны для организма человека ионы натрия и калия.
55. Неметаллы. Общая характеристика Неметаллов.Получение и применение металлов.Химические св-ва Неметалов.
Немета́ллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системы. Расположение их в главных подгруппах соответствующих периодов следующее:
| Группа | I | III | IV | V | VI | VII | VIII |
| 1-й период | H | He | |||||
| 2-й период | B | C | N | O | F | Ne | |
| 3-й период | Si | P | S | Cl | Ar | ||
| 4-й период | As | Se | Br | Kr | |||
| 5-й период | Te | I | Xe | ||||
| 6-й период | At | Rn |
Характерной особенностью неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов. Это определяет их большую способность к присоединению дополнительных электронов, и проявлению более высокой окислительной активности, чем у металлов.
Неметаллы имеют высокие значения сродства к электрону, большую электроотрицательность и высокий окислительно-восстановительный потенциал.
Благодаря высоким значениям энергии ионизации неметаллов, их атомы могут образовывать ковалентные химические связи с атомами других неметаллов и амфотерных элементов. В отличие от преимущественно ионной природы строения соединений типичных металлов, простые неметаллические вещества, а также соединения неметаллов имеют ковалентную природу строения.
В свободном виде могут быть газообразные неметаллические простые вещества — фтор, хлор, кислород, азот, водород, инертные газы, твёрдые — иод, астат, сера, селен, теллур, фосфор, мышьяк, углерод, кремний, бор, при комнатной температуре в жидком состоянии существует бром.
У некоторых неметаллов наблюдается проявление аллотропии. Так, для газообразного кислорода характерны две аллотропных модификации — кислород (O2) и озон (O3), у твёрдого углерода множество форм — алмаз, астралены, графен, графит, карбин, лонсдейлит, фуллерены, стеклоуглерод, диуглерод, углеродные наноструктуры (нанопена, наноконусы, нанотрубки, нановолокна) и аморфный углерод уже открыты, а ещё возможны и другие модификации, например, чаоит и металлический углерод.
В молекулярной форме в виде простых веществ в природе встречаются азот, кислород и сера. Чаще неметаллы находятся в химически связанном виде: это вода, минералы, горные породы, различные силикаты, фосфаты, бораты. По распространённости в земной коре неметаллы существенно различаются. Наиболее распространёнными являются кислород, кремний, водород; наиболее редкими — мышьяк, селен, иод.
Выбор способа получения вещества зависит от того, в каком виде встречается в природе химический элемент, который образует данное вещество. Это в полной мере относится и к выбору способа получения неметаллических простых веществ.
Некоторые неметаллы встречаются в природе в свободном виде. Такие неметаллы, как кислород O2 , азот N2 , инертные газы — He и др., серу S , алмаз C и графит C , можно выделить из смесей или очистить от примесей, используя физические методы.
Химически активные неметаллы встречаются в природе только в виде соединений. В первую очередь это относится к галогенам: фтору, хлору, брому и иоду.
Минералы, образованные галогенами, — флюорит CaF2 (слева) и галит NaCl .
Химически менее активные неметаллы в природе встречаются как в самородном виде, так и составе химических соединений.
Например, серу можно найти как в самородном состоянии, так и в виде соединений — сульфидов и сульфатов.

Распространение серы природе. Слева направо: самородная сера S , пирит FeS2 и гипс CaSO4⋅2H2O .
Из химических соединений неметаллические простые вещества получают химическими методами в ходе различных химических превращений.
Химические методы получения неметаллов
Химические методы получения неметаллов связаны с проведением окислительно-восстановительных реакций, в ходе которых неметаллические химические элементы могут как повышать, так и понижать степень окисления.
Например, хлор Cl2 в промышленности получают путём электролиза раствора хлорида натрия NaCl . При пропускании постоянного электрического тока через раствор этого вещества, протекает химическая реакция:
Для того, чтобы получить кремний Si , в промышленности в электрических печах прокаливают смесь пескаSiO2 с коксом C . При этом протекает химическая реакция:
Лабораторные способы получения неметаллов также связаны с проведением окислительно-восстановительных реакций. Чаще всего это либо реакции разложения, либо реакции замещения.
Например, кислород O2 в лабораторных условиях можно получить путём разложения пероксида водородаH2O2 . Протекает реакция разложения:
Водород H2 в лаборатории можно получить, используя цинк Zn и соляную кислоту HCl . Протекает реакция замещения:
Поскольку свойства неметаллов чрезвычайно разнообразны, эти вещества находят широкое применение в различных отраслях народного хозяйства.
Таблица. Применение неметаллов.
| Область применения | Примеры |
| Промышленность | Такие неметаллы, как сера S , азот N2 , фосфорP и хлорCl2 используются в качестве сырья для получения кислот и другой продукции. Сера S используется в качестве сырья в производстве резин. Сажа C служит пигментом в производстве лаков и красок, а также пигментом и наполнителем в производстве пластмасс и резин. |
| Транспорт | Водород H2 используется в качестве топлива. Важно, что продукт сгорания этого топлива не загрязняет среду. |
| Сельское хозяйство | СераS используется как эффективное средство борьбы с вредителями и болезнями растений. |
| Медицина | Кислород O2 применяют в тех случаях, когда у больного затруднено дыхание. Активированный уголь C есть почти в каждой домашней аптечке. Точно так же, как иодная тинктура — спиртовой раствор иода I2 . Мази, в состав которых входит сера S , используются при лечении кожных заболеваний. Жидкий азот N2 используют не только для хранения биологического материала, но и в косметической медицине. |
| Подготовка воды | Для дезинфекции воды используют хлор Cl2 и озон O3 . |
| Получение высоких температур | В металлургии и металлообработке для того, чтобы, сжигая горючее вещество, создать среду с высокой температурой, испольуют кислород O2 . |
| Пиротехника | В производстве спичек и другой пиротехнической продукции используют серуS , фосфор P и уголь C . |
| Пищевая промышленность | Для продления срока годности пищевых продуктов и для создания инертной атмосферы в упаковку закачивается азот N2 . |
56. Группы элементов в периодической системе. Общая характеристика химические свойства.
К элементам главной подгруппы IV группы относятся углерод, кремний, германий, олово, свинец. Металлические свойства усиливаются, неметаллические — уменьшаются. На внешнем слое – 4 электрона.
Периодом называется совокупность элементов, которая начинается щелочным металлом и заканчивается инертным газом (особый случай — первый период). Каждый период содержит строго определенное количество элементов. Периодическая система состоит из восьми групп и семи периодов, причем седьмой пока не завершен.
Особенность первого периода заключается в том, что он содержит всего 2 элемента: водород и гелий. Место водорода в системе неоднозначно. Поскольку он проявляет свойства, общие со щелочными металлами и с галогенами, то его помещают либо в I А-, либо в VII А-подгруппу, причем последний вариант употребляется чаще. Гелий-первый представитель VIII А-подгруппы. Долгое время гелий и все инертные газы выделяли в самостоятельную нулевую группу. Это положение потребовало пересмотра после синтеза химических соединений криптона, ксенона и радона. В результате инертные газы и элементы бывшей VIII группы (железо, кобальт, никель и платиновые металлы) были объединены в рамках одной группы. Этот вариант не безупречен, так как инертность гелия и неона не вызывает сомнений.
Второй периодсодержит 8 элементов. Он начинается щелочным металлом литием, единственная степень окисления которого + 1. Далее следует бериллий (металл, степень окисления + 2). Бор проявляет уже слабо выраженный металлический характер и является неметаллом (степень окисления + 3). Следующий за бором углерод — типичный неметалл, который проявляет степень окисления как +4, так и — 4. Азот, кислород, фтор и неон — все неметаллы, причем у азота высшая степень окисления + 5 соответствует номеру группы; для фтора известна степень окисления + 7. Инертный газ неон завершает период.
Третий период (натрий — аргон) также содержит 8 элементов. Характер изменения их свойств во многом аналогичен тому, который наблюдался для элементов второго периода. Но здесь есть и своя специфика. Так, магний в отличие от бериллия более металличен, так же как и алюминий по сравнению с бором. Кремний, фосфор, сера, хлор, аргон — все это типичные неметаллы. И все они, кроме аргона, проявляют высшие степени окисления, равные номеру группы.
Как видим, в обоих периодах по мере увеличения Z наблюдается ослабление металлических и усиление неметаллических свойств элементов. Д. И. Менделеев называл элементы второго и третьего периодов (по его словам, малых) типическими. Элементы малых периодов принадлежат к числу самых распространенных в природе. Углерод, азот и кислород (наряду с водородом) — органогены, т.е. основные элементы органической материи.
Все элементы первого — третьего периодов размещаются в А-подгруппах.
Четвертый период (калий — криптон) содержит 18 элементов. По Менделееву, это первый большой период. После щелочного металла калия и щелочноземельного металла кальция следует ряд элементов, состоящий из 10 так называемых переходных металлов (скандий — цинк). Все они входят в b-подгруппы. Большинство переходных металлов проявляют высшие степени окисления, равные номеру группы, кроме железа, кобальта и никеля. Элементы, начиная с галлия и кончая криптоном, принадлежат к А-подгруппам. Криптон в отличие от предшествующих инертных газов может образовывать химические соединения.
Пятый период (рубидий — ксенон) по своему построению аналогичен четвертому. В нем также содержится вставка из 10 переходных металлов (иттрий — кадмий). У элементов этого периода есть свои особенности. В триаде рутений — родий — палладий для рутения известны соединения, где он проявляет степень окисления +8. Все элементы А-подгрупп проявляют высшие степени окисления, равные номеру группы, исключая ксенон. Можно заметить, что особенности изменения свойств у элементов четвертого и пятого периодов по мере роста Z имеют по сравнению со вторым и третьим периодами более сложный характер.
Шестой период (цезий — радон) включает 32 элемента. В этом периоде кроме 10 переходных металлов (лантан, гафний — ртуть) содержится еще и совокупность из 14 лантаноидов — от церия до лютеция. Элементы от церия до лютеция химически очень похожи, и на этом основании их давно включают в семейство редкоземельных элементов. В короткой форме периодической системы ряд лантан видов включают в клетку лантана и расшифровку этого ряда дают внизу таблицы.
В чем состоит специфика элементов шестого периода? В триаде осмий — иридий — платина для осмия известна степень окисления +8. Астат имеет достаточно выраженный металлический характер. Радон, по всей вероятности, обладает наибольшей реакционной способностью из всех инертных газов. К сожалению, из-за того, что он сильно радиоактивен, его химия мало изучена).
Седьмой период начинается с франция. Подобно шестому, он также должен содержать 32 элемента, но из них пока известен 21. Фракций и радий соответственно являются элементами I а- и I I а-подгрупп, актиний принадлежит к III b-подгруппе. Дальнейшее построение седьмого периода спорно. Наиболее распространено представление о семействе актиноидов, которое включает элементы от тория до лоуренсия и аналогично лантаноидам. Расшифровка этого ряда элементов также дается внизу таблицы.
57.Углерод и углеводороды. Клласификация и характеристика углеводорода.
Углеро́д (химический символ — C, лат. Carboneum) — химический элемент четырнадцатой группы (по устаревшей классификации — главной подгруппы четвёртой группы), 2-го периода периодической системы химических элементов. порядковый номер 6, атомная масса — 12,0107
Углеводоро́ды — органические соединения, состоящие исключительно из атомов углерода и водорода. Углеводороды считаются базовыми соединениями органической химии, все остальные органические соединения рассматривают как их производные.
Поскольку углерод имеет четыре валентных электрона, а водород — один, простейший углеводород — метан (CH4).При систематизации углеводородов принимают во внимание строение углеродного скелета и тип связей, соединяющих атомы углерода. В зависимости от строения углеродного скелета углеводороды подразделяют на ациклические и карбоциклические. В зависимости от кратности углерод-углеродных связей углеводороды подразделяют на предельные (алканы) и непредельные (алкены, алкины, диены). Циклические углеводороды разделяют на алициклические и ароматические.
| Ациклические (с открытой цепью) | Карбоциклические (с замкнутой цепью) | ||||
| предельные | непредельные | предельные | непредельные | ||
| с одинарной связью | с двойной связью | с тройной связью | с двумя двойными связями | с одинарной связью | с бензольным кольцом |
| ряд метана (алканы) | ряд этилена (алкены) | ряд ацетилена (алкины) | ряд диеновых углеводородов | ряд полиметиленов (нафтены) | ряд бензола (ароматические углеводороды, или арены) |
Углеводороды, как правило, не смешиваются с водой, поскольку атомы углерода и водорода имеют близкую электроотрицательность, и связи в углеводородах малополярны. Для предельных углеводородов характерны химические реакции замещения, а для непредельных — присоединения.
Основные источники углеводородов — нефть, природные газы и каменный уголь.
Сравнительная таблица углеводородов[править | править вики-текст]
| Характеристика | Алканы | Алкены | Алкины | Алкадиены | Циклоалканы | Арены |
| Общая формула | CnH2n+2 | CnH2n | CnH2n-2 | CnH2n-2 | CnH2n | CnH2n-6 |
| Строение | sp³-гибридизация — 4 электронных облака направлены в вершины тетраэдра под углами 109°28′. Тип углеродной связи — σ-связи | sp²-гибридизация, валентный угол 120°.Тип углеродной связи — π-связи. lc-c — 0,134 нм. | sp-гибридизация, молекула плоская (180°), тройная связь, lc-c — 0,120 нм. | lc-c — 0,132 нм — 0,148 нм, 2 или более π-связей. У каждого атома три гибридные sp²-орбитали. | sp³-гибридизация, валентный угол около 100° lc-c — 0,154 нм. | Строение молекулы бензола (6 р-электронов, n = 1), Валентный угол 120° lc-c — 0,140 нм, молекула плоская (6 π | σ) |
| Изомерия | Изомерия углеродного скелета, возможна оптическая изомерия | Изомерия углеродного скелета, положения двойной связи, межклассовая и пространственная | Изомерия углеродного скелета, положения тройной связи, межклассовая | Изомерия углеродного скелета, положения двойной связи, межклассовая и цис-транс-изомерия | Изомерия углеродного скелета, положения двойной связи, межклассовая и цис-транс-изомерия | Изомерия боковых цепей, а также их взаимного положения в бензольном ядре |
| Химические свойства | реакции замещения (галогенирование, нитрирование), окисления, радикальное галогенирование CH4 + Cl2 → CH3Cl + HCl (хлорметан), горения, отщепления (дегидрирование) | Реакции присоединения (гидрирование, галогенирование, гидрогалогенирование, гидратация), горения | Реакции присоединения (гидрирование, галогенирование, гидрогалогенирование, гидратация), горения | Реакции присоединения | Для колец из 3-4 атомов углерода — раскрытие кольца | Реакции электрофильного замещения |
| Физические свойства | С CH4 до C4H10 — газы; с C5H12 до C16H34 — жидкости; после C17H36 — твёрдые тела. | С C2H4 до C4H8 — газы; с C5H10 до C17H34 — жидкости, после C18H36 — твёрдые тела. | Алкины по своим физическим свойствам напоминают соответствующие алкены | Бутадиен — газ (t кип −4,5 °C), изопрен — жидкость, кипящая при 36 °C, диметилбутадиен — жидкость, кипящая при 70 °C. Изопрен и другие диеновые углеводороды способны полимеризоваться в каучук | С C3H6 до C4H8 — газы; с C5H10 до C16H32 — жидкости; после C17H34 — твёрдые тела. | Все ароматические соединения — твердые или жидкие вещества. Отличаются от алифатических и алициклических аналогов высокими показателями преломления и поглощения в близкой УФ и видимой области спектра |
| Получение | Восстановление галогенпроизводных алканов, восстановление спиртов, восстановление карбонильных соединений, гидрирование непредельных углеводородов, Реакция Вюрца. | Каталитический и высокотемпературный крекинг углеводородов нефти и природного газа, реакции дегидратации соответствующих спиртов, дегидрогалогенирование и дегалогенирование соответствующих галогенпроизводных | Основным промышленным способом получения ацетилена является электро- или термокрекинг метана. Пиролиз природного газа и карбидный метод. | Постадийное дегидрирование алканов, дегидрирование спиртов. | Гидрирование ароматических углеводородов, отщепление двух атомов галогена от дигалогеналканов | Дегидрирование циклогексана, тримеризация ацетилена, выделение из нефти |
58.Полимеры, пластмасса, характеристика свойств. Получение применение.
Полимеры или высокомолекулярные соединения (ВМС) – это сложные вещества с большими молекулярными массами, молекулы которых (макромолекулы) состоят из большого числа регулярно или нерегулярно повторяющихся структурных единиц (звеньев) одного или нескольких типов. Молекулярные массы полимеров могут быть от нескольких тысяч до миллионов.
По происхождению полимеры делят на:
1. Природные, биополимеры (полисахариды, белки, нуклеиновые кислоты, каучук, гуттаперча).
-Искусственные – полученные из природных путем химических превращений (целлулоид, ацетатное, медноамиачное, вискозное волокна).
1. Синтетические – полученные из мономеров (синтетические каучуки, волокна /капрон, лавсан/, пластмассы).
По составу:
2. Элементоорганические – делятся на три группы: основная цепь неорганическая, а ответвления органические; основная цепь содержит углерод и другие элементы, а ответвления органические; основная цепь органическая, а ответвления неорганические.
3. Неорганические – имеют главные неорганические цепи и не содержат органических боковых ответвлений (элементы верхних рядов III – VI групп).
По структуре макромолекулы:
1. Линейные (высокоэластичные).
3. Сетчатые (низкоэластичные).
По химическому составу:
1. Гомополимеры (содержат одинаковые мономерные звенья).
2. Гетерополимеры или сополимеры (содержат разные мономерные звенья)
По составу главной цепи:
1. Гомоцепные (в главную цепь входят атомы одного элемента).
2. Гетероцепные (в главную цепь входят разные атомы)
По пространственному строению:
1. Стереорегулярные – макромолекулы построены из звеньев одинаковой или разной пространственной конфигурации, чередующихся в цепи с определенной периодичностью.
2. Нестереорегулярные (атактические) – с произвольным чередованием звеньев разной пространственной конфигурацией.
По физическим свойствам:
1. Кристаллические (имеют длинные стереорегулярные макромолекулы)
По способу получения:
По свойствам и применению:
Химические свойства простых веществ. Химические свойства сложных вещест
Характерные химические свойства простых веществ — металлов: щелочных, щелочноземельных, алюминия, переходных металлов — меди, цинка, хрома, железа
Простые вещества — металлы
С развитием производства металлов (простых веществ) и сплавов связано возникновение цивилизации (бронзовый век, железный век).
Начавшаяся примерно $100$ лет назад научно-техническая революция, затронувшая и промышленность, и социальную сферу, также тесно связана с производством металлов. На основе вольфрама, молибдена, титана и других металлов начали создавать коррозионностойкие, сверхтвердые, тугоплавкие сплавы, применение которых сильно расширило возможности машиностроения. В ядерной и космической технике из сплавов вольфрама и рения делают детали, работающие при температурах до $3000°С$; в медицине используют хирургические инструменты из сплавов тантала и платины, уникальной керамики на основе оксидов титана и циркония.
И, конечно же, мы не должны забывать, что в большинстве сплавов используют давно известный металл железо, а основу многих легких сплавов составляют сравнительно «молодые» металлы — алюминий и магний.
Сверхновыми стали композиционные материалы, представляющие, например, полимер или керамику, которые внутри (как бетон железными прутьями) упрочнены металлическими волокнами из вольфрама, молибдена, стали и других металлов и сплавов — все зависит от поставленной цели и необходимых для ее достижения свойств материала.
Вы уже имеете представление о природе химической связи в кристаллах металлов. Напомним на примере одного из них — натрия, как она образуется. На рисунке изображена схема кристаллической решетки натрия. В ней каждый атом натрия окружен восемью соседями. У атома натрия, как и у всех металлов, имеется много свободных валентных орбиталей и мало валентных электронов. Электронная формула атома натрия: $1s^<2>2s^<2>2p^<6>3s^<1>3p^<0>3d^<0>$, где $3s, 3p, 3d$ — валентные орбитали.
Единственный валентный электрон атома натрия $3s^1$ может занимать любую из девяти свободных орбиталей — $3s$ (одна), $3р$ (три) и $3d$ (пять), ведь они не очень отличаются по уровню энергии. При сближении атомов, когда образуется кристаллическая решетка, валентные орбитали соседних атомов перекрываются, благодаря чему электроны свободно перемещаются с одной орбитали на другую, осуществляя связь между всеми атомами кристалла металла.
Такую химическую связь называют металлической. Металлическую связь образуют элементы, атомы которых на внешнем слое имеют мало валентных электронов по сравнению с большим числом внешних энергетически близких орбиталей. Их валентные электроны слабо удерживаются в атоме. Электроны, осуществляющие связь, обобществлены и перемещаются по всей кристаллической решетке в целом нейтрального металла.
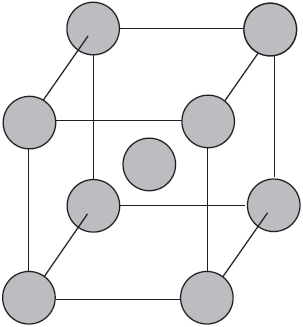
Веществам с металлической связью присущи металлические кристаллические решетки, которые обычно изображают схематически так, как показано на рисунке. Катионы и атомы металлов, расположенные в узлах кристаллической решетки, обеспечивают ее стабильность и прочность (обобществленные электроны изображены в виде черных маленьких шариков).
Металлическая связь — это связь в металлах и сплавах между атомионами металлов, расположенными в узлах кристаллической решетки, осуществляемая обобществленными валентными электронами.
Некоторые металлы кристаллизуются в двух или более кристаллических формах. Это свойство веществ — существовать в нескольких кристаллических модификациях — называют полиморфизмом.
Например, железо имеет четыре кристаллических модификации, каждая из которых устойчива в определенном температурном интервале:
- $α$ — устойчива до $768°С$, ферромагнитная;
- $β$ — устойчива от $768$ до $910°С$, неферромагнитная, т.е. парамагнитная;
- $γ$ — устойчива от $910$ до $1390°С$, неферромагнитная, т.е. парамагнитная;
- $δ$ — устойчива от $1390$ до $1539°С$ ($t°_ <пл.>железа), неферромагнитная.
Олово имеет две кристаллические модификации:
- $α$ — устойчива ниже $13,2°С$ ($ρ=5,75 г/см^3$). Это серое олово. Оно имеет кристаллическую решетку типа алмаза (атомную);
- $β$ — устойчива выше $13,2°С$ ($ρ=6,55 г/см^3$). Это белое олово.
Белое олово — серебристо-белый очень мягкий металл. При охлаждении ниже $13,2°С$ он рассыпается в серый порошок, т.к. при переходе $β→α$ значительно увеличивается его удельный объем. Это явление получило название «оловянной чумы».
Конечно, особый вид химической связи и тип кристаллической решетки металлов должны определять и объяснять их физические свойства.
Каковы же они? Это металлический блеск, пластичность, высокая электрическая проводимость и теплопроводность, рост электрического сопротивления при повышении температуры, а также такие значимые свойства, как плотность, высокие температуры плавления и кипения, твердость, магнитные свойства.
Давайте попробуем объяснить причины, определяющие основные физические свойства металлов.
Почему металлы пластичны?
Механическое воздействие на кристалл с металлической кристаллической решеткой вызывает смещение слоев ион-атомов друг относительно друга, а так как электроны перемещаются по всему кристаллу, разрыв связей не происходит, поэтому для металлов характерна большая пластичность.
Аналогичное воздействие на твердое вещество с ковалентными связями (атомной кристаллической решеткой) приводит к разрыву ковалентных связей. Разрыв связей в ионной решетке приводит к взаимному отталкиванию одноименно заряженных ионов. По этому вещества с атомными и ионными кристаллическими решетками хрупкие.
Наиболее пластичные металлы — это $Au, Ag, Sn, Pb, Zn$. Они легко вытягиваются в проволоку, поддаются ковке, прессованию, прокатыванию в листы. Например, из золота можно изготовить золотую фольгу толщиной $0,003$ мм, а из $0,5$ г этого металла можно вытянуть нить длиной $1$ км.
Даже ртуть, которая, как вы знаете, при комнатной температуре жидкая, при низких температурах в твердом состоянии становится ковкой, как свинец. Не обладают пластичностью лишь $Bi$ и $Mn$, они хрупкие.
Почему металлы имеют характерный блеск, а также непрозрачны?
Электроны, заполняющие межатомное пространство, отражают световые лучи (а не пропускают, как стекло), причем большинство металлов в равной степени рассеивают все лучи видимой части спектра. Поэтому они имеют серебристо-белый или серый цвет. Стронций, золото и медь в большей степени поглощают короткие волны (близкие к фиолетовому цвету) и отражают длинные волны светового спектра, поэтому имеют светло-желтый, желтый и медный цвета.
Хотя на практике металл не всегда нам кажется светлым телом. Во-первых, его поверхность может окисляться и терять блеск. Поэтому самородная медь выглядит зеленоватым камнем. А во-вторых, и чистый металл может не блестеть. Очень тонкие листы серебра и золота имеют совершенно неожиданный вид — они имеют голубовато-зеленый цвет. А мелкие порошки металлов кажутся темно-серыми, даже черными.
Наибольшую отражательную способность имеют серебро, алюминий, палладий. Их используют при изготовлении зеркал, в том числе и в прожекторах.
Почему металлы имеют высокую электрическую проводимость и теплопроводны?
Хаотически движущиеся электроны в металле под воздействием приложенного электрического напряжения приобретают направленное движение, т. е. проводят электрический ток. При повышении температуры металла возрастают амплитуды колебаний находящихся в узлах кристаллической решетки атомов и ионов. Это затрудняет перемещение электронов, электрическая проводимость металла падает. При низких температурах колебательное движение, наоборот, сильно уменьшается и электрическая проводимость металлов резко возрастает. Вблизи абсолютного нуля сопротивление у металлов практически отсутствует, у большинства металлов появляется сверхпроводимость.
Следует отметить, что неметаллы, обладающие электрической проводимостью (например, графит), при низких температурах, наоборот, не проводят электрический ток из-за отсутствия свободных электронов. И только с повышением температуры и разрушением некоторых ковалентных связей их электрическая проводимость начинает возрастать.
Наибольшую электрическую проводимость имеют серебро, медь, а также золото, алюминий, наименьшую — марганец, свинец, ртуть.
Чаще всего с той же закономерностью, как и электрическая проводимость, изменяется теплопроводность металлов.
Она обусловлена большой подвижностью свободных электронов, которые, сталкиваясь с колеблющимися ионами и атомами, обмениваются с ними энергией. Происходит выравнивание температуры по всему куску металла.
Механическая прочность, плотность, температура плавления у металлов очень сильно отличаются. Причем с увеличением числа электронов, связывающих ион-атомы, и уменьшением межатомного расстояния в кристаллах показатели этих свойств возрастают.
Так, щелочные металлы ($Li, K, Na, Rb, Cs$), атомы которых имеют один валентный электрон, мягкие, с небольшой плотностью (литий — самый легкий металл с $ρ=0,53 г/см^3$) и плавятся при невысоких температурах (например, температура плавления цезия $29°С$). Единственный металл, жидкий при обычных условиях, — ртуть — имеет температуру плавления, равную $–38,9°С$.
Кальций, имеющий два электрона на внешнем энергетическом уровне атомов, гораздо более тверд и плавится при более высокой температуре ($842°С$).
Еще более прочной является кристаллическая решетка, образованная ионами скандия, который имеет три валентных электрона.
Но самые прочные кристаллические решетки, большие плотности и температуры плавления наблюдаются у металлов побочных подгрупп V, VI, VII, VIII групп. Это объясняется тем, что для металлов побочных подгрупп, имеющих неспаренные валентные электроны на d-подуровне, характерно образование очень прочных ковалентных связей между атомами, помимо металлической, осуществляемой электронами внешнего слоя с $s$-орбиталей.
Вспомните, что самый тяжелый металл — это осмий $Os$ с $ρ=22,5 г/см^3$ (компонент сверхтвердых и износостойких сплавов), самый тугоплавкий металл — это вольфрам $W$ с $t_<пл.>=3420°С$ (применяется для изготовления нитей накаливания ламп), самый твердый металл — это хром $Cr$ (царапает стекло). Они входят в состав материалов, из которых изготавливают металлорежущий инструмент, тормозные колодки тяжелых машин и др.
Металлы по-разному взаимодействуют с магнитным полем. Такие металлы, как железо, кобальт, никель и гадолиний выделяются своей способностью сильно намагничиваться. Их называют ферромагнетиками. Большинство металлов (щелочные и щелочноземельные металлы и значительная часть переходных металлов) слабо намагничиваются и не сохраняют это состояние вне магнитного поля — это парамагнетики. Металлы, выталкиваемые магнитным полем, — диамагнетики (медь, серебро, золото, висмут).
Напомним, что при рассмотрении электронного строения металлов мы разделили металлы на металлы главных подгрупп ($s-$ и $р-$элементы) и металлы побочных подгрупп (переходные $d-$ и $f-$элементы).
В технике принято классифицировать металлы по различным физическим свойствам:
Простые вещества
Содержание:
Простые веществаа — химические вещества, состоящие исключительно из атомов одного химического элемента, в отличие от сложных веществ. Являются формой существования химических элементов в свободном виде; или, иначе говоря, химические элементы, не связанные химически ни с каким другим элементом, образуют простые вещества. Известно свыше 400 разновидностей простых веществ.
Химические вещества, состоящие исключительно из атомов одного химического элемента, в отличие от сложных веществ. Являются формой существования химических элементов в свободном виде; или, иначе говоря, химические элементы, не связанные химически ни с каким другим элементом, образуют простые вещества. Известно свыше 400 разновидностей простых веществ.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Простые вещества
Прежде чем приступить к рассмотрению свойств простых веществ, необходимо вспомнить некоторые закономерности, характеризующие способность свободных атомов к перестройке электронной конфигурации. Так, у свободных атомов элементов III периода наблюдаются следующие тенденции:
Результатом реализации отмеченных тенденций, присущих свободным атомам, является образование соответствующих связей в простых веществах. Как известно, в периодах наблюдается постепенный переход от активных металлов (щелочные металлы) к типичным неметаллам (галогены).
При рассмотрении тех же тенденций у свободных атомов в группах периодической системы наблюдаем следующие изменения:
С указанными характеристиками свободных атомов можно связать усиление металлических свойств и ослабление неметаллических с ростом зарядов ядер у элементов одной и той же группы.
Металлы и неметаллы. Относительность деления простых веществ на металлы и неметаллы
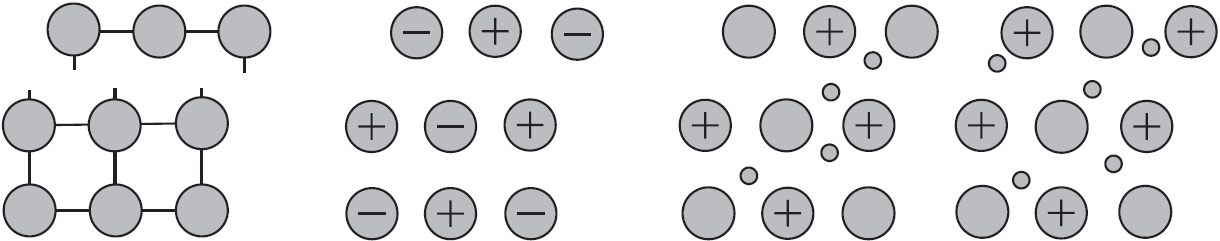
Простые вещества, характеризующиеся атомным (ионным) строением и наличием свободных электронов, являются металлами. Эти вещества обладают металлическим блеском, электро- и теплопроводностью. По химическим свойствам металлы являются типичными восстановителями (т. е. легко отдают валентные электроны).
Все простые вещества, образованные атомами элементов дополнительных подгрупп, являются металлами.
Типичными неметаллами являются такие простые вещества^ которые, как правило, состоят из молекул с атомной и ковалентной связью. Не имея свободных электронов, неметаллы по физическим свойствам характеризуются отсутствием электронной проводимости, металлического блеска и т. п. По химическим свойствам многие из них являются энергичными окислителями, так как их атомы обладают сильной склонностью к присоединению электронов.
Рассмотрим фрагмент периодической системы, составленный из элементов главных подгрупп:
Как видно из этой схемы, типичные неметаллы располагаются в правом верхнем углу системы, а металлы — в ее левом нижнем углу.
Валентность перехода, или относительность деления на металлы и неметаллы, выражается в наличии ряда простых веществ, являющихся как бы полуметаллами. При обычных условиях простые вещества, образованные этими элементами, имеют незначительную электропроводность . Поэтому их нельзя отнести ни к неметаллам, ни к металлам. Иногда их называют металлоидами (т. е. неполными металлам). Атомы этих элементов в простом веществе соединяются ковалентными связями. При этом нередко образуются прямые кристаллические структуры, подобные структуре алмаза, в которых каждый атом связан с несколькими другими.
Следовательно, одна из причин относительности деления простых веществ на металлы и неметаллы тесно связана со знанием атомов элементов.
Другая причина относительности такого деления заключается в состоянии внешних условий. Так, при обычных условиях металлы, как известно, характеризуются наличием свободных электронов. Металлическая связь осуществляется и в твёрдом и в жидком состоянии. Но если перевести в пар при определённых условиях (высокие температуры и низкие давления), то он теряет свое характерное свойство — электропроводность. У неметаллов в условии высокого давления наоборот возникает электронная проводимость, что является результатом глубоких изменений в структуре вещества.
Таким образом, структура вещества, тип химической связи, простого вещества могут изменяться под воздействием соответствующих внешних условий. Хорошо известным примером такого рода изменений являются различия физических свойств у различных аллотропных модификаций одного и того же элемента.
Аллотропия
Способность одного и того же элемента существовать в виде нескольких простых веществ называется аллотропией. В настоящее время известно около 400 простых веществ. Причина образования различных аллотропных видоизменений одного элемента кроется в возможности образования новых связей между атомами при изменении внешних условий. В результате образуются молекулы нового состава или новые кристаллические вещества, отличающиеся пространственным расположением атомов.
Так, например, существуют обыкновенный кислород и озон, отличающиеся друг от друга числом атомов в молекуле: кислород О2, и озон О3. Озон образуется при прохождении через воздух электрических разрядов.
Для серы известны два аллотропных видоизменения: ромбическая и призматическая сера. Выше температуры 95,6° С существует призматическая сера, ниже — ромбическая. Изменяется кристаллическая форма (ясно из названия) — изменяются и физические свойства.
Для олова переход одной модификации (серое олово) в другую (белое олово) совершается при температуре 18° С. Здесь также происходит изменение типа кристаллической решетки.
Наличие нескольких аллотропных видоизменений характерно для всех элементов четвертой группы. Рассмотрим, как влияет изменение структуры на физические свойства простых веществ элементов этой группы. Как известно, углерод и кремний принято относить к неметаллам, германий — к полупроводникам, олово и свинец — к металлам. Однако такое деление условно. В этом можно убедиться, рассмотрев, например, аллотропные видоизменения углерода.
В алмазе каждый атом углерода находится в центре правильной треугольной пирамиды (тетраэдр) и соединен ковалентными связями с четырьмя соседними атомами углерода (рис. 6). Таким образом, в таком кристаллическом веществе нет отдельных молекул (это понятие здесь теряет свой смысл). Связи между атомами углерода весьма прочны. Этим объясняется исключительно высокая твердость алмаза, высокая температура плавления и кипения.
В структуре графита плоские слои из атомов углерода расположены шестиугольниками. При этом расстояние между слоями больше расстояния между соседними атомами углерода, находящимися в одном слое (рис. 7). Для образования связей в шестиугольниках от каждого атома углерода требуется три электрона, четвертый же остается «свободным». Этим объясняется электропроводность графита. Поэтому графит используется для изготовления электродов.
Точно так же отличаются физическими свойствами кристаллические модификации олова: белое олово обладает электронной проводимостью, серое является полупроводником.
Выше мы отмечали, что переход одного аллотропного видоизменения в другое происходит при соответствующих условиях. Однако дело в том, что скорость указанного превращения, как правило, незначительна, различные простые вещества одного элемента могут сосуществовать.
рис. 6. Структура алмаза
Если различия между физическими свойствами аллотропных модификаций одного элемента нередко велико, то по химическим свойствам они чаще всего близки. Отличия касаются, главным образом, окислителей (озон — более активный окислитель), скорости реакции с участием простого вещества.
Понятие об окислительно-восстановительных процессах
При первоначальном знакомстве с химией рассматриваются четыре вида химических реакций: реакции соединения, разложения, замещения и двойного обмена.
Цифры над символами элементов означают окислительное число. Мы видим, что одни реакции (1, 3, 5, 6) идут с изменением окислительного числа элементов, другие (2, 4, 7) — без его изменения. На этой основе все химические реакции условно делят на два типа: реакции, идущие с изменением окислительного числа элементов — окислительно-восстановительные реакции — и реакции, течение которых не сопровождается изменением окислительного числа. Первые реакции играют огромную роль в жизни человека, в окружающем нас мире. Окислительно-восстановительные процессы имеют место при горении, дыхании, при получении серной кислоты из серы или сульфидов металлов, при выплавке металлов из руд, при коррозии металлов и сплавов, при работе химических источников электрической энергии.
Что же лежит в основе перечисленных выше процессов? Почему одни простые вещества легко вступают в реакцию друг с другом, тогда как другие нет.
В основе рассматриваемых процессов лежит такая перестройка электронной структуры атомов, составляющих соединение, которая ведет к изменению окислительного числа элементов. Таким образом, в этом случае, как правило, имеет место переход электронов от одних атомов, ионов, молекул к другим. Правда, иногда изменение окислительного числа сопровождается не передачей электронов от одного атома (иона) к другому, а смещением электронных пар:
(вертикальной линией условно обозначена середина межатомного расстояния в рассматриваемых молекулах).
В первом случае из двух простых веществ образуется ионное соединение, во втором — ковалентное полярное. Окислительное число элементов в простых веществах принимается равным нулю.
Окислительное число хлора и в поваренной соли, и в хлористом водороде равно -1, хотя указанные соединения различаются типом химической связи (что и представлено на схеме).
Окислителями называются вещества (атомы, ионы, молекулы), которые в ходе химической реакции присоединяют электроны или оттягивают их от других атомов. В только что рассмотренных примерах в качестве окислителя выступал хлор (С12). В результате реакции окислительное число хлора понизилось.
Восстановителями называются вещества (атомы, ионы, молекулы), вторые в ходе химической реакции отдают электроны для образования ионной или ковалентной связи. В тех же примерах в качестве восстановителей выступали соответственно натрий и водород. В результате реакции окислительное число восстановителей повысилось.
Принципиальная возможность электронной перестройки, наличие потенциального окислителя или восстановителя определяются строением атомов, строением вещества в целом.
Реализация этой возможности в общем случае находится в зависимости от многих факторов: наличия соответствующего партнера, концентрации окислителя и восстановителя, температуры, среды, в котоорой осуществляется реакция, и т. п.
Рассмотрим это на примере реакции взаимодействия двух простых веществ натрия и хлора:
2Na + С12 = 2NaCI
Как известно, для атомов натрия характерно «стремление» к отдаче электрона, для атомов хлора — к присоединению. Следовательно, в данном случае имеет место взаимодействие активного окислителя и активного восстановителя. Реакция осуществляется довольно легко: попаренная соль образуется с большим выделением тепла, в чём легко убедиться на практике. Процессы взаимодействия многих металлов с хлором идут самопроизвольно или при незначительном нагревании (для увеличения скорости реакции). Образовавшиеся при реакции ионы натрия (Na + ) и хлора (СI — ) обладают завершёнными электронными конфигурациями и поэтому, представляет себе возможность течения обратной реакции, мы понимаем, что Na + будет очень плохим окислителем, а СI — — плохим восстановителем. Для осуществления такой реакции потребуется значительная затрата энергии (высокие температуры). При обычных условиях натрий и хлор из поваренной соли получают электролизом расплава поваренной соли.
Ранее, рассматривая вопрос о положении водорода в периодической системы, мы указывали на сходство водорода как со щелочными металлами, так и с галогенами. Это сходство проявляется, в частности в том, что подобно щелочным металлам, водород может выступать в качестве восстановителя, но с другой стороны, подобно галогенам, способен быть и окислителем. Причина двух способов изменения электронной конфигурации нейтрального атома водорода заключается в особенности строения атомов I периода (первый энергетический уровень заполняется двумя электронами). Изменение
окислительного числа водорода можно представить следующим образом:
В первом случае водород выступает как восстановитель, во втором — как окислитель. Например:
Таким образом, мы прежде всего должны учитывать принципиальные возможности присоединять или отдавать электроны, т. е. возможности, прямо вытекающие из строения атомов и окислительного числа элемента в соединении. В нашем примере водород (Н2) может выступать и в роли окислителя и в роли восстановителя. Какая из этих двух возможностей будет реализована, зависит от партнера по реакции, от того, с каким веществом (окислителем или восстановителем) будет взаимодействовать водород.
Как же связать окислительные и восстановительные свойства простых веществ с положением элементов в периодической системе? Рассмотрим конкретные примеры. Например, окислительная способность в ряду галогенов убывает от хлора к йоду:
Восстановительную способность металлов отражает ряд активности (напряжения) металлов который составлен с учетом последовательности вытеснения металлов из растворов их солей.
По-иному будет выглядеть ряд, иллюстрирующий способность металлов образовывать соединения с кислородом или азотом, водородом или фтором и т. д.
В группах периодической системы восстановительные свойства простых веществ, как правило, усиливаются, а окислительные — падают. Однако это общее положение нуждается в уточнении, когда мы приступаем к изучению некоторых конкретных примеров. Число реакций, в которых данный элемент может выступать, скажем, в качестве восстановителя, достаточно велико, а процесс окисления— восстановления зависит от многих факторов, которые мы пока еще не рассматривали.
Услуги по химии:
Лекции по химии:
Лекции по неорганической химии:
Лекции по органической химии:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
http://examer.ru/oge_po_himii/teoriya/himicheskie_svojstva_prostyh_veshhestv
http://natalibrilenova.ru/prostyie-veschestva/