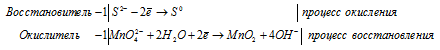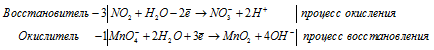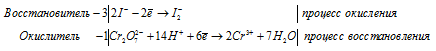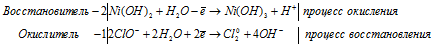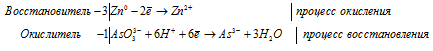Процесс obp представлен уравнением k2cr2o7
2019-07-04 
Два юных химика исследовали взаимодействие раствора сульфида калия с раствором бихромата калия. Один из них пришел к выводу, что при реакции образуется осадок, нерастворимый в разбавленной серной кислоте, но растворяющийся при нагревании в концентрированной азотной кислоте. Второй считал, что осадок частично растворим в разбавленной серной кислоте. Как можно объяснить разные результаты, если известно, что все наблюдения правильны?
Достаточно правильно составить окислительно-восстановительное уравнение, чтобы все стало ясно:
$K_2Cr_2O_7 + 3K_2S + 7H_2O = 2Cr(OH)_3 \downarrow + 3S \downarrow + 8KOH$.
При избытке сульфида калия, который и сам по себе имеет щелочную реакцию, образующийся гидроксид хрома тут же растворится в другом продукте:
$Cr(OH)_3+ 3KOH = K_3 [Cr(OH)_6]$,
$K_2Cr_2O_7 + 3K_2S + 7H_2O = 2K_3[Cr(OH)_6] + 3S \downarrow + 2KOH$.
В осадке будет только сера, растворяющаяся в концентрированной азотной кислоте:
$S + 6HNO_3 \rightleftharpoons 6NO_2 \uparrow + H_2SO_4 + 2H_2O$.
Раствор бихромата калия имеет кислую реакцию вследствие равновесия:
$Cr_2O_7^ <2->+ 3H_2O \rightleftharpoons 2CrO_4^ <2->+ 2H_3O^<+>$.
Поэтому при избытке бихромата калия первое уравнение будет выглядеть по-другому:
$5K_2Cr_2O_7 + 3K_2S + 3H_2O = 2Cr(OH)_3 \downarrow + 3S \downarrow + 8K_2CrO_4$.
Гидроксид хрома в этом случае выпадет в осадок вместе с серой и легко растворится затем в разбавленной серной кислоте:
$2Cr(OH)_3 + 3H_2SO_4 = Cr_2 (SO_4)_3 + 6H_2O$.
Следовательно, первый юный химик прилил бихромат к избытку сульфида, второй — поступил наоборот.
«Окислительно-восстановительные реакции в органической химии с участием KМnO4 и K2Cr2O7
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Описание презентации по отдельным слайдам:
Окислительно-восстановительные реакции
в органической химии с участием KMnO4 и K2Cr2O7
(подготовка к ЕГЭ)
Составитель: Петрова А.П.,
учитель химии
МБОУ «Вилюйская сош №1 имени Г.И.Чиряева»
Республика Саха (Якутия)
Окислительно-восстановительные реакции органических веществ – важнейшее свойство, объединяющее эти вещества. Склонность органических соединений к окислению связывают с наличием кратных связей, функциональных групп, атомов водорода при атоме углерода, содержащем функциональную группу.
Окисление углеводородов с кратной связью обычно проводится в присутствии окислителя – перманганата калия KMnO4 в различных средах (кислой, щелочной или нейтральной). В зависимости от реакции среды и условий проведения реакции можно получать различные продукты окисления углеводородов и восстановления соединений марганца– в кислой среде Mn2+, в нейтральной и щелочной – K2MnO4, MnO2.
KMnO4 и другие неорганические окислители, такие как HNO3, K2Cr2O7, CuO и др. относятся к условным окислителям и в органических уравнениях обозначаются как [O].
Рассмотрим особенности окисления алкенов, алкинов и аренов.
-1 -2 +7 +3 +4 +2
СН3СН=СН2+КМnO4+Н2SO4→ СН3СOOН+СO2+ МnSO4+К2SO4+H2O
-1 +3
C – 4e → C
-2 +4 10e 5
C – 6e → C
+7 +2
Mn + 5e → Mn 10
5СН3СН=СН2+10КМnO4+15Н2SO4→ 5СН3СOOН+5СO2+ 10МnSO4+5К2SO4+20H2O
-1 -1 +7 +3 +3 +2
СН3СН=СНСН2СН3+КМnO4+Н2SO4→СН3СOOН+С2Н5СOOН+МnSO4+К2SO4+H2O
-1 +3
2С — 8е → 2С 5
+7 +2
Mn + 5e → Mn 8
КМnO4 — окислитель
В более жестких условиях окисление приводит к разрыву углеродной цепи по двойной связи и образованию двух кислот или кислоты и оксида углерода (IV) СО2.
В щелочной среде окисление приводит к разрыву углеродной цепи по двойной связи и образованию двух солей.
Пример 1.
-1 -1 +7 +3 +3 +6
СН3СН=СНСН2СН3+КМnO4+KOH→СН3СOOK+С2Н5СOOK+ H2O +К2МnO4
-1 +3
С — 8е → С 1
+7 +6
Mn + 1e → Mn 8
СН3СН=СНСН2СН3+8КМnO4+10KOH→СН3СOOK+С2Н5СOOK+ 6H2O +8К2МnO4
Пример 2.
-1 -2 +7 +3 +4 +6
СН3СН=СН2+КМnO4+KOH→СН3СOOK+ К2CO3+ H2O+ К2МnO4
-1 +3
C — 4e → C
-2 +4 10e 1
C — 6e → C
+7 +6
Mn + 1e → Mn 10
СН3СН=СН2+10КМnO4+13KOH→СН3СOOK+ К2CO3+ 8H2O+ 10К2МnO4
При мягком окислении алкены превращаются в гликоли (двухатомные спирты).
Атомы-восстановители в этих случаях-атомы углерода, связанные двойной связью.
Реакция с раствором перманганата калия протекает в нейтральной или слабо щелочной среде.
3СН2=СН2+2КМnO4+4H2O→ 3CH2OH-CH2OH+2MnO2+2KOH
При окислении алкенов, в которых атомы углерода при двойной связи содержат по два углеродных радикала, происходит образование кетонов:
(СН3)2С=СНСН3+6КМnO4+9Н2SO4→5СН3СOOН+СН3СОСН3+6МnSO4+3К2SO4+9H2O
Алкины окисляются в несколько более жестких условиях, чем алкены, поэтому они обычно окисляются с разрывом углеродной цепи по тройной связи.
5СН3СН≡СН+8КМnO4+12Н2SO4→5СН3СOOН+5СО2+8МnSO4+
4К2SO4+12H2O
В кислотной среде окисление идет до щавелевой кислоты или углекислого газа:
5СН≡СН+8КМnO4+12Н2SO4→5НООССOOН+8МnSO4+4К2SO4+
12H2O
Окисление гомологов бензола
Бензол не окисляется даже в довольно жестких условиях. Гомологи бензола могут быть окислены раствором КМnO4 в нейтральной среде до бензоата калия:
С6Н5СН3+2КМnO4→С6Н5СООК+2МnO2+2КОН+H2O
Окисление гомологов бензола дихроматом калия и перманганатом калия в кислой среде приводит к образованию бензойной кислоты:
5С6Н5СН3+6КМnO4+9Н2SO4→5С6Н5СООН+6МnSO4+3К2SO4+
14H2O
Непосредственным продуктом окисления первичных спиртов являются альдегиды, а вторичных-кетоны.
Третичные спирты в этих условиях не окисляются, метанол окисляется до углекислого газа
СН3ОН+ 2КМnO4 →К2CO3+ 2H2O+2МnO2
Двухатомный спирт этиленгликоль НОСН2-СН2ОН, при нагревании в кислой среде с раствором КМnO4 или К2Сr2О7 легко окисляется до щавелевой кислоты, а в нейтральной –
5НОСН2СН2ОН+8КМnO4+12Н2SO4→5НООССООН+8МnSO4+4К2SO4+
22H2O
Окисление альдегидов и кетонов
Альдегиды-довольно сильные восстановители, поэтому легко окисляются различными окислителя КМnO4, К2Сr2О7, Cu(OH)2, [Ag(NH3)2]OH/ Все реакции идут при нагревании
3СН3-СНО+ 2КМnO4→ СН3СOOН+ СН3СOOK+2МnO2+H2O
3СН3СНО+К2Сr2О7+4Н2SO4→3СН3СООН+Сr2(SO4)3+К2SO4+4H2O
СН3-СНО+2КМnO4+КОН→ СН3СOOК+2К2МnO4+2H2O
5СН3СНО+2КМnO4+3Н2SO4→5СН3СООН+2МnSO4+К2SO4+3H2O
СН3-СНО+Br2+3NaOH→ СН3-СООNa+2NaBr+ 2H2O
СН3-СНО+2[Ag(NH3)2]OH→ СН3-СООNH4+2Ag+3NH3+ H2O
СН3-СНО+ Cu(OH)2→ СН3-СООН+ Cu2O+ 2H2O
Муравьиный альдегид (формальдегид) окисляется до углекислого газа:
5НСНО+4КМnO4(избыток)+6Н2SO4→5СО2+4МnSO4+2К2SO4+11H2O
НСНО+4[Ag(NH3)2]OH→ (NH4)2СО3+4Ag+6NH3+ 2H2O
НСНО+ 4Cu(OH)2→ СО2+ 2Cu2O+ 5H2O
Кетоны окисляются в жестких условиях сильными окислителями с разрывом связей С-С и дают смеси кислот.
(СН3)2-СН-СН2-СО-СН2-СН3+О→(СН3)2-СН-СООН+ НООС-СН2-СН3
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 932 человека из 80 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Курс добавлен 23.11.2021
- Сейчас обучается 40 человек из 25 регионов
Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 26 человек из 16 регионов
Ищем педагогов в команду «Инфоурок»
Дистанционные курсы для педагогов
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 573 289 материалов в базе
Материал подходит для УМК
«Химия (базовый уровень)», Рудзитис Г.Е.,Фельдман Ф.Г.
§ 12. Классификация химических реакций
Другие материалы
- 06.04.2021
- 94
- 2
- 06.04.2021
- 77
- 1
- 06.04.2021
- 98
- 0
- 06.04.2021
- 376
- 12
- 06.04.2021
- 77
- 0
- 06.04.2021
- 226
- 4
- 06.04.2021
- 234
- 25
- 06.04.2021
- 157
- 3
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 07.04.2021 583
- PPTX 81.7 кбайт
- 2 скачивания
- Оцените материал:
Настоящий материал опубликован пользователем Петрова Анна Прокопьевна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 5 лет и 4 месяца
- Подписчики: 0
- Всего просмотров: 20605
- Всего материалов: 16
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Тринадцатилетняя школьница из Индии разработала приложение против буллинга
Время чтения: 1 минута
В Забайкалье в 2022 году обеспечат интернетом 83 школы
Время чтения: 1 минута
Полный перевод школ на дистанционное обучение не планируется
Время чтения: 1 минута
В Ленобласти школьники 5-11-х классов вернутся к очному обучению с 21 февраля
Время чтения: 1 минута
Онлайн-конференция о создании школьных служб примирения
Время чтения: 3 минуты
Инфоурок стал резидентом Сколково
Время чтения: 2 минуты
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Составление уравнений в ионно-молекулярной форме
S 2 — + MnO4 2- + 2H2O = MnO2 + S 0 + 4OH —
После приведения членов обеих частей уравнения, получим:
Уравнение в ионно-молекулярной форме:
4K + + S 2- + MnO4 2- + 2H2O = S + MnO2 + 4K + + 4OH — .
После приведения членов обеих частей уравнения, получим:
Уравнение в ионно-молекулярной форме:
После приведения членов обеих частей уравнения, получим:
Для уравнивания добавим в уравнение 1 моль K2SO4, получим:
Уравнение в ионно-молекулярной форме:
После приведения членов обеих частей уравнения, получим:
Уравнение в ионно-молекулярной форме:
3Zn 0 + AsO3 3- + 6H + = 3Zn 2+ + As 3- + 3H2O.
После приведения членов обеих частей уравнения, получим:
http://infourok.ru/okislitelno-vosstanovitelnye-reakcii-v-organicheskoj-himii-s-uchastiem-kmno4-i-k2cr2o7-5138003.html
http://buzani.ru/zadachi/khimiya-glinka/1213-uravneniya-v-ionno-molekulyarnoj-forme-zadachi-631-632