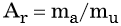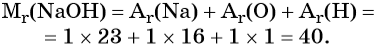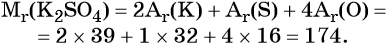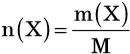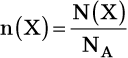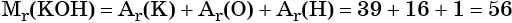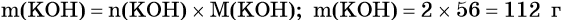Проведение расчетов на основе формул и уравнений реакций
Абсолютной атомной массой mа называют истинную массу атома элемента. Так как абсолютные атомные массы имеют очень малые значения (например, 1,993 × 10 –26 кг для изотопа 12 С), то для проведения физических и химических расчётов используют понятия атомной единицы массы. Атомной единицей массы (а. е. м., mu), или углеродной единицей, называют 1/12 часть массы атома изотопа углерода с массовым числом 12. Численное значение 1 а. е. м. = 1,667 · 10 –27 кг.
Относительной атомной массой Аr называют массу атома, выраженную в атомных единицах массы:
Относительные атомные массы химических элементов приведены в периодической системе химических элементов возле символа соответствующего элемента. Следует отметить, что эти значения представляют собой среднюю величину из атомных масс всех природных изотопов этого элемента с учетом их относительного содержания в природе. При решении расчётных химических задач на школьном уровне обычно используют величины атомных масс, округлённые до целочисленных. Исключение составляет хлор, для которого обычно берут величину 35,5.
Относительной молярной массой Mr называют массу молекулы, выраженную в атомных единицах массы.
Относительная молярная масса простых и сложных веществ равна сумме относительных атомных масс атомов, входящих в состав молекулы. Например, относительная атомная масса кислорода О равна 16, молекулы кислорода O2 − 2 × 16 = 32, молекулы озона O3 − 3 × 16 = 48.
Относительная молярная масса гидроксида натрия NaOH равна:
Относительная молярная масса сульфата калия K2SO4 равна:
Количество вещества — физическое понятие, показывающее число структурных единиц (атомов, молекул, ионов и т. д.), образующих это вещество. Количество вещества обозначают греческой буквой ν или латинской буквой n. Единицей измерения количества вещества является моль, это одна из основных единиц системы СИ.
Моль — количество вещества, содержащее столько же структурных единиц, сколько содержится атомов в 0,012 кг изотопа углерода с массовым числом 12.
Молярной массой называют величину, равную отношению массы вещества к количеству вещества. Численно молярная масса всегда совпадает с массой молекулы, выраженной в атомных единицах массы. Единица измерения молярной массы г/моль.
Число структурных элементов (атомов, молекул, ионов и т. д.) в одном моле вещества называют числом или постоянной Авогадро, это число равно 6,02 × 10 23 моль –1 . Значение числа Авогадро необходимо запомнить.
Масса, молярная масса и количество вещества некоего вещества Х связаны между собой формулой:
где m(X) — масса вещества Х; M(X) — его молярная масса.
Количество вещества также можно определить по формуле:
где N(X) — число частиц вещества Х; NA — число Авогадро.
Пример 1. Определить массу гидроксида калия количеством вещества 2 моль.
Следовательно, молярная масса М(KOH) равна 56 г/моль.
Пример 2. Сколько молекул содержится в азотной кислоте массой 189 г?
Различные методы решения расчетных задач
план-конспект урока по химии (9 класс) по теме
Конспекти методический материал к уроку по химии для учащихся 9 класс.
Скачать:
| Вложение | Размер |
|---|---|
| otkrytyy_urok_po_himii_9_klass.docx | 46.67 КБ |
| otkrytyy_urok.doc | 274.5 КБ |
| otkrytyy_urok.ppt | 537 КБ |
Предварительный просмотр:
Открытый урок по химии для 9 класса
Тема: Проведение расчетов на основе формул и уравнений реакций.
Цель урока:Цель: Обобщить и систематизировать знания учащихся в области решения задач по заданиям ГИА. Закрепить умения и навыки по решению задач, с использованием понятия массовая доля и уравнениям реакций.
1. Вычисления массовой доли химического элемента в веществе.
2. Вычисления массовой доли растворенного вещества в растворе.
3. Вычисления с помощью уравнений реакций.
Оборудование: Плоскодонная колба, стеклянная палочка, вода, хлорид меди, презентация.
Создать ситуацию успеха, поздороваться.
Учащиеся приветствуют учителя.
Актуализация опорных знаний
Тема сегодняшнего урока
Проведение расчетов на основе формул и химических
реакций. Умение проводить химические расчеты просто необходимо и инженеру технологу, и химику-исследователю. Это умение пригодиться и вам, вне зависимости от того, какую профессию вы собираетесь избрать. Дело в том, что решение химических задач-отличная тренировка мышления, прекрасно развивает память, внимание, терпение ,умение мыслить логически, приучает к аккуратности и собранности. Вот поэтому при изучении химии большое внимание
уделяется задачам, среди которых, подавляющее большинство-расчеты по химическим уравнениям.
Сообщение плана урока.
Знакомлю с листом учащегося.
Учащиеся записывают тему урока в тетрадь.
- Признаками химической реакции являются?
Выпадение осадка, выделение газа, образование воды.
- Единица измерения количества вещества?
- Чему равен молярный объем?
- Степень окисления серы в серной кислоте равна?
- Какие соединения называются оксидами?
Это сложные вещества, состоящие из 2-х химических элементов одним из которых является кислород.
- Самый сильный окислитель?
- Как найти массовую долю растворенного вещества.
- Аллотропная модификация кислорода
Проверка знаний химических формул.
Головоломка « Уравнения связи»
В головоломке спрятались 8 химических формул, найдите их, за 3 минуты.
Расчёт массовой доли химического элемента.
Учащимся предлагается выполнить задания по вариантам
Учащиеся самостоятельно находят химические формулы.
№ 1 Массовая доля кислорода в силикате магния (MgSiO3 )равна
1) 16% 2) 24% 3) 36% 4) 48%
№ 2 Массовая доля азота в нитрате алюминия(AI(NO 3 ) 3 равна
1) 14% 2) 19,7% 3) 6,6% 4) 21,3%
№ 3Массовая доля кислорода в нитрате алюминия (AI(NO3)3 равна
1) 7,5% 2) 22,5% 3) 42,4% 4) 67,6%
№ 4 Массовая доля кислорода в нитрате железа (III) Fe(NO3)3 равна
1) 59,5% 2) 6,6% 3) 16% 4) 56,1%
№ 5 Массовая доля азота в нитрате железа (III) Fe(NO3)3 равна
1) 5,8% 2) 17,4% 3) 28% 4) 59,5%
Демонстрация опыта по расчету концентрации раствора
5 г хлорида меди
Добавила еще 3г хлорида меди
Приливаю еще 20 г воды, как измениться концентрация раствора.
Приступаем к решению задач на растворы.
Задания по вариантам, ответ заносят в таблицу, время 2 мин.
К доске вызываю 3 учащихся, и решаем задачи по карточкам.
Мысленно поверни и допиши уравнения химических реакций.
1Смешали 120 г раствора серной кислоты с массовой долей 20% и 80г 30%-ного раствора того же вещества. Массовая доля кислоты в полученном растворе равна_______%
2.К 150 г раствора хлорида натрия с массовой долей 10% добавили 20г этой же соли. Массовая доля хлорида натрия в образовавшемся растворе стала равна
3.К 120г раствора хлорида бария с массовой долей 15% добавили 60 г воды.
Массовая доля хлорида бария в образовавшемся растворе стала равна________%
Учащиеся записывают химические реакции в тетрадь.
Почти в каждой задаче по химии требуется составить уравнение реакций и рассчитать массы или объемы участвующих в ней веществ. Но любые расчеты теряют смысл, если уравнение реакций составлено неверно, поэтому залог успеха в решении задачи понимание физической и химической сущности рассматриваемых процессов.
Составляем уравнение реакции
Определяем молярные массы
(для газов- молярные объемы) и записываем их,
3. Находим число молей вещества, массу или объем которого известны,
4. Определяем по уравнению реакции, в каких мольных соотношениях находятся взятые для расчета вещества,
5. Рассчитываем массу или объем искомого вещества
6. Формулируем ответ
Вычислите объем водорода, выделившегося при
взаимодействии цинка массой 13 г, с разбавленной серной кислотой.
n(Zn)=13г : 65 г/моль=0,2 моль
Учащиеся решают задачи на избыток и недостаток.
Избыток или недостаток?
Приступая к решению задачи, надо обратить внимание на наличие «лишних» данных в ее условии: они указывают на то, что одно из реагирующих веществ, взято в избытке.
если это имеет место, надо провести расчет по уравнению реакции и обнаружить это вещество,
решать задачу, используя в расчетах тот
реагент, который израсходуется полностью.
задачи повышенной трудности
1. Какая масса меди может быть вытеснена избытком цинка из раствора сульфата меди (II) массой 320 г и массовой долей соли 5%
2. К раствору хлорида бария (масса раствора 125 г, массовая доля соли 10%)
Прибавили раствор серной кислоты ( масса 196 г, массовая доля кислоты 10%). Рассчитайте массу осадка, выделившегося в результате реакции.
Хлор без остатка прореагировал с 228,58 мл 5%-ного раствора
Гидроксида натрия(плотность 1,05 г/мл) при повышенной температуре. Определите состав полученного раствора и рассчитайте массовые доли веществ в этом растворе.
1.Какой объем водорода выделится (н.у.) при взаимодействии избытка магния и раствора соляной кислоты массой 146 г и массовой долей кислоты 10%
2. Слили вместе по 10 мл растворов гидроксида натрия и азотной кислоты с массовой долей растворенных веществ по 10% в каждом. Плотность раствора щелочи составляет 1,11 г/мл, плотность раствора кислоты -1,05г/мл. Какую окраску будет иметь индикатор лакмус в получившейся смеси?
№ 3 Массовая доля азота в нитрате алюминия(AI(NO3)3 равна
1) 14% 2) 19,7% 3) 6,6% 4) 21,3%
Химическая головоломка «Уравнения связи»
Химическая головоломка «Уравнения связи»
1. Массовая доля кислорода в нитрате алюминия (AI(NO 3 ) 3 равна
1) 7,5% 2) 22,5% 3) 42,4% 4) 67,6%
2. Какая масса серебра может быть вытеснена медью из раствора нитрата серебра массой 340 г и массовой долей соли 2%
3. К раствору хлорида бария (масса раствора 125 г, массовая доля соли 10%)Прибавили раствор серной кислоты ( масса 196 г, массовая доля кислоты 10%). Рассчитайте массу осадка, выделившегося в результате реакции.
4. Какой объем водорода (н.у.) выделиться при взаимодействии избытка цинка с раствором серной кислоты массой 196 г и массовой долей кислоты 2%
5. Слили вместе по 10 мл растворов гидроксида натрия и азотной кислоты с массовой долей растворенных веществ по 10% в каждом. Плотность раствора щелочи составляет 1,11 г/мл, плотность раствора кислоты -1,05г/мл. Какую окраску будет иметь индикатор лакмус в получившейся смеси?
Предварительный просмотр:
Петроградский район История (пробный ЕГЭ) 11 класс февраль 2012 года
Данную стратегию уместно использовать для развития у школьников следующих умений:
-анализировать текст совместно с другими людьми;
— вести исследовательскую работу в группе;
— доступно передавать информацию другому человеку;
-самостоятельно определять направление в изучении какого-то предмета с учетом интересов группы.
Стратегия «Зигзаг» используется для изучения и систематизации большого по объему материала.
Для этого предстоит сначала разбить текст на смысловые отрывки для взаимообучения.
Количество отрывков должно совпадать с количеством членов групп. Например, если текст разбит на 5 смысловых отрывков, то в группах (назовем их условно рабочими) — 5 человек.
1. Стадия вызова осуществляется при помощи любых известных вам приемов. В данной стратегии может и не быть фазы вызова как таковой, так как само задание – организация работы с текстом большого объема – само по себе служит вызовом.
2. Смысловая стадия. Класс делится на группы. Группе выдаются тексты различного содержания. Каждый учащийся работает со своим текстом: выделяя главное, либо использует одну из графических форм (например «кластер»). По окончании работы учащиеся переходят в другие группы – группы экспертов.
3. Стадия размышления: работа в группе «экспертов». Новые группы составляются так, чтобы в каждой оказались специалисты по одной теме. В процессе обмена результатами своей работы, составляется общая презентационная схема рассказа по теме. Решается вопрос о том, кто будет проводить итоговую презентацию.
Затем учащиеся пересаживаются в свои первоначальные группы. Вернувшись в свою рабочую группу, эксперт знакомит других членов группы со своей темой, пользуясь общей презентационной схемой. В группе происходит обмен информацией всех участников рабочей группы. Таким образом, в каждой рабочей группе, благодаря работе экспертов, складывается общее представление по изучаемой теме.
Следующим этапом станет презентация сведений по отдельным темам, которую проводит один из экспертов, другие вносят дополнения, отвечают на вопросы. Таким образом, идет «второе слушание» темы.
Итогом урока может стать исследовательское или творческое задание по изученной теме.
Зигзаг 2, автор Славин. Этот прием применяется на текстах меньшего объема. В отличие от первого «Зигзага», текст изучается всеми учениками, принцип деления на группы – вопросы к данному тексту, их количество должно совпадать с количеством участников группы. В экспертные группы собираются специалисты по одному вопросу: для более детального его изучения, обмена мнениями, подготовки подробного ответа на вопрос, обсуждения формы его представления. Вернувшись в рабочие группы, эксперты последовательно представляют варианты ответов на свои вопросы.
Сценарий урока по химии на тему «Проведение расчётов на основе формул и уравнений реакций» (9 класс)
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Авторы разработки: Ларченко Е.С., Жаринкова Г.А.
Тема урока: « Проведение расчетов на основе формул и уравнений реакций»
Тип урока: урок закрепления знаний
— оперировать основными химическими понятиями «атом», «молекула», «химический элемент», «простое вещество», «сложное вещество», «валентность», «химическая реакция», используя знаковую систему химии;
— раскрывать смысл законов сохранения массы веществ, постоянства состава, атомно-молекулярной теории;
— называть химические элементы;
— определять состав веществ по их формулам;
— определять валентность атома элемента в соединениях;
— составлять формулы бинарных соединений;
— составлять уравнения химических реакций;
— вычислять относительную молекулярную и молярную массы веществ;
— вычислять массовую долю химического элемента по формуле соединения;
— вычислять количество, объем или массу вещества по количеству, объему, массе реагентов или продуктов реакции;
— применять закон Авогадро;
— оперировать понятиями «молярный объем», «раствор»;
— вычислять массовую долю растворенного вещества в растворе;
— учить точно и грамотно выражать свои мысли с применением математической терминологии и символики, проводить логические обоснования;
— формировать навыки устных и письменных вычислений;
— познакомить с понятием процента от числа
Формирование умений и навыков:
— работать с информацией (анализ, обобщение, классификация, систематизация);
— переводить текстовую информацию в графическую и табличную;
— формулировать проблемные вопросы и выдвигать гипотезы;
— устанавливать причинно-следственные связи;
— переводить текстовую задачу на математический язык;
— аргументировать собственную позицию;
— строить высказывание в свободной форме;
— переводить единицы измерения;
— навыка самоконтроля и самооценки;
— уважительного отношения к другому мнению;
Оборудование: презентация к уроку, листок учащегося, карта самооценки урока
Урок рассчитан на 45 мин. (в классе с недостаточной математической подготовкой – 90 мин.)
Основные этапы урока:
1. Актуализация знаний.
2. Основная часть урока: практическое применение способов вычисления по формуле вещества и химическому уравнению.
3. Подведение итогов урока (результативность).
1. Актуализация знаний.
Мотивационный момент. Учитель интересуется, часто ли учащимся в повседневной жизни готовить растворы. Выслушивает ответы. В случае затруднений подсказывает(например: консервирование, утренний чай, раствор для полоскания при ангине и т.д.).Далее он заводит речь о соотношении веществ для раствора. Задаёт вопрос: как вы готовите чай? Из ответов учащихся вытекает, что количество веществ для них не принципиально. Но тогда учитель ставит учащихся в проблемную ситуацию и спрашивает, что произойдёт, если фармацевт приготовит капли для глаз, взяв вещества «на глазок»? Итог беседы подводят учащиеся: чаще всего в жизни следует для приготовления раствора соблюдать определённые пропорции компонентов раствора.
Учитель предлагает учащимся с помощью методического приёма «Головоломка» (слайд №1) вспомнить формулы, по которым будут производиться вычисления.
Мотивирует детей проблемной ситуацией.
Предлагает решить головоломку, которая мотивирует учащихся и задаёт направление уроку.
Строит работу с учащимися с опорой на слайд №1 презентации с целью выяснить ранее усвоенные знания об способах вычисления массовой доли вещества, массы раствора и т.д.
Участвуют в эвристической беседе, делают вывод из проблемной ситуации.
Участвуют, восстанавливают в памяти всё, что им известно из курса химии о способах вычисления по формуле и по химическому уравнению.
Работают со слайдом № 1 презентации и самостоятельно в тетради записывают обнаруженные в головоломке формулы для вычислений.
Затем после проверки сами оценивают свой результат на первом этапе урока по карте самооценки.
Учащиеся должны уметь: формулировать проблемные вопросы и выдвигать гипотезы;
— устанавливать причинно-следственные связи;
— написать основные формулы вычислений по химии.
Учащиеся должны уметь: аргументировать собственную позицию;
— строить высказывание в свободной форме;
Учащиеся должны уметь: ответственно относиться к учению, проявлять готовность и способность к саморазвитию и самообразованию.
2. Практическое применение способов вычисления по формуле вещества и химическому уравнению.
Учитель предлагает учащимся в соответствии с «Листком учащегося» (Приложение № 1) самостоятельно выполнить задания, выбрав парную или индивидуальную формы работы. На выполнение каждого задания отводится определённое время, после истечения которого, открывается правильный ответ (слайды № 3-5). Учащиеся оценивают результат своей работы на 2 этапе урока с помощью «Листа самооценки» (Приложение № 2).
Работают с «Листком учащегося» и выполняют задания в тетради. В случае затруднения обращаются к учителю или другим ученикам за помощью.
Работают с листом самооценивания.
Учащиеся должны уметь: составлять формулы бинарных соединений;
— составлять уравнения химических реакций;
— вычислять относительную молекулярную и молярную массы веществ;
— вычислять массовую долю химического элемента по формуле соединения;
— вычислять количество, объем или массу вещества по количеству, объему, массе реагентов или продуктов реакции;
— применять закон Авогадро;
— оперировать понятиями «молярный объем», «раствор»;
— вычислять массовую долю растворенного вещества в растворе;
Учащиеся должны уметь:
— переводить текстовую информацию в графическую;
— переводить текстовую задачу на математический язык;
— строить высказывание в свободной форме;
— отвечать на вопросы, задавать вопросы;
— осуществлять взаимодействие в паре.
Учащиеся должны уметь:
— уважительно относиться к другому мнению;
— честно и справедливо оценивать результаты своей работы.
5. Подведение итогов урока (результативность).
Учащиеся оценивают собственную работу на уроке, пользуясь листом самооценивания и шкалой перевода баллов в оценку (Приложение №2 «Листа самооценки» )
Учитель проводит беседу с учащимися:
1. Чему научились на уроке?
3. Что получилось лучше, а над чем надо ещё работать?
4. Как оценили свою работу на уроке?
5. Как вы думаете, могут ли пригодиться навыки вычислений в жизни? При каких обстоятельствах?
http://nsportal.ru/shkola/khimiya/library/2012/09/14/razlichnye-metody-resheniya-raschetnykh-zadach-0
http://infourok.ru/scenariy-uroka-po-himii-na-temu-provedenie-raschyotov-na-osnove-formul-i-uravneniy-reakciy-klass-1153608.html