Проводники 1 и 2 рода уравнение нернста
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
Конспект лекций для студентов биофака ЮФУ (РГУ)
3.5 ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
3.5.4 Классификация электродов
По типу электродной реакции все электроды можно разделить на две группы (в отдельную группу выделяются окислительно-восстановительные электроды, которые будут рассмотрены особо в разделе 3.5.5).
Электроды первого рода
К электродам первого рода относятся электроды, состоящие из металлической пластинки, погруженной в раствор соли того же металла. При обратимой работе элемента, в который включен электрод, на металлической пластинке идет процесс перехода катионов из металла в раствор либо из раствора в металл. Т.о., электроды первого рода обратимы по катиону и их потенциал связан уравнением Нернста (III.40) с концентрацией катиона (к электродам первого рода относят также и водородный электрод).
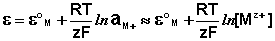
Электроды второго рода
Электродами второго рода являются электроды, в которых металл покрыт малорастворимой солью этого металла и находится в растворе, содержащем другую растворимую соль с тем же анионом. Электроды этого типа обратимы относительно аниона и зависимость их электродного потенциала от температуры и концентрации аниона может быть записана в следующем виде:
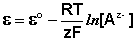
Для определения электродного потенциала элемента необходимо измерить ЭДС гальванического элемента, составленного из испытуемого электрода и электрода с точно известным потенциалом – электрода сравнения . В качестве примеров рассмотрим водородный, каломельный и хлорсеребряный электроды.
Водородный электрод представляет собой платиновую пластинку, омываемую газообразным водородом, погруженную в раствор, содержащий ионы водорода. Адсорбируемый платиной водород находится в равновесии с газообразным водородом; схематически электрод изображают следующим образом:
Электрохимическое равновесие на электроде можно рассматривать в следующем виде:
Потенциал водородного электрода зависит от активности ионов Н + в растворе и давления водорода; потенциал стандартного водородного электрода (с активностью ионов Н + 1 моль/л и давлением водорода 101.3 кПа) принят равным нулю. Поэтому для электродного потенциала нестандартного водородного электрода можно записать:
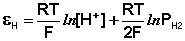
Каломельный электрод . Работа с водородным электродом довольно неудобна, поэтому в качестве электрода сравнения часто используется более простой в обращении каломельный электрод, величина электродного потенциала которого относительно стандартного водородного электрода точно известна и зависит только от температуры. Каломельный электрод состоит из ртутного электрода, помещенного в раствор КСl определенной концентрации и насыщенный каломелью Hg2Сl2:
Каломельный электрод обратим относительно анионов хлора и уравнение Нернста для него имеет вид:
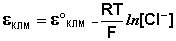
Хлорсеребряный электрод . В качестве электрода сравнения используют также другой электрод второго рода – хлорсеребряный, представляющий собой серебряную проволоку, покрытую хлоридом серебра и помещённую в раствор хлорида калия. Хлорсеребряный электрод также обратим относительно анионов хлора:
Величина потенциала хлорсеребряного электрода зависит от активности ионов хлора; данная зависимость имеет следующий вид:
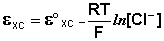
Чаще всего в качестве электрода сравнения используется насыщенный хлорсеребряный электрод, потенциал которого зависит только от температуры. В отличие от каломельного, он устойчив при повышенных температурах и применим как в водных, так и во многих неводных средах.
Электроды, обратимые относительно иона водорода, используются на практике для определения активности этих ионов в растворе (и, следовательно, рН раствора) потенциометрическим методом, основанном на определении потенциала электрода в растворе с неизвестным рН и последующим расчетом рН по уравнению Нернста. В качестве индикаторного электрода может использоваться и водородный электрод, однако работа с ним неудобна и на практике чаще применяются хингидронный и стеклянный электроды.
Хингидронный электрод , относящийся к классу окислительно-восстановительных электродов (см. ниже), представляет собой платиновую проволоку, опущенную в сосуд с исследуемым раствором, в который предварительно помещают избыточное количество хингидрона С6Н4О2·С6Н4(ОН)2 – соединения хинона С6Н4О2 и гидрохинона С6Н4(ОН)2, способных к взаимопревращению в равновесном окислительно-восстановительном процессе, в котором участвуют ионы водорода:
Хингидронный электрод является т.н. окислительно-восстановительным электродом (см. разд. 3.5.5); зависимость его потенциала от активности ионов водорода имеет следующий вид:
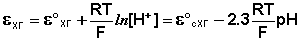
Стеклянный электрод , являющийся наиболее распространенным индикаторным электродом, относится к т.н. ионоселективным или мембранным электродам. В основе работы таких электродов лежат ионообменные реакции, протекающие на границах мембран с растворами электролитов; ионоселективные электроды могут быть обратимы как по катиону, так и по аниону.
Принцип действия мембранного электрода заключается в следующем. Мембрана, селективная по отношению к некоторому иону (т.е. способная обмениваться этим ионом с раствором), разделяет два раствора с различной активностью этого иона. Разность потенциалов, устанавливающаяся между двумя сторонами мембраны, измеряется с помощью двух электродов. При соответствующем составе и строении мембраны её потенциал зависит только от активности иона, по отношению к которому мембрана селективна, по обе стороны мембраны.
Наиболее часто употребляется стеклянный электрод в виде трубки, оканчивающейся тонкостенным стеклянным шариком. Шарик заполняется раствором НСl с определенной активностью ионов водорода; в раствор погружен вспомогательный электрод (обычно хлорсеребряный). Потенциал стеклянного электрода с водородной функцией (т.е. обратимого по отношению к иону Н + ) выражается уравнением
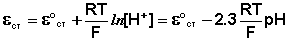
Необходимо отметить, что стандартный потенциал ε °ст для каждого электрода имеет свою величину, которая со временем изменяется; поэтому стеклянный электрод перед каждым измерением рН калибруется по стандартным буферным растворам с точно известным рН.
3.5.5 Окислительно-восстановительные электроды
В отличие от описанных электродных процессов в случае окислительно-восстановительных электродов процессы получения и отдачи электронов атомами или ионами происходят не на поверхности электрода, а только в растворе электролита. Если опустить платиновый (или другой инертный) электрод в раствор, содержащий двух- и трехзарядные ионы железа и соединить этот электрод проводником с другим электродом, то возможно либо восстановление ионов Fe 3+ до Fe 2+ за счет электронов, полученных от платины, либо окисление ионов Fe 2+ до Fe 3+ с передачей электронов платине. Сама платина в электродном процессе не участвуют, являясь лишь переносчиком электронов. Такой электрод, состоящий из инертного проводника первого рода, помещенного в раствор электролита, содержащего один элемент в различных степенях окисления, называется окислительно-восстановительным или редокс-электродом . Потенциал окислительно-восстановительного электрода также определяют относительно стандартного водородного электрода:
Pt, H2 / 2H + // Fe 3+ , Fe 2+ / Pt
Зависимость потенциала редокс-электрода ε RO от концентрации (активности) окисленной [Ox] и восстановленной форм [Red] для окислительно-восстановительной реакции, в которой не участвуют никакие другие частицы, кроме окислителя и восстановителя, имеет следующий вид (здесь n – число электронов, участвующих в элементарном акте окислительно-восстановительной реакции):
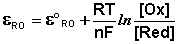
Из данного выражения следует уравнение для потенциала металлического электрода (III.40), т.к. активность атомов металла (восстановленной формы) в материале электрода равна единице.
В случае более сложных систем в выражении для окислительно-восстановительного потенциала фигурируют концентрации всех участвующих в реакции соединений, т.е. под окисленной формой следует понимать все соединения в левой части уравнения реакции
а под восстановленной – все соединения в правой части уравнения. Так, для окислительно-восстановительных реакций, протекающих с участием ионов водорода
уравнение Нернста будет записываться следующим образом:
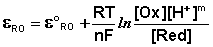
При составлении гальванических элементов с участием редокс-электрода электродная реакции на последнем в зависимости от природы второго электрода может быть либо окислительной, либо восстановительной. Например, если составить гальванический элемент из электрода Pt / Fe 3+ , Fe 2+ и второго электрода, имеющего более положительный электродный потенциал, то при работе элемента редокс-электрод будет являться анодом, т.е. на нем будет протекать процесс окисления:
Если потенциал второго электрода будет меньше, чем потенциал электрода Pt / Fe 3+ , Fe 2+ , то на последнем будет протекать реакция восстановления и он будет являться катодом:
Знание величин электродных потенциалов позволяет определить возможность и направление самопроизвольного протекания любой окислительно-восстановительной реакции при одновременном наличии в растворе двух или более окислительно-восстановительных пар. Восстановленная форма любого элемента или иона будет восстанавливать окисленную форму другого элемента или иона, имеющего более положительный электродный потенциал.
Copyright © С. И. Левченков, 1996 — 2005.
Проводники 1 и 2 рода уравнение нернста
Правильно разомкнутая электрохимическая цепь, на концах которой можно измерить электрическую разность потенциалов, называется гальваническим элементом. Рассмотрим электрохимическую цепь, состоящую их электролита, 2 электродов и одинаковых по природе проводников.
Одним из электродов возьмем водородный электрод (Pt, H2 / HСl), 2 электрод –серебряный (AgСl / Ag).
Чтобы цепь была правильно разомкнута, надо разомкнуть на Ag.
Ag | Pt, H2 | HСl | AgСl, Ag
Схема правильно разомкнутой электрохимической цепи.
| — граница раздела фаз.
В этой цепи 3 границы раздела фаз и разность внешних потенциалов ∆Е ═ алгебраической сумме 3 скачков
Таким образом, разность в-потенциалов правильно разомкнутой цепи складывается из скачков гальвани-потенциалов на каждой из границ раздела.
Выражения для этих гальванипотенциалов вытекают из условий равновесия на каждой из фазовых границ.
Условия фазового равновесия:
1 гр. Равенство электрохимических потенциалов двух разных Ме:
II (на 2 границе)
III (на 3 границе)
Складывая между собой уравнения для потенциалов на фазовых границах, получим с учетом выражения для электрохимического потенциала i-того компонента следующее выражение ∆Е
Если число перенесенных электронов в электрохимической цепи больше 1, то число Фарадея умножается на n.
Суммарная химическая реакция, которая лежит в основе работы рассматриваемого гальванического элемента имеет следующий вид:
Ag С l + ½ H 2 = Ag + H С l
полуреактивное окисление ½ H2 – е = Н + ; Ag + + е = Ag п/р восстановление
ионное суммарное ½ H2 + Ag + = Н + + Ag
Для этой реакции можно записать изменение свободной энергии Гиббса ∆G
∆Ν – изменение числа молей в ходе реакции
Сравнивая выражения для ∆G и ∆Е имеем
— ∆ G = F n ∆Е = A ′ max
A′max – максимально полезная работа по определению изобарического – изотермического потенциала.
∆Е, равное разности потенциалов на концах правильно разомкнутой электрохимической цепи, называется ЭДС гальванического элемента и может служить критерием при определении направленности окислительно-восстановительных реакций. Процесс будет самопроизвольным при ∆Е > 0.
Для измерения ЭДС гальванических элементов применяют компенсационный метод, при котором разность потенциалов на концах электрохимической цепи компенсируется выверенной по эталону разностью потенциалов от внешнего источника тока. Упрощенная схема компенсационного метода имеет следующий вид:
На реохорде будут включены некоторые сопротивления. В соответствии со схемой Ех определяется из соотношения Ех/Еэт = ех/еэт = I Rх/I Rэт; Ех=Еэт·ех/еэт .
Знак эдс устанавливается по отношению правого электрода к левому. Условленно, что электрохимическая цепь для измерения электродных потенциалов составляется таким образом, что на месте правого электрода всегда исследуемый электрод, на месте левого – электрод сравнения.
Если при этом ∆Е получается больше нуля, то процесс самопроизвольный и на правом положительном электроде (катоде) идет процесс восстановления. Если ∆Е
Так как величена ЭДС гальванического элемента складывается из скачков потенциалов на границах электрод-раствор, то величена ЭДС будет зависеть не только от природы электрода, но и от активности или концентрации электролита или его отдельных компонентов.
В рассматриваемом гальваническом элементе такими компонентами являются Н2 (газ), Н + , Cl — (ионы в растворе) и Ag, AgCl (твердые вещества). Химические потенциалы твердых веществ не изменяются в растворе и отвечают стандартным значениям, то есть μ 0 Ag и μ 0 AgCl. При условии, что водород подается к платиновому электроду под давлением в 1 атмосферу (10 5 – нормальные условия), то потенциал водорода также будет стандартным μ 0 Н 2 . Для ионов же в растворе имеет место уравнение Нернста для химического потенциала:
Подставим эти выражения в уравнения для ∆Е и ∆G
В этом случае член в скобках отвечает величине ∆G 0 .
Полученное выражение отвечает величине ЭДС рассматриваемого гальванического элемента в произвольных условиях. Распространяя это уравнение на окислительно-восстановительные реакции в электрохимической системе, получим общее уравнение Нернста для ЭДС:
Пi — произведение по i
νί — стехиометрические коэффициенты в уравнении реакции
ai – активных элементов.
Для исходных веществ νί для конечных νί>0
В соответствии с этим знак перед логарифмом меняется.
Применяя к электрохимическим реакциям уравнение Гиббса- Гельмгольца в виде:
Можно получить тепловой эффект электрохимической реакции с учетом выражения — ∆G = nF∆Е в виде:
∆Н = -n F∆Е + T d∆Е/dT,
где d∆Е/dT – температурный коэффициент ЭДС; может быть либо плюс, либо минус, поэтому эффект электрохимической реакции будет
и ∆Н 0 только для низких температур
и ∆Н >0 для высоких температур.
Величина температурного коэффициента эдс отвечает изменению энтропии реакции:
по определению ∆S = — d∆G / dT
Таким образом, температурная зависимость эдс позволяет рассчитать все основные термодинамические характеристики окислительно-восстановительной реакции, лежащие в основе работы гальванического элемента. Стандартное уравнение изотермы Вант-Гоффа
дает возможность определить константу равновесия, а, следовательно, глубину окислительно-восстановительной реакции по методу эдс
— n F ∆Е` = — RT ln Кр
Электрохимические цепи строго равновесны лишь тогда, когда они не содержат границы двух различных растворов. При наличии такой границы на ней происходят независимые процессы диффузии, и возникает диффузионный потенциал. Электрохимическая цепь, содержащая границу двух растворов, называется цепью с переносом.
Диффузионный потенциал является гальванопотенциалом в разных фазах, поэтому его нельзя точно вычислить.
Если приравнять ∆G, обусловленное переносом ионов через границу двух различных растворов, к электрической работе, то можно получить общую формулу:

а i – активность отдельного иона, значение которого не известно.
Если в разбавленных растворах активность отдельных ионов заменить их концентрацией, то задавшись распределением концентрации в области между двумя растворами, величина ∆φдиф можно рассчитать с небольшой погрешностью по формуле Хендерсона:
Классификация электродов и электрохимических цепей
Электрохимические цепи характеризуются по двум признакам:
1) по источнику электрической энергии в цепи;
2) по наличию или отсутствию в цепи границ двух различных растворов (цепь с (без) переноса).
1. Физические цепи – без переноса источника электрической энергии – служит различие в физическом состоянии двух одинаковых по химическому состоянию электродов. Эти электроды погружены в один и тот же раствор и при работе цепи электрод, находящемся в менее устойчивом состоянии, переходит в более устойчивое. Разновидность физической цепей – алютропические цепи, в которых один из электродов сделан из метастабильной модификации данного металла. Другая разновидность – гравитационные цепи.
2. Концентрационные цепи – отличаются только концентрацией компонентов Red и Ox при одинаковых электродах и растворах. Источником электрической Е в них является разность свободной энергии Гиббса за счет разной активности химических компонентов.
∆ E = ∆ E 0 – ν RTln ( a ± )/ nF
3. Химические цепи – источник электрической энергии – свободная энергия химической реакции. Химическими цепями являются все остальные разновидности гальванических элементов, в которых электроды разного состава. Для электрохимических исследовании в зависимости от назначения исследуются различные типы электродов, которые классифицируются по природе Red и Ox форм.
с i / — концентрация раствора I , ci // — концентрация раствора II
Типы электродов
Для электрохимических исследований в зависимости от назначения используются различные типы электродов, которые классифицируются по природе веществ окисленной и восстановленной форм, участвующих в электродном процессе.
Электроды I рода
Электродом 1-го рода называют систему, в которой восстановленной формой Red является металл, а окисленной ОХ — соль данного металла, содержащая простые ионы Ме n+ . Пример такого электрода – система Сu/Сu 2+ , где полуреакция восстановления следующая:
Потенциал такого электрода 1-го рода записывается в соответствии с уравнением Нернста:
Как видно из этого выражения, электроды 1-го рода являются обратимыми по катиону, т.е. их потенциал является функцией активности катиона. Однако, есть электрода 1-го рода, обратимые по аниону.
Например, полуреакция восстановления теллура
2 Те + 2е ↔ Те2 2-
Еще к электродам I рода относятся амальгамные электроды, например: амальгама ртути на таллии.
Полуреакция восстановления Tℓ (таллия)
В общем случае формула для потенциала может иметь вид:
a i – активность ионов сорта i
a M – активность ионов сорта металла
Для чистых металлов активность является величенной постоянной, поэтому член с активностью металла можно объединить со стандартным потенциалом: Е 0/ =Е 0 -RTln( aM)/nF. Тогда, для потенциала I рода:
Электроды II рода
Электродом II рода называют систему, в которой металл покрыт слоем его труднорастворимой соли или оксидом, а раствор содержит анионы этой соли или группы ОН — .
Полуреакция восстановления для хлор — серебряного электрода имеет вид:
AgCl + e ↔ Ag + + Cl —
Потенциал такого электрода согласно этому уравнению:
Как видно из этого уравнения электроды II рода обратимы по аниону.
Полуреакция восстановления для ртутно-окисного электрода имеет вид:
Каломельный электрод – это соль Нg2Cl2 (серого цвета).
Н g 2 + Cl 2 — + 2 e ↔ 2 Hg + 2 Cl —
Электроды II рода используются в качестве электродов сравнения, тогда как электрод I рода – в качестве рабочих электродов.
Электроды III рода
Электроды III рода – это электроды, в которых металлы находятся в контакте с двумя труднорастворимыми солями, а в растворе присутствуют ионы соли с большим произведением растворимости.
I. Pb + | PbCl2, AgCl, Ag
ПР – произведение растворимости
Ag + Cl + 2e + Pb 2+ ↔ 2Ag + PbCl2
II. Электрод III рода будет отвечать тому электроду, в котором металл является лишь передатчиком электронов между Red– и ОХ– формой. Такие электроды называются редокс – системами, они обратимы. А в качестве дифферентного металла может быть использована платина или устойчивые к агрессивным средам спеченные порошки карбидов или нитридов переходных металлов, обладающих электронной проводимостью. Одной из классических редокс–систем может быть:
Полуреакция восстановления: I2 + 2e + I — ↔ I 3-
ферри – ферроцианид К
Полуреакция восстановления: Fe 3+ + e ↔ Fe 2+
III. Третий пример – газовый электрод: кислородный, хлорный, водородный электроды. Представляют собой инертную металлическую пластину, к которой подводится электрохимически активный газ. Молекулы газа адсорбируются на поверхности металла, распадаясь на атомы, а затем участвуя в окислительном процессе с раствором содержащем одноименные ионы, например, стандартный водородный электрод сравнения. Он представляет собой платиновую пластину, покрытую слоем платиновой черни для увеличения истинной поверхности. Эта пластина опущена в 1М раствора H2SO4, налитый в емкость, внутрь которой пропускают чистый водород под давлением Р = 1 атм.
Полуреакция восстановления: Н + + ē↔1/2Н2
Потенциал водородного электрода – ЭДС следующей электрохимической цепи:
Если в правой части цепи активность Н + и давление газа будут стремится к 1, то цепь окажется симметричной и ∆E = 0. Именно такой водородный электрод и принят за стандартный электрод сравнения. Условились в электрохимических цепях при измерении электродных потенциалов стандартные электроды сравнения записывают слева, а исследуемые справа, тогда электродный потенциал будет являться электродвижущей силой электрохимической цепи, построенной из стандартного водородного электрода и полуреакции восстановления на границе исследуемого электрода с раствором. Знак электродного потенциала определяется напряжением тока в данной цепи, совпадающим с направлением движения электронов во внешней цепи. Это соответствует положительному направлению обхода контура.
Метод ЭДС при определении коэффициента активности, чисел переноса и произведения растворимости
Для более точного определения коэффициента активности методом эдс используемой химической цепи без переноса эдс такой цепи представлено в виде:
∆Е = Е 0 – d rt / nF ln (L · C) – d rt / nF lnb ±
L = √ d d d+ + ∙ d d- — , с- концентрация соли в растворе Мd+А d-
Это уравнение соединяет 2 неизвестных Е 0 и b ±, поэтому строят график зависимости [Е 0 + d rt / nF ln (L · C)] = [Е 0 – d rt / nF lnb ±] от √с
При малых концентрациях соли зависимость lnb ± от √с линейна, т.е. согласно предельному закону Дебая-Гюккеля: lg b ± = – ׀ z + z — ׀ h √I
Экстраполяция линейного участка графика в с=0 отсекает на ординате ∆Е0 и рассчитывает b ±.
Для определения чисел переноса методом эдс используется разность потенциалов на концах концентрацной цепи с переносом. Если известны коэффициенты активности в исследуемых растворах, то число переноса можно рассчитать:
Например: цепь (I) Cd/ CdSO4 CdSO4/Cd d = 2
Концентрации 2-х растворов не должны сильно отличаться друг от друга. Тогда найденные числа переноса t – и t + = 1- t будут составлять средней концентрации √с1∙с2.
Если измерить разность потенциалов в цепи 1 и в цепи 2:
Cu / Cd / CdCl 2 / AgCl , Ag / Cd / AgCl , Ag / CdCl 2 / Cd / Cu
Значение стандартных потенциалов позволяет рассчитать по методу ЭДС произведение растворимости трудно растворимой соли или оксида. Произведение растворимости соли МеА:
E 0 – стандартный потенциал электрода II рода с полуреакцией:

Е 0/ – стандартный потенциал I рода с полуреакцией:

Применение уравнения Нернста в решении задач.
При рассмотрении вопроса об окислительно-восстановительных реакциях часто возникает необходимость расчета электродвижущей силы (ЭДС) и потенциалов отдельных полуреакций. В справочниках обычно приведены таблицы т.н. стандартных потенциалов тех или иных процессов, рассчитанных при р=1 атм, Т=298К и активностях участников равных 1. Однако в реальных задачах условия могут значительно отличаться от указанных выше. Как быть в таком случае? Ответ дает уравнение Нернста. В оригинальном виде оно выглядит так:
Как можно заметить, в уравнении фигурируют несколько постоянных величин. Также температура в подавляющем большинстве случаев равна 298К. Кроме того, можно заменить натуральный логарифм на десятичный. Это можно сделать путем умножения на коэффициент перевода. Если собрать все постоянные в единый множитель, то приходим к несколько иному, но более знакомому по учебным пособиям виду уравнения Нернста:
Такой вариант уравнения сильно облегчает жизнь в ряде случаев, например рассмотрении рН-зависимых процессов. Используя данное уравнение можно провести вычисления в любых условиях, приведенных в задаче. Рассмотрим характерные примеры задания по данной теме.
Пример 1:
Рассчитать ЭДС гальванического элемента, составленного из медной и цинковой пластин, погруженных в растворы 0.1М CuSO4 и 0.01М ZnSO4 соответственно. Коэффициенты активности ионов Cu 2+ и Zn 2+ принять равными единице.
Решение:
Для начала запишем уравнения протекающих процессов:
Далее находим по таблице стандартные потенциалы процессов:
Если в условиях задачи ничего не сказано про коэффициенты активности ионов, то можно считать их равными единице, как и в нашем случае. Тогда активности участников процессов можно принять равными их аналитическим концентрациям.
Найдем реальные потенциалы с учетом нестандартных активностей ионов:
Далее необходимо сравнить полученные величины между собой, чтобы определить, кто из участников процесса – окислитель. Потенциал меди больше, чем у цинка, поэтому она будет окислителем. Тогда найдем ЭДС системы:
Ответ: 1.13 В
Пример 2:
Одним из лабораторных способов получения хлора является действие KMnO4 на концентрированную соляную кислоту. Можно ли провести процесс при рН=4?
Решение:
Для начала запишем уравнения протекающих процессов.
Далее находим по таблице стандартные потенциалы процессов:
Несложно заметить, что от рН в данном случае зависит только потенциал перманганата. Тогда воспользуемся уравнением Нернста и рассчитаем его реальный потенциал в условиях задачи:
Получается, что потенциал KMnO4 стал меньше, чем у хлора, а значит, реакция не пойдет.
http://www.trotted.narod.ru/physchem/lec-37.htm
http://scienceforyou.ru/jelektrohimija/uravnenie-nernsta










