Урок 14. Расчеты по уравнениям химических реакций
В уроке 14 «Расчеты по уравнениям химических реакций» из курса «Химия для чайников» мы научимся решать задачи, используя уравнения химических реакций.
Вещества вступают в химические реакции в определенных массовых и количественных соотношениях. Следовательно, при проведении реакций в лабораториях и на химических заводах расходуются определенные массы исходных веществ для получения заданной массы продуктов реакции.
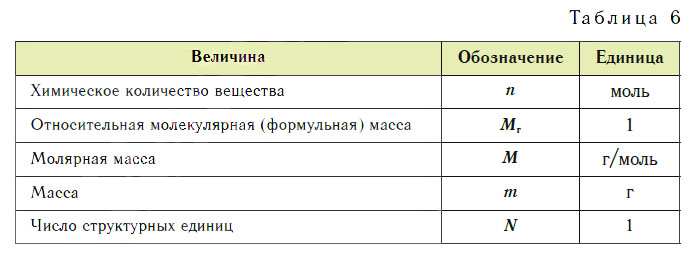
Эти расчеты проводят по уравнениям реакций. Единицы величин, которыми пользуются в химии, представлены в таблице 6.
При проведении любого вычисления по уравнению реакции нужно внимательно прочитать условие задачи. Особое в нимание обратите на расстановку коэффициентов, так как соотношение числа структурных единиц реагирующих веществ и получающихся продуктов реакции выражается в уравнениях коэффициентами так же, как и мольные отношения.
Для решения расчетной задачи необходим определенный порядок действий. Рассмотрим его на нескольких примерах.
Пример 1. Железо масс о й 224 г полностью прореагировало с хлором. Рассчитайте массу образовавшегося вещества FeCl3.
Расчеты массы вещества по уравнению химической реакции
Этот видеоурок доступен по абонементу
У вас уже есть абонемент? Войти
При решении расчетных химических задач необходимо умение производить вычисления по уравнению химической реакции. Урок посвящен изучению алгоритма расчетов массы (объема, количества) одного из участников реакции по известной массе (объему, количеству) другого участника реакции.
Расчёты по уравнениям химических реакций.
Стехиометрия – количественные соотношения между вступающими в реакцию веществами.
Если реагенты вступают в химическое взаимодействие в строго определенных количествах, а в результате реакции образуются вещества, количество которых можно расчитать, то такие реакции называются стехиометрическими.
Законы стехиометрии:
Коэффициенты в химических уравнениях перед формулами химических соединений называются стехиометрическими.
Все расчёты по химическим уравнениям основаны на использовании стехиометрических коэффициентов и связаны с нахождением количеств вещества (чисел молей).
Количество вещества в уравнении реакции (число молей) = коэффициенту перед соответствующей молекулой.
Моль – это такое количество вещества, в котором содержится определённое число частиц (молекул, атомов, ионов), равное постоянной Авогадро:
Выход реакции η – отношение реальной массы продукта mp к теоретически возможной mт, выраженное в долях единицы или в процентах.
Если в условии выход продуктов реакции не указан, то в расчетах его принимают равным 100% (количественный выход).
Схема расчёта по уравнениям химических реакций:
- Составить уравнение химической реакции.
- Над химическими формулами веществ написать известные и неизвестные величины с единицами измерения.
- Под химическими формулами веществ с известными и неизвестными записать соответствующие значения этих величин, найденные по уравнению реакций.
- Составить и решить пропорцию.
Пример. Вычислить массу и количество вещества оксида магния, образовавшегося при полном сгорании 24 г магния.
1. Составим уравнение химической реакции:
2. Под формулами веществ укажем количество вещества (число молей), которое соответствует стехиометрическим коэффициентам:
3. Определим молярную массу магния:
Относительная атомная масса магния Ar(Mg) = 24.
Т.к. значение молярной массы равно относительной атомной или молекулярной массе, то M(Mg) = 24 г/моль.
4. По массе вещества, заданной в условии, вычислим количество вещества:
5. Над химической формулой оксида магния MgO, масса которого неизвестна, ставим x моль, над формулой магния Mg пишем его молярную массу:
6. Составим пропорцию:
По правилам решения пропорции:
Количество оксида магния ν(MgO) = 1 моль.
http://interneturok.ru/lesson/chemistry/8-klass/bvewestva-i-ih-prevraweniyab/raschety-massy-veschestva-po-uravneniyu-himicheskoy-reaktsii
http://www.calc.ru/Raschty-Po-Uravneniyam-Khimicheskikh-Reaktsiy.html