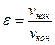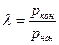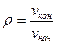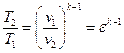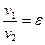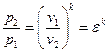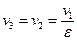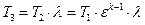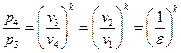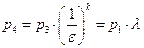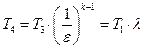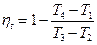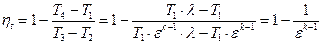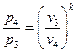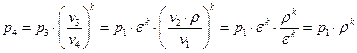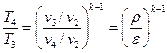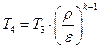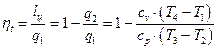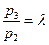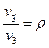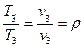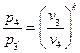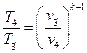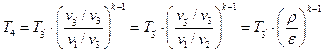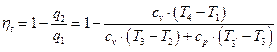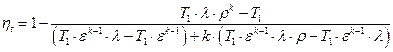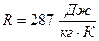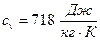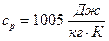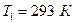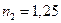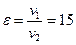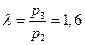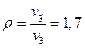Вопрос 2. Параметры состояния и уравнения состояния.
Вопрос 2. Параметры состояния и уравнения состояния.
Параметры состояния — физические величины, характеризующие внутреннее состояние термодинамической системы. Параметры состояния термодинамической системы подразделяются на два класса: интенсивные (не зависят от массы системы) и экстенсивные (пропорциональны массе).
Термодинамическими параметрами состояния называются интенсивные параметры, характеризующие состояние системы. Простейшие параметры:
1. 
2. 
3. 
4. 
Связь между параметрами, характеризующими состояние простого тела, называется уравнением состояния F (р, v, T) = 0.
Изменение состояния системы называется процессом.
Равновесный процесс — это непрерывная последовательность равновесных состояний системы.
Обратимый процесс — равновесный процесс, который допускает возможность возврата этой системы из конечного состояния в исходное путем обратного процесса.
Термодинамическим процессомпринято считать обратимый равновесный процесс.
Равновесные процессы могутбыть изображены графически на диаграммах состояния p-v, р-Т и т. д. Линия, изображающая изменение параметров в процессе, называется кривой процесса. Каждая точка кривой процесса характеризует равновесное состояние системы.
Уравнение термодинамического процесса – уравнение вида 
Уравнение состояния для простого тела — 
Идеальный газ – совокупность материальных точек (молекул или атомов), находящихся в хаотическом движении. Эти точки рассматриваются как абсолютно упругие тела, не имеющие объёма и не взаимодействующие друг с другом. Уравнением состояния идеального газа является уравнение Менделеева-Клапейрона:
PV=nRT, где P – давление, [Па]; V – объём системы [м 3 ]; n – количество вещества, [моль]; T – термодинамическая температура, [К]; R – универсальная газовая постоянная.
Реальный газ – газ, молекулы которого взаимодействуют друг с другом и занимают определённый объём. Уравнением состояния реального газа является обобщённое уравнение Менделеева-Клапейрона:

_____________________________________________________________
Вопрос 3. Термодинамическая работа, координаты P-V.
Термодинамическая работа: 


Удельная работа: 


— Если 

— Если 

— При малом изменении объёма давление практически не изменяется.


1. В случае если 

2. В случае если дано уравнение процесса — 




Вопрос 4. Потенциальная работа, координаты P-V, распределение работы.
Потенциальная работа – работа, вызываемая изменением давления.

— Если 

— Если 

— При малом изменении давления объём почти не меняется.


1. В случае если 

2. В случае если дано уравнение процесса — 



переданная внешним системам.

________________________________________________________
Вопрос 16. Изобарный процесс изменения состояния простого тела. Уравнение процесса, изображение в координатах P-V, связь между параметрами, работа и теплообмен, изменение функций состояния.
Если 







Так как 

Для идеального газа:
Первое начало термодинамики: 
Для идеального газа: 







Вопрос 63. Дросселирование. Эффект Джоуля-Томсона. Основные понятия
Дросселирование – процесс движения вещества через внезапное сужение. Причинами возникновения местных сопротивлений при движении потока рабочего тела по каналам могут быть запорные, регулирующие и измерительные устройства; повороты, сужение, загрязнение каналов и т.д.
Эффект Джоуля-Томсона — изменение температуры вещества при адиабатном дросселировании.
Рис. 1.7. Процесс дросселирования в h-s диаграмме
Различают дифференциальный и интегральный дроссель – эффекты. Величина дифференциального дроссель – эффекта определяется из соотношения


Интегральный дроссель-эффект: 
Коэффициент Джоуля – Томсона выводится из математических выражений первого начала термодинамики и второго начала термостатики
1. Если дроссель–эффект положительный (Dh > 0), то снижается температура рабочего тела (dT 0);
3. Если дроссель–эффект равен нулю (Dh = 0), то температура рабочего тела не изменяется. Состояние газа или жидкости, которому соответствует условие Dh = 0, называется точкой инверсий.
___________________________________________________________________
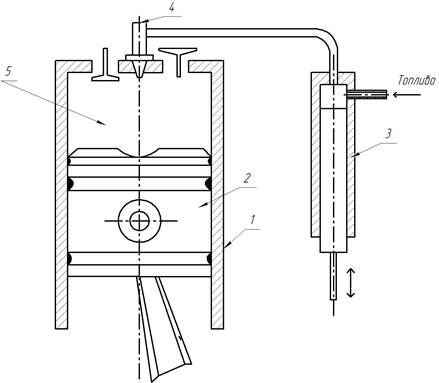
Двухтактный дизель
Рабочий процесс в двухтактном дизеле в основном протекает так же как и в двухтактном карбюраторном двигателе, и отличается только тем что продувка цилиндра производится чистым воздухом. По окончании ее оставшийся в цилиндре воздух сжимается. В конце сжатия через форсунку впрыскивается топливо в камеру сгорания и воспламеняется.Схема двухтактного дизеля с кривошипно-камерной продувкой показана на рисунке 14, а, а индикаторная диаграмма — на рисунке 14, 6.
Рабочий процесс в двухтактном дизеле протекает следующим образом.
Первый такт. При движении поршня вверх от н. м. т. к в. м. т. вначале происходит окончание продувки, а затем окончание выпуска. На индикаторной диаграмме продувка изображена линией b»— a» а выпуск — а» — а.
После закрытия выпускного окна поршнем в цилиндре происходит сжатие воздуха. Линия сжатия на индикаторной диаграмме изображена кривой а—с. В это время под поршнем в кривошипной камере создается разрежение, под действием которого автоматический клапан открывается, и в кривошипную камеру засасывается чистый воздух. В начале движения поршня вниз, вследствие уменьшения объема под поршнем, давление воздуха в кривошипной камере повышается, и клапан закрывается.
Второй такт. Поршень движется от в. м. т. к н. м. т. Впрыск и горение топлива начинаются перед концом сжатия и заканчиваются после того, как поршень пройдет в. м. т. По окончании горения происходит расширение. Протекание процесса расширения на индикаторной диаграмме изображено кривой r-b.
Остальные процессы, выпуск и продувка протекают так же, как и в карбюраторном двухтактном двигателе.
Вопрос 2. Параметры состояния и уравнения состояния.
Параметры состояния — физические величины, характеризующие внутреннее состояние термодинамической системы. Параметры состояния термодинамической системы подразделяются на два класса: интенсивные (не зависят от массы системы) и экстенсивные (пропорциональны массе).
Термодинамическими параметрами состояния называются интенсивные параметры, характеризующие состояние системы. Простейшие параметры:
1. 
2. 
3. 
4. 
Связь между параметрами, характеризующими состояние простого тела, называется уравнением состояния F (р, v, T) = 0.
Изменение состояния системы называется процессом.
Равновесный процесс — это непрерывная последовательность равновесных состояний системы.
Обратимый процесс — равновесный процесс, который допускает возможность возврата этой системы из конечного состояния в исходное путем обратного процесса.
Термодинамическим процессомпринято считать обратимый равновесный процесс.
Равновесные процессы могутбыть изображены графически на диаграммах состояния p-v, р-Т и т. д. Линия, изображающая изменение параметров в процессе, называется кривой процесса. Каждая точка кривой процесса характеризует равновесное состояние системы.
Уравнение термодинамического процесса – уравнение вида 
Уравнение состояния для простого тела — 
Идеальный газ – совокупность материальных точек (молекул или атомов), находящихся в хаотическом движении. Эти точки рассматриваются как абсолютно упругие тела, не имеющие объёма и не взаимодействующие друг с другом. Уравнением состояния идеального газа является уравнение Менделеева-Клапейрона:
PV=nRT, где P – давление, [Па]; V – объём системы [м 3 ]; n – количество вещества, [моль]; T – термодинамическая температура, [К]; R – универсальная газовая постоянная.
Реальный газ – газ, молекулы которого взаимодействуют друг с другом и занимают определённый объём. Уравнением состояния реального газа является обобщённое уравнение Менделеева-Клапейрона:

_____________________________________________________________
Расчет параметров состояния в характерных точках цикла
ТЕРМОДИНАМИЧЕСКИЕ ЦИКЛЫ ДВИГАТЕЛЕЙ ВНУТРЕННЕГО СГОРАНИЯ
по дисциплине «Основы теплотехники»
для студентов направления подготовки 23.03.02 профиль «Автомобиле- и тракторостроение»
Автор-составитель Н.А. Овчинников
Овчинников Н.А. Термодинамические циклы двигателей внутреннего сгорания: учебно-методическое пособие /Н.А. Овчинников. – Ковров: ФГБОУ ВПО «КГТА им. В.А. Дегтярева», 2014. – 32 с.
Содержит теоретические сведения по расчету циклов двигателей внутреннего сгорания, пример расчета цикла двигателя внутреннего сгорания, а также описание расчетно-практической работы, выполняемой в рамках дисциплины «Основы теплотехники», учебного плана направления подготовки 23.03.02 по профилю «Автомобиле- и тракторостроение»,
Табл. 1 Ил. 8 Библиогр.: 4 назв.
Рекомендовано к изданию редакционно-издательским советом КГТА
Рецензенты: канд. техн. наук М.В. Опарин (зам. нач. отдела испытаний Ковровского филиала ГКНПЦ им. М.В. Хруничева – КБ «Арматура»), д-р техн. наук, профессор С.А. Воронов (ФГБОУ «КГТА им. В.А. Дегтярева)
ВВЕДЕНИЕ
Изучение термодинамических циклов двигателей внутреннего сгорания является заключительным этапом изучения одного из важных разделов технической термодинамики, обобщающим знания в области термодинамических процессов. Теоретические знания бесполезны, если не связаны с формированием компетенций по решению конкретных задач инженерной практики. Формированию необходимых компетенций способствует выполнение расчетно-практической работы.
Основными целями, на которые направлено выполнение расчетно-практической работы являются следующие:
— закрепление и углубление теоретического материала по технической термодинамике;
— приобретение практических навыков применения полученных теоретических знаний.
В расчетно-практической работе предусмотрено решение технического задания по расчету параметров различных типов термодинамических циклов двигателей внутреннего сгорания, которые в настоящее время являются основным видом энергетических установок автомобильной и тракторной техники.
Теоретический материал приведен в объёме, достаточном для самостоятельного выполнения студентом работы, без привлечения дополнительной литературы, и, не ожидая, когда будут прочитаны соответствующие разделы лекционного курса.
1. ОСНОВЫ ТЕОРИИ ТЕРМОДИНАМИЧЕСКИХ ЦИКЛОВ ДВИГАТЕЛЕЙ ВНУТРЕННЕГО СГОРАНИЯ
Двигателем внутреннего сгорания (ДВС) называется тепловой двигатель, в котором процесс выделения и подвода теплоты к системе в результате сгорания топлива происходит внутри рабочего цилиндра двигателя.
Рабочим телом в ДВС в начале цикла является рабочая смесь (смесь воздуха с парами топлива) или чистый воздух, а в конце цикла – смесь газов, образовавшихся при сгорании топлива.
Часть теплоты, полученная в результате сгорания топлива, расходуется на совершение механической работы, а оставшаяся неиспользованная часть теплоты, как правило, выбрасывается в окружающую среду. На рис. 1.1 показана принципиальная схема поршневого двигателя внутреннего сгорания.
Рис. 1.1 Принципиальная схема двигателя внутреннего сгорания
Основными элементами любого поршневого ДВС являются цилиндр 1 с поршнем 2, поступательное движение которого посредством кривошипно-шатунного механизма 3 преобразуется во вращательное движение коленчатого вала 4. В верхней части цилиндра размещен впускной 5 и выпускной 6 клапан, а также свеча зажигания (либо форсунка для распыления жидкого топлива в дизельном двигателе) 7.
Помимо этого в ДВС имеются: механизм газораспределения, системы питания топливом, зажигания, смазки, охлаждения и др.
Смесь распыленного в воздухе топлива называется рабочей смесью, а процесс приготовления рабочей смеси – смесеобразованием.
По способу приготовления рабочей смеси ДВС подразделяются на ДВС с внешним и внутренним смесеобразованием. К ДВС с внешним смесеобразованием относятся карбюраторные и газовые двигатели. Рабочая смесь в них приготавливается в специальном внешнем устройстве – карбюраторе (при работе на бензине или керосине) или смесителе (при работе на газовом топливе). В ДВС с внешним смесеобразованием в цилиндр подаётся уже готовая рабочая смесь, которая воспламеняется принудительно от электрической искры (свечой зажигания).
Рис. 1.2. Схема двигателя высокого сжатия
В ДВС с внутренним смесеобразованием приготовление рабочей смеси происходит внутри рабочего цилиндра 1 (рис. 1.2), куда воздух и топливо подаются раздельно. Сначала поршень 2 сжимает чистый воздух до высокого давления 3…4 МПа, вследствие чего его температура в конце процесса сжатия достигает 600…650°С. Затем в камеру сгорания 5 через форсунку 4 впрыскивается жидкое топливо. Топливо к форсунке подаётся специальным топливным насосом 3. Проходя через форсунку, топливо распыляется и воспламеняется при смешении с раскаленным воздухом. Двигатели, работающие по принципу воспламенения топлива при высоком сжатии, называются двигателями высокого сжатия.
Циклы ДВС в зависимости от процесса подвода теплоты к рабочему телу подразделяются на 3 типа:
1. С изохорным (при 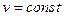
2. С изобарным (при 
3. Со смешанным (сначала при 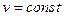

Важными характеристиками циклов ДВС являются:
Степень сжатия ( 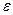
Степень сжатия рабочей смеси в ДВС с внешним смесеобразованием довольно низкая ( 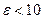
Детонация – вредное явление преждевременного самовоспламенения рабочей смеси ещё до прихода поршня в требуемое положение. Степень сжатия в ДВС с внутренним смесеобразованием значительно выше, чем у карбюраторных и может достигать значений 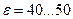
Степень повышения давления ( 
Степень повышения давления показывает во сколько раз повышается давление в цилиндре после сгорания топлива при 
Степень предварительного расширения ( 
Степень предварительного расширения показывает во сколько раз повышается удельный объём в цилиндре после сгорания топлива при 
При термодинамическом анализе циклов ДВС приняты следующие допущения, позволяющие упростить анализ.
1. В качестве рабочего тела принимается идеальный газ, теплоёмкость которого не зависит от температуры.
2. Цикл замкнут и на всех стадиях цикла количественный и качественный состав рабочего тела не изменяется.
3. Теплота к рабочему телу подводится от внешнего горячего источника, а не за счет сжигания топлива, отводится – к внешнему холодному источнику, а не выбросом в атмосферу.
4. Процессы сжатия и расширения рабочего тела адиабатные, т.е. протекают без теплообмена с внешней средой.
5. Отсутствует трение между элементами шатунно-поршневой группы и гидравлическое сопротивление в клапанах и подводящих коммуникациях.
6. Разность температур между источниками теплоты и рабочим телом бесконечно мала.
При исследовании идеальных термодинамических циклов обычно определяют параметры состояния рабочего тела в характерных точках цикла, количество подведенной и отведенной теплоты, полезную работу цикла, вычисляют термический КПД цикла и проводят его анализ.
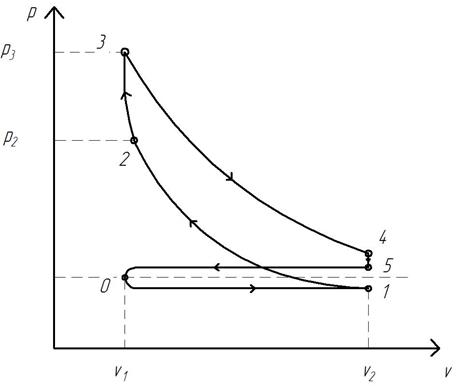
1.1. ЦИКЛ ДВС С ПОДВОДОМ ТЕПЛОТЫ ПРИ 
В 1877 году немецкий инженер Н.А. Отто построил бензиновый двигатель, в котором был реализован термодинамический процесс, характеризующийся подводом теплоты при постоянном удельном объёме.
Исследование работы реального поршневого двигателя обычно производится с помощью индикаторной диаграммы, показывающей зависимость давления в цилиндре от величины его рабочего объёма при различных положениях поршня в течение полного цикла.
На рис. 1.3 изображена действительная индикаторная диаграмма четырехтактного двигателя с быстрым сгоранием рабочей смеси при v=const.
Рис. 1.3. Индикаторная диаграмма карбюраторного ДВС
Полный цикл работы реального ДВС с подводом теплоты при v=const складывается из следующих процессов:
0…1 — всасывание рабочей смеси (давление всасывания несколько ниже атмосферного из-за гидравлического сопротивления впускного клапана и всасывающего трубопровода);
1…2 — сжатие рабочей смеси (впускной и выпускной клапаны закрыты);
2…3 – горение рабочей смеси (горение рабочей смеси происходит столь быстро, что поршень практически не успевает переместиться и таким образом линия 2…3 приближается к изохоре, т.е. v≈const);
3…4 – расширение продуктов сгорания (сжатые газы расширяются и передвигают поршень, совершая механическую работу);
4…5 – выхлоп (открывается выпускной клапан и давление в цилиндре практически мгновенно падает до p5 , несколько превышающего pатм);
5…0 – нагнетание (при открытом выпускном клапане происходит выталкивание из цилиндра оставшихся отработавших газов).
С учетом допущений, позволяющих идеализировать термодинамический цикл, которые были изложены выше, идеальный термодинамический цикл ДВС с подводом теплоты при v=const представлен на рис. 1.4.
Рис. 1.4. Идеальный термодинамический цикл ДВС с подводом теплоты при v=const (цикл Отто)
Цикл состоит из следующих процессов:
1…2 – адиабатное сжатие рабочего тела;
2…3 – изохорный подвод количества теплоты q1 от горячего источника к рабочему телу (в реальном двигателе аналогом является процесс сгорания рабочей смеси);
3…4 – адиабатное расширение рабочего тела (в реальном двигателе аналогом является процесс расширения продуктов сгорания рабочей смеси);
4…1 – изохорный отвод количества теплоты q2 от рабочего тела к холодному источнику (в реальном двигателе аналогом является процесс выхлопа отработавших газов из цилиндра в атмосферу).
При известных параметрах состояния 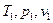
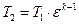
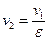
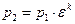

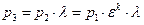

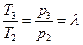
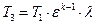

С учетом формулы (1.1.5) будем иметь:
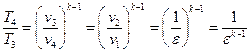
Учитывая (1.1.6), получим:
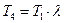
Удельное количество теплоты, подводимое к рабочему телу в цикле, определяется:
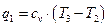
Удельное количество отводимой теплоты:

Термический КПД цикла Отто определяется следующим образом.
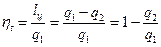
Подставляя в (1.1.11) соответствующие выражения для q1 и q2, получим
Учитывая формулы (1.1.1), (1.1.6) и (1.1.8), получим

Удельная полезная работа цикла определяется как разность удельных работ расширения и сжатия рабочего тела.
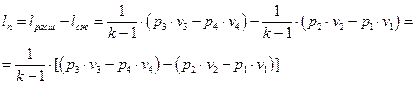
Выражение (1.1.12) показывает, что термический КПД цикла ДВС с внешним смесеобразованием целиком определяется значением достигаемой в цикле степени сжатия рабочей смеси. Чем выше степень сжатия, тем выше КПД. Однако, в карбюраторных ДВС степень сжатия относительно невелика и не превышает значений ε≈10. Это связано с тем, что при сжатии рабочей смеси вместе с повышением давления возрастает и её температура, что может приводить к преждевременному самовоспламенению рабочей смеси. Явление преждевременного самовоспламенения рабочей смеси в цилиндре ДВС называется детонацией. Детонация является вредным явлением, т.к. нарушает фазы газораспределения по цилиндрам ДВС и приводит к его преждевременному износу. Опасность детонации ограничивает возможности повышения термического КПД циклов ДВС с внешним смесеобразованием.
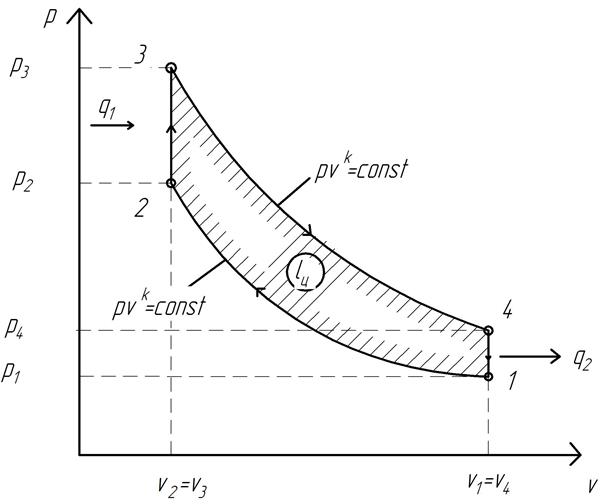
1.2. ЦИКЛ ДВС С ПОДВОДОМ ТЕПЛОТЫ ПРИ p=const (ЦИКЛ ДИЗЕЛЯ)
Стремление повысить термический КПД ДВС за счет достижения более высокой степени сжатия привело к созданию в 1897 г. немецким инженером Рудольфом Дизелем двигателя новой конструкции. Этот двигатель был основан на следующем принципе. В цилиндре ДВС на начальной стадии цикла сжимается не рабочая смесь, а чистый воздух, что позволяет достичь значений степени сжатия ε≈40…50. В конце процесса сжатия в цилиндр через форсунку под давлением впрыскивается жидкое топливо, которое распыляется и смешивается с раскаленным воздухом.
Таким образом, рабочая смесь создаётся не во внешнем устройстве (карбюраторе), а внутри самого цилиндра ДВС, из-за чего такие двигатели относятся к ДВС с внутренним смесеобразованием. Рабочая смесь самовоспламеняется от высокой температуры сжатого воздуха. Топливо в цилиндр ДВС подаётся постепенно, что обусловливает его относительно медленное, а не мгновенное сгорание. При этом давление в цилиндре остаётся постоянным, т.к. процесс горения сопровождается движением поршня, т.е. повышение давления компенсируется увеличением рабочего объёма цилиндра.
По этой причине в идеализированном цикле процесс подвода теплоты принимается изобарным (p=const).
Двигатели, работающие по циклу Дизеля, имеют ряд преимуществ перед двигателями, основанными на цикле Отто:
-более высокий термический КПД цикла;
— отсутствие запального устройства (свечи зажигания);
-возможность использования более дешевого низкосортного топлива.
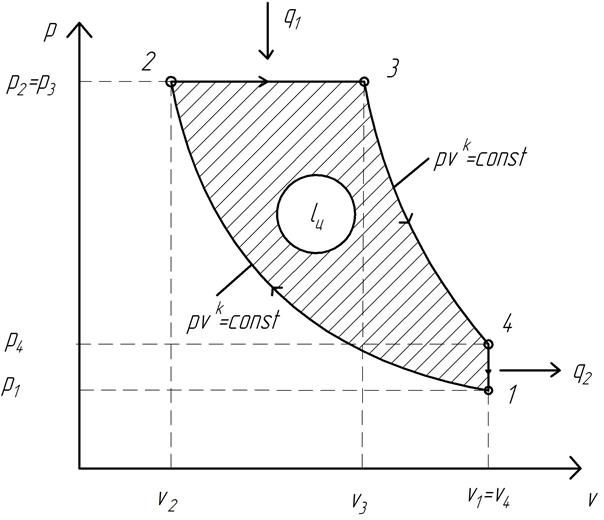
На рис. 1.5 изображен идеальный термодинамический цикл с изобарным подводом теплоты.
Рис. 1.5. Идеальный термодинамический цикл ДВС с подводом теплоты при p=const (цикл Дизеля)
Цикл Дизеля образован следующими процессами.
1…2 – адиабатное сжатие рабочего тела (воздух);
2…3 – изобарный подвод количества теплоты q1 от горячего источника к рабочему телу (сгорание топлива при p=const);
3…4 – адиабатное расширение рабочего тела (продукты сгорания топлива);
4…1 – изохорный отвод количества теплоты q2 от рабочего тела к холодному источнику (выхлоп отработавших газов в атмосферу).
Если известны степень сжатия ε, степень предварительного расширения ρ и начальные параметры рабочего тела 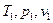
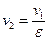
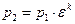
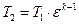

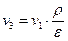
Т.к. 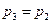
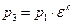
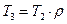


Учитывая формулу (1.2.2), а также, что 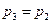


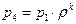
Т.к. 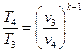
Подставляя вместо T3 выражение (1.2.6), получаем
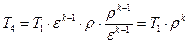
Удельное количество теплоты q1, подводимое к рабочему телу в цикле, определяется:

Удельное количество отводимой теплоты:
Термический КПД цикла Дизеля определяется следующим образом.
Учитывая, что отношение 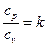

С учетом ранее полученных выражений для T2, T3, T4
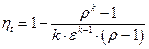
Удельная полезная работа цикла определяется как разность удельных работ расширения и сжатия рабочего тела.

1.3. ЦИКЛ ДВС СО СМЕШАННЫМ ПОДВОДОМ ТЕПЛОТЫ ПРИ v=const, p=const (ЦИКЛ ТРИНКЛЕРА)
Как видно из формулы (1.2.12), резервы повышения КПД двигателя Дизеля состоят в дальнейшем повышении степени сжатия ε. Для этого в двигателе Дизеля необходимо было использовать предварительное сжатие воздуха в специальном компрессоре, который по массе и габаритам являлся соизмеримым с самим двигателе. Это существенно утяжеляло и удорожало двигательную установку.
Необходимость повышения термического КПД цикла и упрощения конструкции двигателя привели к созданию в 1904 г. бескомпрессорного двигателя. Автором конструкции был юный российский инженер Густав Васильевич Тринклер. Его двигатель получил широкое распространение во всем мире. Отличительной чертой конструкции двигателя Тринклера является наличие специальной форкамеры 1 (см. рис. 1.6), которая соединяется узким каналом с цилиндром 2 ДВС.
Рис. 1.6. Принципиальная схема двигателя Тринклера
Воздух адиабатно сжимается в цилиндре до давления, соответствующего температуре, которая выше температуры самовоспламенения жидкого топлива. Топливо, распыляемое в форкамере форсунками 3, подаётся плунжерным насосом под высоким давлением. Наиболее лёгкая фракция топлива практически мгновенно (при v=const) сгорает в форкамере. При этом к системе подводится теплота q’1. Возникшим высоким давлением оставшаяся большая часть несгоревшего топлива и воздуха выталкивается из форкамеры в цилиндр и догорает в нем при движущемся поршне 4, как в обычном дизельном двигателе при p=const, но уже при существенно более высокой степени сжатия, чем в двигателе Дизеля.
Таким образом, процесс механического сжатия воздуха в компрессоре заменяется процессом сжатия в форкамере за счет тепловой энергии, выделяющейся при сгорании части топлива в форкамере. При горении топлива в основном цилиндре к рабочему телу подводится количество теплоты q»1. Дальнейшие процессы цикла происходят также , как и в других циклах ДВС.
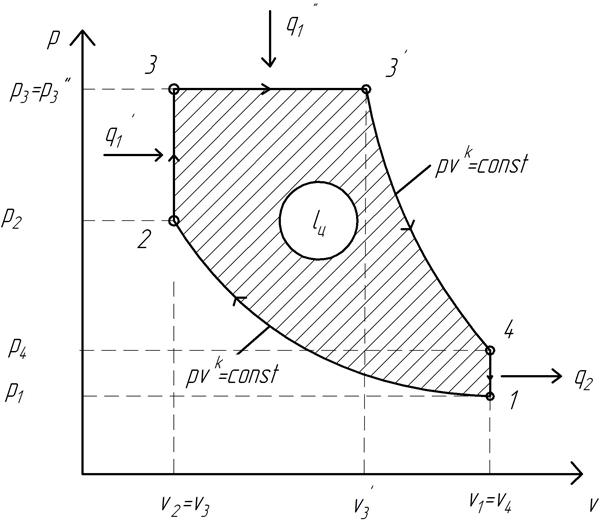
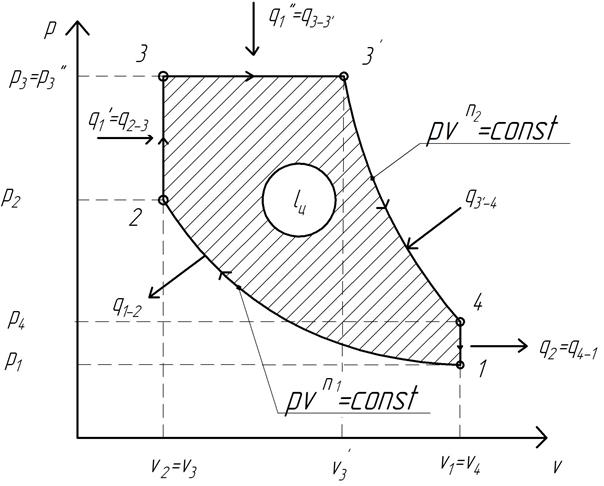
Идеальный цикл Тринклера представлен на рис. 1.7.
Рис. 1.7. Идеальный термодинамический цикл ДВС со смешанным подводом теплоты (цикл Тринклера)
Основными процессами, образующими цикл, являются:
1…2 – адиабатное сжатие рабочего тела;
2…3 – изохорный подвод теплоты к рабочему телу (сгорание части топлива в форкамере);
3…3′ — изобарный подвод теплоты к рабочему телу (догорание оставшейся части топлива в цилиндре ДВС);
3’…4 – адиабатное расширение рабочего тела;
4…1 – изохорный отвод теплоты от рабочего тела (выхлоп продуктов сгорания).
Основные параметры состояния рабочего тела в характерных точках цикла через известные его начальные параметры определяются следующим образом.
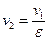
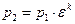
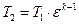

Учитывая (1.3.2), получим

Учитывая (1.3.3)
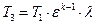
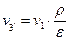
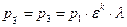
Учитывая формулу (1.3.6), получим
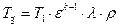
Учитывая формулы (1.3.8), (1.3.7) и, заменяя v4 на v1, получим
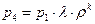
Учитывая, что 
Учитывая выражение (1.3.9), получим
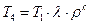
Удельное количество теплоты, подводимой к рабочему телу, определяется как сумма количества теплоты q’1, подводимой в изохорном процессе (v=const) и количества теплоты q»1, подводимой в изобарном процессе (p=const).
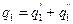


Удельное количество теплоты, отводимой от рабочего тела:

Термический КПД цикла со смешанным подводом теплоты
Учитывая, что 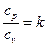
После преобразований получим
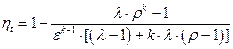
Удельная полезная работа цикла определяется как разность удельных работ расширения и сжатия рабочего тела.
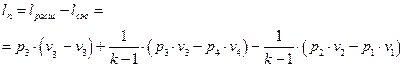
В реальных циклах ДВС процессы сжатия и расширения рабочего тела являются политропными. В этом случае расчет параметров состояния в характерных точках цикла следует выполнять по уравнениям каждого из процессов цикла последовательно от точки к точке, опираясь при определении параметров состояния в конце процесса на значения параметров состояния в начале процесса.
Рассмотрим пример расчёта цикла ДВС со смешанным подводом теплоты и политропными процессами сжатия и расширения рабочего тела.
2. ПРИМЕР РАСЧЁТА ЦИКЛА ДВС СО СМЕШАННЫМ ПОДВОДОМ ТЕПЛОТЫ (ЦИКЛ ТРИНКЛЕРА)
Дано:
Рабочее тело – воздух
Газовая постоянная воздуха
Изохорная теплоёмкость воздуха
Изобарная теплоёмкость воздуха
Начальные параметры рабочего тела:
Показатель политропы сжатия
Показатель политропы расширения
Степень сжатия
Степень изохорного повышения давления
Степень предварительного изобарного расширения
Определить:
1. Параметры состояния p, v, T в характерных точках цикла (рис. 2.1).
2. Энергетические характеристики каждого процесса цикла:
-удельное количество теплоты q,
-удельную работу процесса l,
-изменение удельной внутренней энергии ∆u,
-изменение удельной энтальпии ∆h,
-изменение удельной энтропии ∆s.
3. Удельную работу цикла lц.
4. Термический КПД цикла 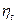
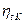

Рис. 2.1. Цикл ДВС со смешанным подводом теплоты
Расчет параметров состояния в характерных точках цикла
Из уравнения состояния идеального газа 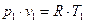
Параметры состояния в термодинамике и первый закон термодинамики (стр. 1 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 7 8 |
Параметры состояния в термодинамике
и первый закон термодинамики.
1. Определение понятий.
1.1. Расчеты и их точность.
1.1.1. Физическая величина – категория мышления, характеризуется отвлеченным числом и наименованием. Отвлеченное число определяет количество, наименование – качество. И эти два понятия (количество и качество) для физической величины нераздельны.
Чтобы какая-то величина, характеристика стала физической, необходимо и достаточно, чтобы существовал способ ее измерения (сравнения с эталоном) или метод ее расчета.
Наименование физической величины еще называют размерностью. У физических величин 20С, 2 км, 2 рубля – количество одинаково, а качество, физический смысл этого количества совсем разный.
1.1.2. Операции над физическими величинами.
Математики совершенно не задумываются о смысле, о качестве величин, над которыми они совершают свои действия, процедуры. Физик же должен быть предельно осторожен. Действительно, что такое 23км? Это 8 чего? Каково качество, наименование у числа 8? Наконец, 23км = 23000м справедливо ли? Для математика – нет, а для физика? Далее, 2м +20С = 4 чего?
Эти простые примеры показывают, что целый ряд операций над физическими величинами недопустимы в силу неопределенности наименования (качества), размерности результата.
Разрешается проводить операцию алгебраического сложения только для одноименных (одинаковой размерности) слагаемых. В частности, все члены любого уравнения должны иметь одну и туже размерность.
Разрешается возводить в степень, умножать и делить физические величины разного наименования. При этом эти операции совершаются и над отвлеченным числом (как делают математики), и над наименованием. Например, 60С : 2м/сек = 3 0С*сек*м-1.
Следствие. Размерность любых физических величин всегда представляет собой произведение степеней размерностей основных величин в данной системе размерностей. В системе СИ, а только в ней по закону РФ мы и должны работать, основными величинами являются: м (метр), кг (килограмм массы), с (секунда), К (градус Кельвина), а (ампер), св (свеча).
1.1.3. Точность расчетов.
Расчетная формула для определения какой-то физической величины представляет собой последовательность математических операций над исходными физическими величинами: сделай сначала это, потом то и …. т. д.
Точность результата расчета измеряется погрешностью, абсолютной и относительной.
Абсолютной погрешностью определения (т. е. расчета или измерения в опыте) величины Х называется
ΔХ = |Храсч — Хист|,
где величина Храсч – расчетное (измеренное) значение физической величины, Хист – истинное, как правило, не известное.
Относительной погрешностью δХ называется отношение
Из этих определений следует, что и абсолютная и относительная погрешность определения Храсч не зависит от порядка самой величины.
Культура грамотного расчета любой физической величины основана на следующей простой истине: погрешность результата расчета по любой расчетной формуле не меньше погрешности исходных величин в формуле. Иными словами, расчет по любой формуле не может увеличить точность результата по сравнению с точностью исходных данных. Если в составе исходных величин для расчета находятся величины разной погрешности (точности), то погрешность результата не лучше максимальной погрешности величин в исходных данных.
На практике стараются использовать такие исходные данные, относительная погрешность которых одинакова, и тогда относительная погрешность результата расчета по какой-то формуле не меньше погрешности исходных величин.
В химической технологии стараются вести все расчеты с точностью 2% – 3% (относительная ошибка). И тогда, можно легко показать, в результате расчета следует указывать (записывать) число с тремя значащими цифрами, независимо от порядка величины. Например, 2,84; 0,0284 = 2,84 * 10-2; 28400 = 2,84 * 104 – и это все величины, имеющие одинаковую относительную погрешность (2% — 3%), причем цифра 2 – точная, цифра 8 – тоже точная, а цифра 4 определена не точно: там может быть любая цифра от 1 до 9. Следовательно, при использовании калькулятора при проведении расчетов не следует в результат списывать цифры из всех разрядов калькулятора, разумно сразу сначала округлять справа налево вплоть до третьей цифры слева. Например, калькулятор высветил результат 2,843687 * 10-2, записывать результат следует в виде 2,84 * 10-2, или следует записывать в виде 5,64 * 107.
1.2. Основные термодинамические понятия.
1.2.1. Термодинамическая система и внешняя среда.
Пусть рассматривается некоторая совокупность объектов (материальных тел). Заключим их в некоторую абстрактную (виртуальную) воображаемую или материальную границу (оболочку). И все, что находится внутри этой границы, назовем термодинамической системой. Выбор центрального для термодинамических расчетов объекта определяет сам исследователь, и он же решает, что собой представляет внешняя (окружающая) среда, с которой это центральное тело взаимодействует.
В технической термодинамике объектом исследования является рабочее тело (газ, жидкость или твердое) как единая макросистема какого-то вещества или смеси веществ. Взаимодействие термодинамической системы (рабочего тела) с внешней средой, по предположению, осуществляется только на границе. «Взаимодействие – вот главное, когда мы рассматриваем природу в целом» отметил философ и естествоиспытатель Ф. Энгельс.
1.2.2. Взаимодействием термодинамической системы с внешней средой называется акт энергообмена. Есть энергообмен в какой-то форме – значит есть взаимодействие. Иначе, взаимодействия нет. «Добродетельным можно быть самим по себе, а для порока нужны двое» отметил тот же Ф. Энгельс. В частности, если рабочее тело заключено в объем с неподвижными прочными стенками, то внешняя среда не может деформировать (сжимать или расширять) рабочее тело. Тогда в термодинамике говорят, что термодинамическая система деформационно изолирована от внешней среды. Если на границе термодинамической системы расположить толстый слой теплоизоляции, то система не может обмениваться теплотой с внешним миром. (Зимой люди одевают шубы и теплые пальто.) Тогда говорят, что рабочее тело теплоизолировано, а все процессы в нем называют адиабатическими. Аналогично, можно говорить о химическом взаимодействии (физхимия), о электрическом, магнитном, о соответствующей изоляции от внешней среды.
2. Параметры состояния в термодинамике.
2.1. Термин «параметр» — греч. Parametron – отмеривающий. Параметр состояния – физическая величина, т. е. количественная и качественная характеристика свойств или поведения термодинамической макросистемы (рабочего тела). На рассвете развития и становления термодинамики параметры состояния системы избирались на основе прямых измерений в опытах. В современной термодинамике параметры состояния обязательно соотносят с каким-то видом (родом) взаимодействия системы с внешней средой.
Человеческий опыт позволяет различать множество взаимодействий по их роду (типу, виду): деформационное изменение рабочего тела по геометрии объема, поверхности или длины рабочего тела, термическое (нагрев или охлаждение), химическое (молекулы в исходной смеси веществ химически взаимодействуют с образованием молекул новых веществ), электрическое (перемещение зарядов под действием внешнего электрического поля), магнитное (диполи, микро магниты, домены рабочего тела занимают новое положение в пространстве под действием внешнего магнитного поля).
Техническая термодинамика, будучи частью термодинамики вообще, занимается только деформационным и термическим взаимодействиями, происходящими с телами в целом в их массе и объеме (макросистемы).
2.2. Классификация и систематизация термодинамических параметров состояния.
В любой реальной системе при ее взаимодействии с внешней средой потенциалом называется такой параметр, разность значений которого в системе и внешней среде является первопричиной взаимодействия.
Иными словами, разность потенциалов – необходимое условие взаимодействия (и любого рода энергообмена или массообмена).
Необходимым условием деформации (изменения геометрии и формы рабочего тела) является разность давлений р внутри и вне системы, других причин для деформации объема просто нет. В гидравлике (текучие рабочие тела) эта же разность давлений является причиной движения жидких сред.
Необходимым условием термического взаимодействия системы с внешней средой является разность температур Т внутри и вне системы
Вообще, разность значений внешнего Ре и внутреннего Р потенциала можно назвать «движущей силой».
Итак, — р (минус) – потенциал деформационного взаимодействия. Причина появления минуса рассматривается далее.
Т – потенциал термического взаимодействия.
По определению, давлением р называется отношение силы воздействия к площади поверхности действия силы:
р = f / s, [f] = н (ньютон), [s] = м2. [p] = н/м2. [T] = К (Кельвин). (1.1)
2.2.2. Координата состояния.
Координатой состояния называется такой параметр состояния, который обязательно изменяется при данном роде взаимодействия.
Иными словами, изменение координаты состояния является достаточным условием взаимодействия (т. е. энергообмена или массообмена) системы с внешней средой.
Поиском конкретного вида таких параметров – координат занимается экспериментальная и теоретическая физика в ее различных разделах. Для механического деформационного взаимодействия координатой являются: длина – при линейном воздействии (растягивание пружины, например), площадь – при поверхностном воздействии (выдувании пузырей, например), объем – при воздействии на трехмерное тело, масса – при химическом взаимодействии двух или более веществ (убывание исходных веществ и увеличение количества продуктов реакции).
Для деформационного взаимодействия координатой состояния является геометрический объем V м3, поверхность S м2 или протяженность l м конкретного тела (вещества). Однако геометрические характеристики объема м3, поверхности м2 или длины м ничего кроме абсолютного значения (количества) не дают. Подобные количественные характеристики не могут относиться к параметрам состояния системы (поэтому называются экстенсивными величинами). Для рабочего тела в обобщенном виде параметром состояния, т. е. характеристикой последнего, служит удельное значение геометрической характеристики: удельного объема, т. е. геометрического объема, отнесенного к массе m кг рабочего тела, помещенного в объем V:
v = V / m, м3 / кг (1.2)
Заметим здесь же, что удельный объем вещества в термодинамической системе очень просто связан с плотностью ρ среды, которая почему-то более привычна студентам:
v ≡ 1 / ρ; ρ ≡ 1/ v кг/м3 (1.3)
Плотность вещества и его удельный объем просто обратно пропорциональны, т. е. vρ = 1.
Термическая координата состояния и ее экстенсивная величина носит название энтропия, обозначается буквой S, имеет размерность дж/К, а параметром состояния рассматривается удельное значение энтропии, относящееся к интенсивным величинам (характеристикам), оно обозначается буквой s:
s = S / m, дж / кг К (1.4)
Энтропия рабочего тела – такая же физическая величина, как хорошо знакомые давление, объем, температура. Энтропию также можно измерять в специальном эксперименте или рассчитывать по некоторой методике. Исторически энтропия была введена немецким термодинамиком Клаузиусом аналитическим анализом термодинамических взаимодействий.
Еще и еще раз подчеркнем: координата состояния данного рода взаимодействия никогда не изменяется, если отсутствует этот род взаимодействия.
3. Первый закон термодинамики – взаимные энергопревращения в термодинамических системах.
3.1. Количество воздействия.
Воздействием внешней среды на термодинамическую систему мы назвали акт обмена энергией между двумя объектами. Поэтому естественной мерой воздействия является количество энергии, которой обменивается система с внешней средой. Формальную запись количества воздействия термодинамика позаимствовала у теоретической механики. В аппарате последней, как и в теории поля, термин потенциал относится к энергии рабочего тела, а не к его параметру.
Элементарным количеством воздействия данного рода называется произведение потенциала на приращение сопряженной координаты.
│dKd│ = pdv, дж/кг, │dKT│ = Tds, дж/кг, (1.7)
где К – количество воздействия, индексы «d» и «Т» — соответственно деформационное и термическое воздействие, │ │- символика абсолютного значения величины.
Здесь уместно отметить об отличии направления действия сил и потенциалов. В теоретической механике, которая возникла исторически ранее термодинамики, знак «+» был принят для работы расширения системы (dv > 0). В термодинамике для потока теплоты q от системы во внешнюю среду принимается знак «-« (ds 0.
Это же правило устанавливается строго термодинамически. Для записи в одном уравнении количеств воздействия Кd и КТ обмена системы с окружающей средой следует лишь вспомнить качественную связь между направлением действия движущей силы и изменением координаты. Действительно, при силовых взаимодействиях Xe > X (dX > 0) координата убывает (dx Р (dP > 0) координата возрастает и количество внешнего воздействия должно входить в уравнение со знаком «+». Иными словами, формально потенциал это минус сила.
3.2. Внутренняя энергия.
Внутренней энергией термодинамической системы называется сумма всех видов энергии в системе.
В школьном курсе физики различают два вида энергии: кинетическая и потенциальная. Под кинетической энергией понимают энергию движения конечного количества массы макротела в геометрическом пространстве. При этом различают движение поступательное, как движение центра масс, движение вращательное вокруг какой-то оси и движение колебательное, как перемещение частей массы относительно друг друга.
Разумеется, внутренняя энергия возрастает или убывает за счет потоков через границу рабочего тела (за счет количеств внешних воздействий между системой и внешней средой). Именно подобные энергетические преобразования по существу между каким-то внешним телом и рабочим телом увеличивают или уменьшают внутреннюю энергию. В самом веществе рабочего тела происходят структурно-энергетические преобразования. Последние адекватны роду (виду) взаимодействия. Если это электрические импульсы (за счет разности электрических потенциалов ΔV), то в системе происходит движение зарядов. Если воздействие на рабочее тело тепловое, то интенсифицируется движение молекул (растет их кинетическая энергия) и т. д.
Однако, термодинамика не занимается таким детальным рассмотрением роли и влияния на вещество видов энергии – это задача физики и физической химии.
Обозначение внутренней энергии в термодинамике – U дж или u = U/m дж/кг.
3.3. Первый закон термодинамики.
На специфическом языке термодинамики это просто закон сохранения энергии в замкнутой системе: изменение внутренней энергии термодинамической системы равно сумме количеств внешних воздействий.
Аналитическая запись закона (основное уравнение термодинамики:
dU = ∑ δKi или dU = δQ – δW = T dS – p dV. (1.8)
для термодеформационной системы. В (1.8) приращение внутренней энергии dU записано через параметры состояния р, V,Т, S, т. е. через потенциалы и координаты двух видов взаимодействия. В интенсивной форме запись первого закона термодинамики имеет вид:
dq ≡ T ds, dw ≡ p dv и тогда du = dq – dw = Tds — pdv. (1.9)
Здесь dq = Tds – элементарное количество теплоты, подведенное (отведенное) к системе, т. е. это элементарное количество термического воздействия, dw = pdv – элементарное количество работы деформации (механической работы), т. е. элементарное количество деформационного воздействия.
Замечание. В уравнении первого закона (основного закона термодинамики) в правой части входят внешние воздействия, т. е. при потенциальных воздействиях Pedxe и силовых –Xedxe, т. е.
dU = ∑Pedxe — ∑Xedxe (1.9.1)
Если изучаются равновесные (квазистационарные) процессы, в которых нет отличия по величине сил (Х) и потенциалов в системе (Р) и окружающей среде (Ре), т. е. между ними бесконечно малая разница по величине, то все переменные основного уравнения термодинамики – функция U и аргументы P, X,x относятся к исследуемому рабочему телу. Действительно, из (1.9.1) при Pe – P = ΔP и Xe – X = ΔX получим
dU = ∑(P +ΔP)dx — ∑(X + ΔX)dx,
и при ΔР → о(ΔР) и ΔХ → о(ΔХ) окончательно с учетом равенства │dxe│ = │dx│получаем (1.8) и (1.9).
Окончательно, основное уравнение технической термодинамики, изучающей квазистатические (равновесные) процессы имеет вид:
du = Tds – pdv. (1.9.2.)
Подведем предварительные итоги. Выше представлены основные определения понятий термодинамики, их необходимо запомнить, чтобы говорить на языке термодинамики. Взаимосвязь понятий иллюстрирует схема на рис 1.
Схема последовательности ввода и взаимосвязей
понятий в термодинамике.
4. Уравнения состояния.
Уравнением состояния рабочего тела называется функциональная зависимость потенциала от всех координат состояния.
Следовательно, сколько родов взаимодействия термодинамической системы с внешней средой, столько потенциалов, столько координат состояния и столько уравнений состояния.
Для термодеформационной системы (т. е. для двух родов взаимодействия: термического и деформационного) уравнений состояния два, т. к. два потенциала в соответствии с (1.9.2):
p = f(s, v), T = φ(s, v). (1.10)
Конкретный вид функций f(s, v) и φ(s, v) предоставляют для термодинамики физики, которые для этого проводят специальные теоретические и экспериментальные исследования. Полученные соотношения параметров состояния системы четко отражают физические связи внутри рабочего тела (системы) – первичными сигналами изменения состояния являются координаты. Сами соотношения относятся к уравнениям состояния – это общий вид такого уравнения в термодинамике.
В силу исторических обстоятельств развития физики и термодинамики уравнение состояния идеального газа не содержит энтропию:
pv = RT (уравнение Клайперона – Менделеева), (1.11)
где R = 8314/μ. Здесь 8314 дж/кмольК – универсальная газовая постоянная, μ – молекулярный вес вещества рабочего тела, кг/кмоль. Это уравнение было получено из опытов с газами при невысоких давлениях и температурах. Разумеется, из (1.10) обе аналитические связи можно свести к одной F(p, v,T) = 0, которая не противоречит экспериментальному (1.11). Этим не исчерпывается роль термодинамики в решении проблемы уравнений состояния. Она накладывает существенные ограничения на функциональный вид этих функций. Эти функции могут быть не любыми, а обязательно удовлетворять условиям:
(∂f/∂v)s ≡ (∂(-p)/∂v)s ≥ 0 и (∂φ/∂s)v ≡ (∂T/∂s)v ≥ 0 (1.12)
В этой записи, а мы будем ею широко пользоваться в дальнейшем, индекс внизу справа у скобки с частной производной означает, что соответствующий параметр состояния фиксирован.
Эти неравенства обычно называют критерием стабильности термодинамики, в химии – это формальная запись принципа ле Шателье – Брауна, хорошо знакомого студентам химико-технологического профиля образования.
Происхождение критерия стабильности термодинамики – эмпирический факт. Многочисленные наблюдения за различными термодинамическими системами показывают, что с ростом координаты состояния какого-то рода взаимодействия (и отсутствия других видов) соответствующий потенциал самопроизвольно не убывает (т. е. растет или неизменен). Обратно, с увеличением потенциала сопряженная координата состояния самопроизвольно также не убывает (т. е. растет или неизменна)
Для теплоизолированной системы (s = const) c увеличением удельного объема, согласно критерию стабильности, давление в системе только уменьшается, но это и очевидно. Для деформационно изолированной системы (v = const) с увеличением энтропии температура газа обязательно увеличится, и обратно, с увеличением температуры энтропия только увеличится. Действительно, если закрытый газовый баллон с каким-то газом положить в костер, то температура газа обязательно увеличится в согласии с критерием стабильности. Вот такие и многие другие экспериментальные факты термодинамика «присвоила» себе.
4. Размерности, измерение и расчет параметров состояния.
Измерение или расчет каких-либо характеристик рабочего тела относятся к количественной оценке величины этих характеристик по сравнению с эталоном самой величины. Подобные эталоны приняты в международной практике при введении стандартов на сами характеристики и их эталоны. В настоящее время действует, как обязательный, международный стандарт (SI) или Российский (СИ), утвержденный в 1980 году как обязательный для всех отраслей науки и техники. Основных единиц в этом стандарте – 6 и это: длина – метр, масса – килограмм, термодинамическая температура – градус Кельвина, сила тока – ампер, сила света – свеча, время – секунда. Все они используются в различных разделах термодинамики. В производные единицы включены термодинамические величины: сила – ньютон (Н), давление – (Н/м2), работа и количество теплоты – джоуль (дж).
Из курса физики известно, что производные величины представляют результат взаимодействия двух или более физических объектов в пространстве или во времени. Характеристика и размерность производных величин отличаются от таких же для исходных взаимодействующих объектов, а размерность первых определяется по уравнениям законов связи вторых. Так работа – это произведение действующей силы на путь, т. е. производная величина определяется по уравнению W = X*x, в котором сила Х выражается в избранной системе единиц. Но вне зависимости от системы единиц понятие силы едино согласно второму закону Ньютона – это произведение массы тела на ускорение его Х = mа. Тогда для обязательной в употреблении системе СИ получим [X] = 1 кг*1 м/с2 = 1кг м/с2 и эта сила называется Ньютон, т. е. 1 Н = кг м/с2.
В технической системе единиц, встречающейся в учебниках и старых проектах производств, принята иная единица силы – кГ – килограмм силы, полученная из того же уравнения второго закона Ньютона для массы 1 кг и ускорения силы тяжести g = 9,81 м/с2 (точнее 9,80665). Очевидна связь между этими двумя единицами силы: 1 кГ = 9,81 Н. Соответственно работа в технической системе единиц вычисляется по величине (количеству) в кГм, а в системе СИ в Нм, названной джоулем (дж). Размерность последней величины кгм2с-2 и она же используется для расчетов количества теплоты Q, которая в технической системе единиц имеет единицу – Ккал или кал. Согласно закону эквивалентности 427 кГм работы эквивалентны 1 Ккал, т. е. 1 ккал = 4,19 кдж.
Размерность давления по определению – сила, отнесенная к единице поверхности действия силы: н/м2 = кг/мс2. Единица давления н/м2 = П названа паскаль. Но, оказалось, в технике используются много большие давления, чем паскали. Поэтому введена величина 1 бар = 105 П, которая удобно соответствует технической единице – одной технической атмосфере, равной 104 кГ/м2 или 0,981*105 П.
Прямые измерения абсолютного давления, как параметра состояния рабочего тела, невозможны чисто технически. Косвенные измерения всегда связаны с применением приборов, замеряющих разность давлений, – манометров. В производственных условиях применяются механические или тензометрические манометры, а при давлениях в аппаратах ниже атмосферного или немного выше его используются жидкостные манометры, чаще всего так называемые U-образные дифманометры. Они представляют собой две вертикальные параллельные стеклянные трубки, соединенные внизу перемычкой, коленом из самой трубки. В таком приборе вес столба жидкости h выравнивается разностью давлений Δр внутри аппарата и в атмосфере (рис.2). В аналитической форме:
где ρ – плотность жидкости, залитой в U-образный манометр, кг/м3, g = 9,81 м/с2 – ускорение свободного падения, h – разность столбов жидкости в коленах U-образного манометра. Легко видеть, что
где В – барометрическое давление. В этом уравнении все величины, естественно, приведены к одной размерности. Заметим, что величина В – давление в атмосфере по отношению к глубокому (космическому) вакууму.
При наличии в аппарате среды под разряжением (под вакуумом) столб жидкости в U-образном манометре вместе с остаточным давлением газа в аппарате будут уравновешены атмосферным давлением:
т. е. само абсолютное давление будет рассчитываться по прежним переменным
Рис. 2. Иллюстрация к измерению давления.
Здесь р – давление в сосуде, h — разность столбов жидкости
в U-образном манометре.
В сечении а – а давления в трубках справа и слева уравновешены.
Подчеркнем еще раз – параметром состояния является лишь абсолютное давление, которое отсчитывается от безуслов0ного нуля, т. е. природного абсолютного начала отсчета (космосе). В земных (технических) условиях договорились об абсолютной шкале давлений согласно закону Шарля:
р = р0(1 + βТ) или Δр/р0 = βТ.
Здесь из опытов получено для идеальных газов β = 1/273.
Температурная шкала создается следующим образом. Для любого идеального газа выполняется уравнение состояния в виде:
где F(..) – универсальная функция температуры. Опыт показывает, что эта функция линейно растет с ростом температуры:
где α и β – константы. Тогда для температуры плавления льда и температуры кипения воды (при давлении 105 Па) в градусах Цельсия запишем:
0 = α(pV)0 + β, 100 = α(pV)100 + β. (4.2)
Система уравнений (4.2) относительно α и β легко решается, и это решение подставим в (4.1). Получим:
θ = 1000C * (pV –(pV)0)/((pV)100 – (pV
Из опыта известно, что для идеального газа
(pV)100 / (pV)0 = 1,366.
Подставляя это соотношение в (4.3), получаем
pV = (pV)0 (1 + 0,00366θ).
Здесь величина θ есть «идеально-газовая температура». Величина pV, равная универсальной функции температуры, станет равной 0, если θ = θ0 = -1/0,00366 = -273,150С. Если перенести начало отсчета температуры θ из 00С в точку θ0, то получим
Т(К) = θ – θ0 = (θ + 273,15) К.
Так получается шкала термодинамической (абсолютной) температуры Т в кельвинах, зная эмпирическую шкалу температуры Цельсия. Часто вместо θ используют обозначение t, одновременно для практических расчетов пренебрегают величиной 0,15 на фоне 273. Таким образом
Где температура Т в кельвинах, а температура t в Цельсиях.
В англо-язычной научно-технической литературе часто встречается понятие температуры по шкале Фаренгейта. Связь этой шкалы со шкалой Цельсия следующая:
t0F = 9/5 (t0C + 32) или t0C = 5/9 (t0F – 32).
5. Статистическая физика и параметры состояния в термодинамике.
Параметры состояния в термодинамике являются макрохарактеристиками системы, т. е. они определяют свойства и поведение системы в целом, а не свойства и поведение ее частей, не внутренних составляющих системы. Термодинамика занимается только макросистемами.
В предыдущей главе по существу изложена аксиоматика термодинамики, ее базис, фундамент. Так, собственно, поступали Евклид, Лобачевский, Риман, создавая свои «математики». Однако, для свободного и глубокого владения методом термодинамического анализа необходим широкий спектр физических представлений, образов, ассоциаций, связанных с основными понятиями термодинамики.
Как же представляет себе статистическая физика параметры состояния в термодинамике? По существу сказать: «Параметры состояния – это макрохарактеристика объекта», сказать: «Термодинамика занимается макросистемами» — означает, на языке теории вероятностей и статистики, что параметры состояния в термодинамике являются просто средними величинами, математическим ожиданием некоторых случайных величин.
Удельный объем v м3/кг.
Рассмотрим некоторый фиксированный геометрический объем V, м3 какого-то газа с границей Г. Пусть этот объем находится в том же газе, а стенки границы Г абсолютно проницаемы для молекул газа (см. рис. 3).
Рис. 3. Иллюстрация к понятию удельного объема.
Молекулы совершают случайное, хаотическое блуждание, какие-то из них войдут в объем V через границу Г, а какие-то выйдут из объема. Следовательно, число молекул в объеме V является случайной величиной с каким-то математическим ожиданием, т. е. средним значением. Если это среднее значение умножить на массу молекулы и произведение разделить на V, то и получим, по определению, величину плотности ρ. И в соответствии с (1.3) далее получаем величину удельного объема v. Отметим важное обстоятельство: чем больше число молекул газа в V, тем точнее находится оценка среднего значения числа молекул в V. Именно в этом смысл макрорассмотрения: число молекул газа должно быть очень большим. Что такое v или ρ, если в объеме V «бегает» одна – две молекулы – не знает никто.
Рассмотрим газ и непроницаемую стенку (рис. 4).
Рис. 4. Иллюстрация к понятию давления р.
Молекулы газа беспорядочно движутся в объеме около стенки. Скорость их движения случайна и по величине и по направлению. При подходе молекулы к стенке происходит удар: молекула деформирует стенку (сминает), далее стенка упруго локально отталкивает молекулу обратно, и весь этот процесс происходит за какое-то время Δτ секунд. Если до удара нормальную к стенке компоненту вектора скорости поступательного движения молекулы обозначить как W, то после удара ее скорость станет равной –W (минус). Это означает, что количество движения молекулы изменилось на величину -2 μW. (μ – масса молекулы). Но согласно второму закону Ньютона это означает, что на молекулу действовала сила F в течение времени Δτ:
Следовательно, каждая молекула, ударившись о стенку, оказывает на нее силовое воздействие F. И это воздействие случайно. Найдем среднее значение силы ударов молекул по стенке, усредняя по множеству этих молекул за время много большее Δτ, разделим на величину площади поверхности стенки и получим величину давления р.
Опять обращаем внимание, что чем больше будет ударов молекул р стенку, тем точнее, ближе к истине величина р. Что такое давление, если у стенки «бегает» одна молекула, не знает никто.
Забегая вперед, заметим, что, чем больше молекул находится у стенки (чем больше плотность газа ρ), тем естественно больше давление р. Одновременно, чем больше скорость W молекул (т. е. чем больше температура газа), тем тоже больше давление р. А от этих рассуждений уже и не далеко до вывода уравнения состояния идеального газа.
Температура Т, К.
Рассмотрим поступательное движение молекул вещества, их колебательное и вращательное движения. Каждому из них можно сопоставить количество кинетической энергии. Так как поведение молекул реального газа стохастично, случайно, то и количество кинетической энергии молекул вещества тоже случайно. Можно найти среднее значение этих энергий по множеству всех молекул и сопоставить это среднее значение с температурой. В частности, в статистической физике показывается, что при рассмотрении простейшего газа, молекулы которого представимы в виде материальных точек (нет вращения и колебаний) получается следующее. Оказывается, что среднее значение (математическое ожидание) кинетической энергии поступательного движения молекулы равно 3/2 kT, где k – константа Больцмана. Следовательно, термический потенциал в термодинамике Т можно понимать именно как среднюю кинетическую энергию поступательного движения молекул вещества.
И опять-таки никто не знает, что такое температура одной, двух молекул. Оценка среднего значения по одной двум молекулам такая «плохая», что ее нельзя считать физической величиной.
В теории плазмы физики вынуждены вводить в рассмотрение аж две температуры. Одна – для атомов без электронов, другая – для электронов: уж очень большая разница в скоростях и массах.
Если вещество находится в газовой фазе, то температура характеризует преимущественно кинетическую энергию поступательного движения молекул. Для жидкой и твердой фазы поступательное движение сильно затруднено из-за большой плотности. Для твердой фазы характерно колебательное движение атомов и молекул, для жидкой еще и вращение.
Рассматривая интерпретацию термодинамических параметров состояния с точки зрения статистической физики, можно увидеть, что эти параметры являются математическими ожиданиями некоторых случайных величин:
где Мх – среднее значение случайной величины х, f(x) – плотность распределения вероятностей этой случайной величины. В теории вероятностей все просто: f(x) — известна, значит надо взять интеграл и получить величину математического ожидания. Больцман поставил вопрос совсем иначе: сколько существует распределений молекул (т. е. функций f(…)) в пространстве координат и скоростей, чтобы получить одну и туже величину средних величин? Математик, не задумываясь, ответит – бесконечно много. Физик с ним согласится, что действительно много. Чтобы не работать с огромными числами, Больцман предложил работать с их логарифмами. Если общее число вариантов распределений молекул в пространстве координат и скоростей обозначить как W, то по Больцману
где k — константа Больцмана, s — энтропия.
Иллюстрацией может служить толпа людей, митингующих на площади, затем те же люди, идущие на демонстрации, наконец, те же люди как в армии построенные в колонну и марширующие по той же площади. Здесь видно, что хаоса, беспорядка все меньше и меньше, поэтому и энтропия все меньше. Зато средние значения каких-то случайных величин по множеству людей одни и те же.
Подведем итоги: статистическая физика рассматривает термодинамические параметры состояния как средние значения некоторых случайных величин, усредненных по огромному множеству молекул в геометрическом и скоростном пространстве. Энтропия – мера хаоса и беспорядка, мера числа разных распределений вероятностей, дающих одни и те же средние значения некоторых случайных величин.
http://lektsii.org/6-103689.html
http://pandia.ru/text/77/363/84998.php