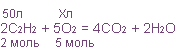Расчеты объемных отношений газов при химической реакции. Тепловой эффект
Расчет объемных cоотношений газов при химических реакциях
Прежде чем приступить к решению задач по данной теме, нужно вспомнить теоретический материал.
Одинаковые объемы различных газов при одинаковых условиях содержат одинаковое число молекул.
Следствие из закона Авогадро
При одинаковых условиях $1$ моль любого газа занимает одинаковый объем.
Объем газа количеством $1$ моль, измеренный при н. у., называют молярным объемом и обозначают $V_m$.
Следовательно: $n=
Молярный объем — это физическая величина, равная отношению объема вещества к количеству вещества.
На основании закона Авогадро можно определять молекулярные массы газообразных веществ по их плотности. Относительную плотность газа обозначают буквой $D$ (безразмерная величина).
Отношение массы определенного объема одного газа к массе такого же объема другого газа (при одинаковых условиях) называется плотностью первого газа по второму.
$D(H_2)=
Плотность по воздуху $D(\text»возд.»)=
Закон объемных соотношений
При одинаковых условиях объемы газов, вступающих в реакцию, относятся друг к другу, а также к объемам газообразных продуктов как небольшие целые числа.
Коэффициенты в уравнениях реакций показывают числа объемов реагирующих и образовавшихся газообразных веществ.
Например: $2$ объема водорода и $1$ объем кислорода дают $2$ объема водяного пара:
Молярный объем газообразных веществ выражается в л/моль: $V_m=22.4$ л/моль.
В расчетах следует учитывать, что объем:
- одного миллимоля (мМ) — $22.4 мл$;
- одного киломоля (кМ) — $22.4 м^3$;
- одного мегамоля (ММ) — $22 400 м^3$.
Задача 1. Найдите массу $33.6 м^3$ аммиака $NH_3$ при н. у.
Задача 2. Найдите массу и объем (н.у.), которые имеют $18·10^<20>$ молекул сероводорода $H_2S$. При решении задачи обратим внимание на число молекул $18·10^<20>$. Так как $10^<20>$ в $1000$ раз меньше $10^<23>$, расчеты следует вести с использованием ммоль, мл/моль и мг/моль.
Ответ: $m(H_2S)=102$мг; $V(H_2S)=67.2$мл
Задача 3. Вычислите плотность и относительные плотности оксида углерода (IV) по водороду и воздуху.
Ответ: $ρ(CO_2)=1.96$г/л, $D(H_2)=22, D(возд.)=1.52$
Задача 4. Вычислите объем кислорода для сжигания $5м^3$ метана ($CH_4$).
Решение. Отношение объемов реагирующих газов позволяет произвести расчеты, не вычисляя относительных молекулярных масс.
Ответ: для сжигания $5м^3$ метана требуется $10м^3$ кислорода.
Расчет теплового эффекта реакции
Реакции, протекающие с выделением теплоты, называются экзотермическими.
Если перед числом, выражающим теплоту реакции, стоит знак «+», значит, энергия выделяется.
Реакции, протекающие с поглощением теплоты, называются эндотермическими.
Если перед числом, выражающим теплоту реакции, стоит знак «-«, значит, энергия поглощается.
Теплоту реакции записывают обычно в конце уравнения, ее еще называют тепловым эффектом химической реакции и обозначают буквой $Q$ (Дж, кДж).
Химические уравнения, в которых указывается тепловой эффект, называются термохимическими.
$2H_2+O_2=2H_2O$ — эндотермическая реакция.
$S+O_2=SO_2+297$ кДж — экзотермическая реакция.
Для термохимического уравнения:
существует прямо пропорциональная зависимость между количеством исходного вещества $A-nA$ и количеством выделившейся или поглощенной теплоты $Q_1$:
Задача 1. Вычислите по термохимическому уравнению количество теплоты, выделившейся при сгорании $1$ кг угля: $C+O_2=CO_2+402.24$ кДж.
Данное термохимическое уравнение показывает, что при сгорании $1$ моль угля ($12$г) выделилось $402.24$ кДж. Можно составить пропорцию:
$12$г угля — $402.24$ кДж
$1000$г угля — $Q_1$
Ответ: $33 520$ кДж выделяется при сгорании $1$ кг угля.
Задача 2. При взаимодействии алюминия массой $9$ г с кислородом выделилось $274.44$ кДж теплоты. Составьте термохимическое уравнение реакции.
1. Определяем количество вещества алюминия, взятого для реакции:
2. Составляем уравнение реакции горения алюминия:
4. Термохимическое уравнение реакции имеет следующий вид:
Расчет по химическому уравнению объемных
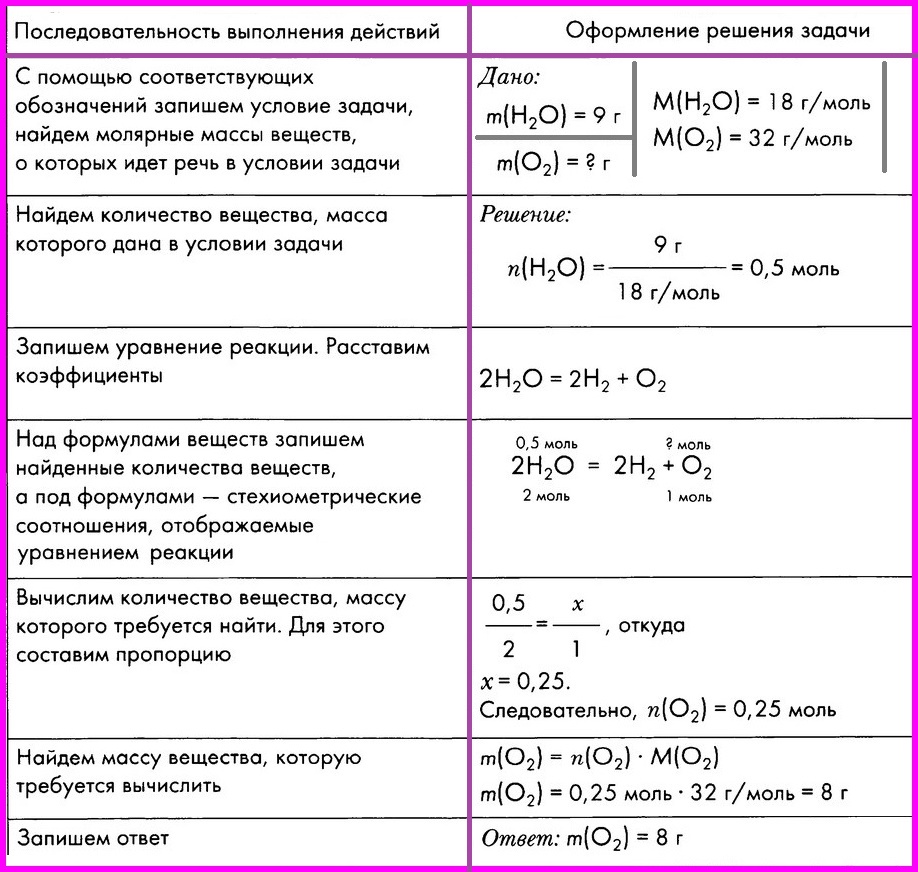
ЗАДАЧА: Вычислите массу кислорода, выделившегося в результате разложения порции воды массой 9 грамм.
Алгоритм № 2. Вычисление объема вещества по известной массе другого вещества, участвующего в реакции.
ЗАДАЧА: Вычислите объем кислорода (н.у.), выделившегося в результате разложения
порции воды массой 9 г.
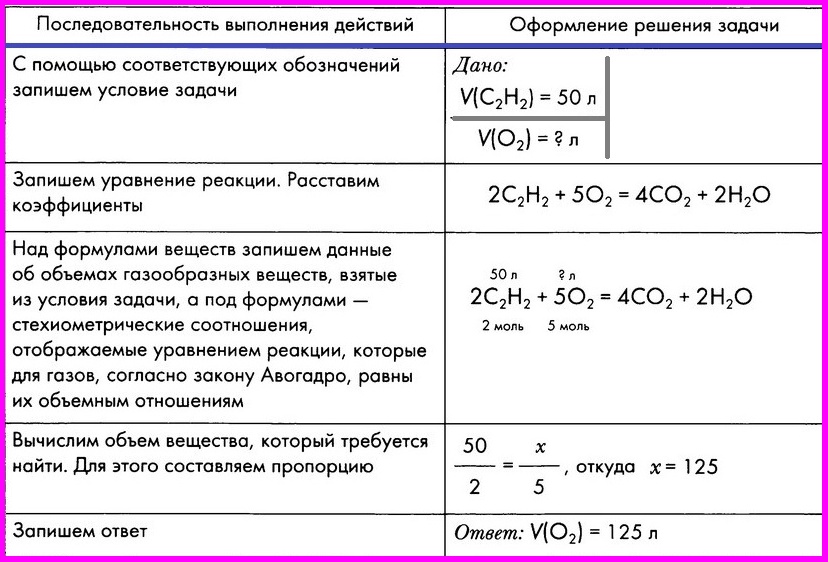
Алгоритм № 3. Расчет по химическому уравнению объемных отношений газов
ЗАДАЧА: Вычислите объем кислорода, необходимого для сжигания порции ацетилена объемом 50 л.
Алгоритм № 4. Вычисление относительной плотности газа по другому газу
ЗАДАЧА: Вычислите плотность кислорода а) по водороду; 6) по воздуху.
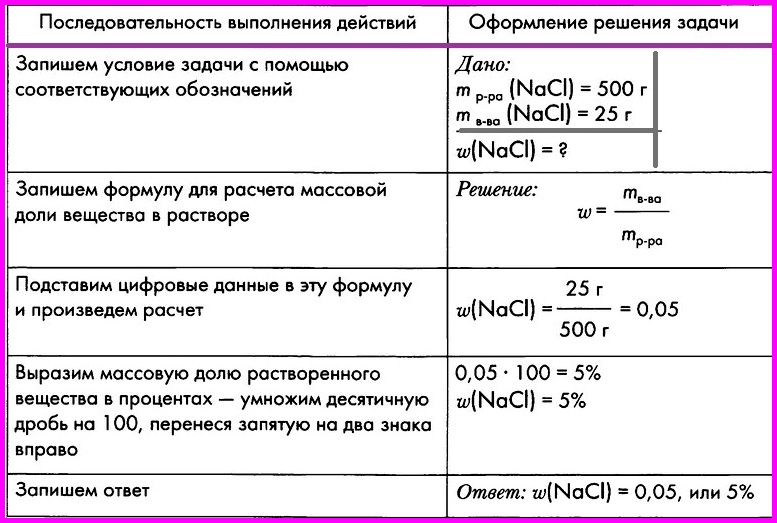
Алгоритм № 5. Вычисление массовой доли вещества в растворе
ЗАДАЧА: При выпаривании раствора массой 500 г образовалось 25 г кристаллической соли — хлорида натрия. Вычислите массовую долю соли в исходном растворе.
Алгоритм № 6. Вычисление массы вещества в растворе по массе раствора и массовой доле растворенного вещества.
ЗАДАЧА: Вычислите массу гидроксида натрия, необходимого для приготовления 400 г 20%-ного раствора гидроксида натрия.
Алгоритм № 7. Расчеты по термохимическим уравнениям. Вычисление количества теплоты по известной массе вещества.
ЗАДАЧА: По термохимическому уравнению 2Сu + O2 = 2СuO + 310 кДж вычислите количество теплоты, выделившейся в результате окисления порции меди массой 16 г.
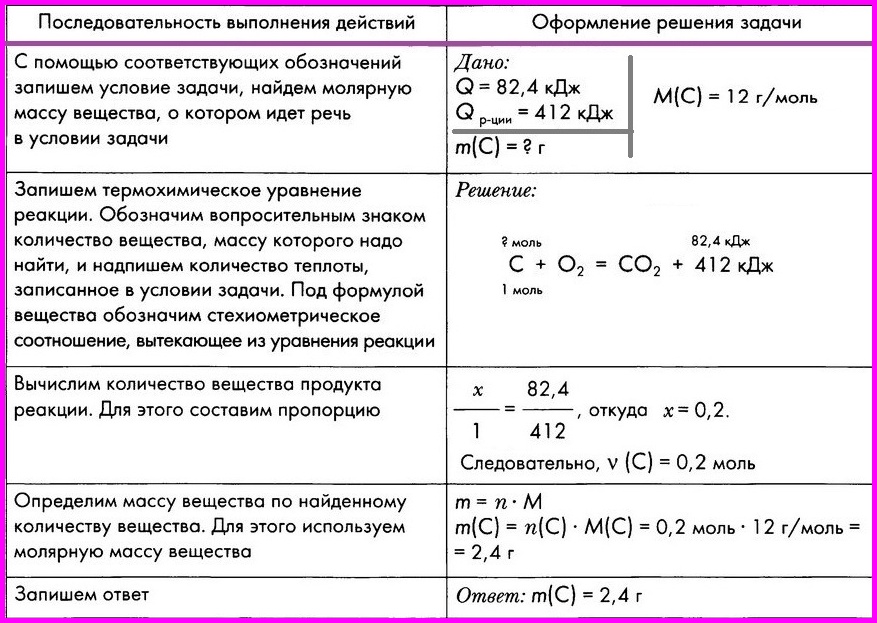
Алгоритм № 8. Расчеты по термохимическим уравнениям. Вычисление массы вещества по известному количеству теплоты.
ЗАДАЧА: По термохимическому уравнению С + O2 = СO2 + 412 кДж вычислите массу сгоревшего угля, если количество теплоты, выделившееся в результате реакции, составляет 82,4 кДж .
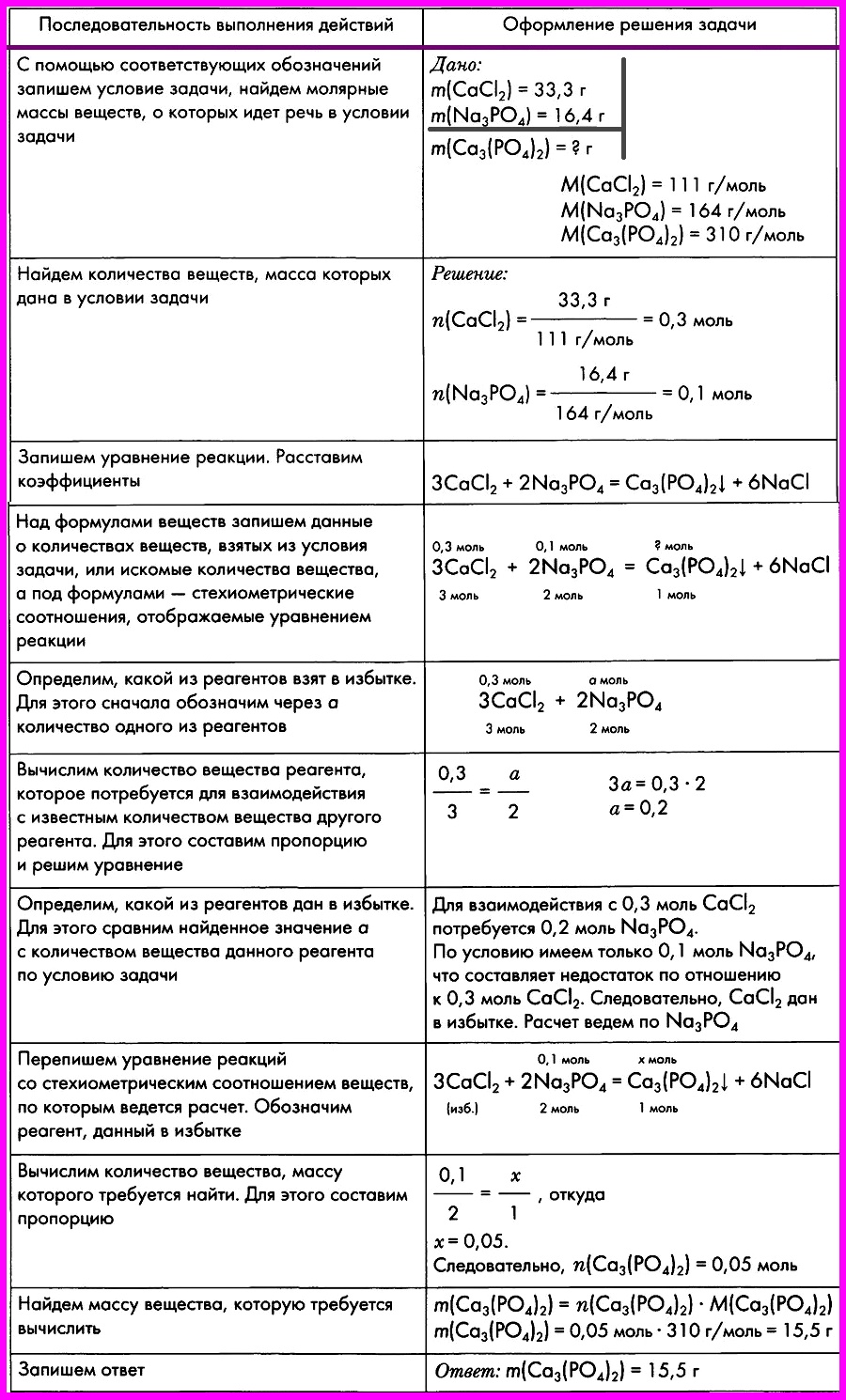
Алгоритм № 9. Расчеты по химическим уравнениям, если одно из реагирующих веществ дано в избытке.
ЗАДАЧА: Смешали два раствора, один из которых содержал 33,3 г хлорида кальция, а другой — 16,4 г фосфата натрия. Вычислите массу образовавшегося фосфата кальция.
Вы смотрели Справочник по химии «Алгоритмы решения типовых задач». Выберите дальнейшее действие:
Последовательность выполнения действий
1. С помощью соответствующих обозначений запишем условие задачи
2. Запишем уравнение реакции, расставим коэффициенты
3. Над формулами веществ запишем данные об объемах газообразных веществ, известные из условия задачи, а под формулами — стехиометрические соотношения, отображаемые уравнением реакции, которые для газов, согласно закону Авогадро, равны их объемным отношениям
50 / 2 = Х / 5, откуда
5. Запишем ответ
Примечание. Необходимо заметить, что ответ является правильным, если объемы газообразных веществ рассчитаны в одних и тех же условиях.
http://uchitel.pro/%D1%85%D0%B8%D0%BC%D0%B8%D1%8F-%D0%B0%D0%BB%D0%B3%D0%BE%D1%80%D0%B8%D1%82%D0%BC%D1%8B-%D1%80%D0%B5%D1%88%D0%B5%D0%BD%D0%B8%D1%8F-%D1%82%D0%B8%D0%BF%D0%BE%D0%B2%D1%8B%D1%85-%D0%B7%D0%B0%D0%B4%D0%B0/
http://examchemistry.com/content/lesson/primenenie/taskcourse/ratiogases.html