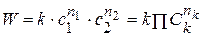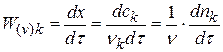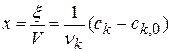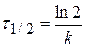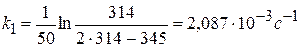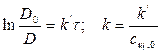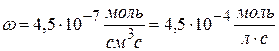Расчет порядка реакции по уравнению
Общий метод определения порядка реакции основан на законе действующих масс:
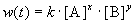
Представим, что вещество B находится в большом избытке, и его концентрация мало меняется в ходе реакции. Тогда порядок реакции по веществу A можно определить, измерив скорость реакции при двух концентрациях A. Записывая уравнение (3.1) для двух моментов времени в логарифмической форме и вычитая одно выражение из другого, найдем порядок x:
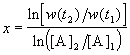
В случае, если имеется больше двух экспериментальных точек, можно записать кинетические данные в координатах lnw — ln[A] и представить их в линейном виде с помощью метода наименьших квадратов. Тогда порядок реакции x будет равен тангенсу угла наклона прямой.
Если реакция имеет целый порядок, то для определения порядка используют различные частные методы. Метод подстановки заключается в том, что кинетические данные представляют в виде
где функция f соответствует решению кинетического уравнения для одного из целых порядков. Если величина k, определенная таким образом, будет постоянной, то мы угадали, т.е. выбрали верный порядок. Если k будет изменяться со временем, то надо выбрать функцию f, соответствующую другому порядку.
Другой способ определения целого порядка заключается в измерении зависимости времени протекания реакции от начальной концентрации. Из решения (2.1) кинетического уравнения для реакции n-го порядка следует, что время t x, за которое степень превращения достигнет x, обратно пропорционально (n-1)-й степени начальной концентрации (см. также (2.2)):
Измеряя время превращения t x при двух начальных концентрациях, можно определить порядок n по формуле:
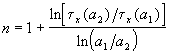
Отметим, что разные начальные концентрации можно выбирать на одной и той же кинетической кривой.
Пример 3-1. В некоторой реакции целого порядка nA 
Решение. Из первого опыта следует, что период полураспада вещества при начальной концентрации 1 моль/л равен 4 мин. Во втором опыте при начальной концентрации 2 моль/л период полураспада равен 1 мин (от 2 моль/л до 0.5 моль/л — за 5 мин, из них от 1 моль/л до 0.5 моль/л — 4 мин, следовательно на превращение от 2 моль/л до 1 моль/л потребовалась 1 мин).
Таким образом, при увеличении начальной концентрации в 2 раза период полураспада уменьшился в 4 = 2 n-1 раза, следовательно порядок реакции n = 3.
Пример 3-2. Кинетика реакции первого порядка, в которой происходило образование кислоты, изучалась путем отбора проб реакционной смеси и их титрования одним и тем же раствором щелочи. Объемы щелочи, которые пошли на титрование:
Время, мин
Объем, мл
Докажите, что реакция имеет первый порядок. Рассчитайте период полураспада.
Решение. Запишем решение кинетического уравнения для реакции первого порядка в виде:
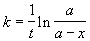
где a = x 
Время, мин
k, мин -1
0.0348
0.0347
В течение реакции величина k остается постоянной, что и доказывает первый порядок.
Период полураспада равен
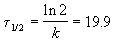
Пример 3-3. Реакция омыления метилацетата при 298 К описывается уравнением:
Для этой реакции получены следующие кинетические данные:
Время, мин
сNaOH, ммоль/л
Исходные концентрации щелочи и эфира одинаковы и равны 0.01 моль/л. Определите порядок реакции и константу скорости.
Решение. Запишем кинетические данные в координатах lnw-lnсNaOH, причем скорость реакции определим через конечные изменения концентраций и времени:
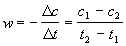
(Концентрацию вещества иногда обозначают не квадратными скобками, а буквой c). По этой приближенной формуле скорость лучше определять в середине временного интервала: t = (t1 + t2)/2. Концентрацию в этот момент времени определим как полусумму значений на границах интервала: c = (c1 + c2)/2. Сведем полученные данные в таблицу (учтем, что cNaOH = 10 ммоль/л при t = 0):
Тема 2: Реакции первого и второго порядка
НЕРАВНОВЕСНЫЕ ЯВЛЕНИЯ
В СЛОЖНЫХ ХИМИЧЕСИХ ПРОЦЕССАХ
Примеры решения задач
для студентов, обучающихся
по программе бакалавриата по направлению подготовки
240100 – Химическая технология
Тема 1: Кинетика химических реакций.
Реакции первого и второго порядка
Основные расчетные формулы:

Глубина протекания химической реакции
Плотность глубины реакции
Реакция I порядка, интегральное уравнение:

Реакция II порядка: А+В=С

Существует понятие суммарный порядок реакции n = ∑nk и частный порядок реакции по компоненту

Графическое или аналитическое определение Еа

Задача № 1
Термическое разложение в газовой фазе (Т = 849 К, V-const)
происходит как одностадийная реакция. Эта стадия является односторонней, мономолекулярной. Рассчитайте константу скорости прямой реакции по следующим данным:
| τ, с | ∞ |
| р, мм.рт.ст. (общее давление) |
Решение:
1) Для реакции I порядка справедливо интегральное уравнение

k должно быть постоянной.
2) Рассмотрим реакцию
| С2Н5СНО = С2Н6 + СО | |||
| τ = 0 | р0 | х=0 | х=0 |
| τ = τ | р0 – х | х | х |
Р0 – исходное давление С2Н5СНО. В любой момент времени общее давление пара равно


3)
Значение k внесем в таблицу:
| τ, с | ∞ | ||||
| k∙10 3 , с -1 | 2.08 | 1.67 | 1.59 | 1.60 | 1.59 |
4) Вычислим значение kср

Задача № 2
В реакции формальдегида с пероксидом водорода образуется муравьиная кислота (реакция II порядка, 
За время τ = 2 часа при 333,2 К 

Дано:
Реакция II порядка
Решение:
| НСНО + Н2О2 = НСООН + Н2О | ||||
| τ = 0 | с0 = 1 моль/л | с0 = 1 моль/л | 0 моль/л | 0 моль/л |
| τ1 = 2 часа | сτ1 = 0,215 моль/л | сτ1 = 0,215 моль/л | х моль/л | х моль/л |
| τ2 = ? | сτ2 = 0,1 моль/л | сτ2 = 0,1 моль/л | 0,9 моль/л | 0,9 моль/л |
| τ3 = ? | сτ3 = 0,01 моль/л | сτ3 = 0,01 моль/л | 0,09 моль/л | 0,09 моль/л |
Для реакции II порядка при с1,0=с2,0
1) 
2)
3)
Вывод: Если исходные компоненты разбавить в 10 раз, то для достижения той же глубины реакции нужно в 10 раз больше времени.
Задача № 3
Для реакции А→В к = 0,5. Вычислить степень превращения вещества А за время 1 час, если реакция идет по 0, 1 и 2 порядку и с0,1 = 1 моль/л . Определите, как зависит степень превращения вещества от порядка реакции.
Дано:
Решение:
1) Реакция 0 порядка:
2) Реакция 1 порядка:

3) Реакция II порядка

Сведем данные расчета в таблицу:
| Порядок реакции, n | |||
| Степень превращения, α | 0,5 | 0,394 | 0,333 |
Вывод: При одинаковом значении константы скорости реакции с увеличением порядка реакции уменьшается степень превращения вещества.
Задача № 4
Рассчитать константу скорости реакции кристаллического фиолетового со щелочью по следующим данным
| τ, с | ||||||
| D | 0,600 | 0,405 | 0,320 | 0,220 | 0,140 | 0,091 |
Щелочь берется в избытке: сщ,0 = 1,8 моль/л, скр,0 = 0,01 моль/л, t = 27 0 С.
Решение:
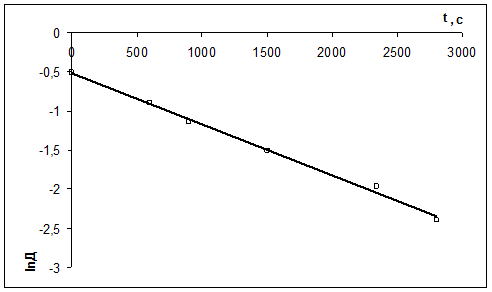
1) Реакция цветная, за концентрацией красителя можно судить по изменению D: D=ε с l

2) Рассчитать k можно графически или аналитическим расчетным способом. Строим график в координатах lnD = f(τ); k ’ = -a = −tgα
| τ, с | ||||||
| lnD | -0,511 | -0,903 | -1,139 | -1,514 | -1,966 | -2,397 |
2)
Задача № 5
Дана реакция 2 порядка А+В=С. Исходные концентрации с0,А = с0,В. За время 500 с реакция проходит на 20%. За какое время она пройдет на 60%?
Решение:
1) Интегральное уравнение реакции II порядка:

Ответ: за 3000 с реакция пройдет на 60%.
Тема 2: Реакции первого и второго порядка
Задача № 1
Рассчитайте k, если скорость реакции II порядка равна 4,5∙10 -7 моль/см 3 ∙с при концентрации одного компонента 1,5∙10 -2 моль/л и другого 2,5∙10 -3 моль/л.
Решение:
Ответ: k = 1,2 л/моль∙с
Задача № 2
Определите возраст мумии, если содержание изотопа углерода 14 С в ее тканях составляет 80% от его содержания в живом организме, а период полураспада 14 С равен 5600 лет. Реакция распада углерода относится к реакциям 1 порядка.
Дано:
Решение:
1) Допустим, что с0 = 1 моль/м 3 , тогда сτ = 0,8 моль/м 3 .
2) Рассчитываем возраст мумии:
Ответ: возраст мумии 1802 года.
Задача № 3
Реакция взаимодействия уксусного ангидрида с водой является реакцией первого порядка
Дано:
Решение:
1) Рассчитываем k:
2)
3)
4)
Вывод: ко времени полупревращения скорость реакции уменьшается в два раза по сравнению с начальным моментом.
Задача № 4
Превращение перекиси водорода в диэтиловый эфир протекает как реакция I порядка. При 333 К за время 10 мин превращение прошло на 75%. Вычислите константу скорости реакции.
Решение:
Допустим, что с0 = 1 моль/л, тогда сτ = с0 – х = 100-75,2 = 24,8%
Задача № 5
Фенилдиазохлорид разлагается по уравнению:
При 323 К и начальной концентрации 10 г/л были получены следующие результаты:
| τ, мин | ∞ | |||
| VN2, cм 3 | 19,3 | 32,6 | 50,4 | 58,3 |
Рассчитайте константу скорости реакции, постойте график VN2 = f(τ) и сделайте вывод о порядке реакции.
Решение:
В данной химической реакции за ходом процесса удобно следить по объему выделившегося газа. Реакция мономолекулярная, скорее всего, протекает согласно реакции I порядка. Кинетическое уравнение для реакции I порядка выглядит так:

Рассчитаем значение константы:
Значения констант скорости реакции имеет почти одинаковые значения, то это реакция I порядка и взятое нами уравнение удовлетворяет или описывает кинетику этого процесса.
Задача № 6
Найдите время, за которое реакция А→В с константой скорости 6,5∙10 -5 с -1 пройдет а) наполовину; б) на 98%.
Решение:
1) по единице измерения константы можно сказать, что данная реакция относится к реакции I порядка.
2) Кинетическое интегральное уравнение можно записать:
При τ = τ1/2 сτ = 0,5с0, если с0 = 1 моль/м 3 , то сτ = 0,5 моль/м 3 .
Примеры решения типовых задач. . Определение порядка реакций по кинетическим данным
Пример 1
. Определение порядка реакций по кинетическим данным
Определите порядок реакции
NH4CNO 
исходя из следующих данных:
Исходная концентрация, со моль/л 0,10 0,20 0,40
Период полупревращения, t 0,5 , час 19,15 9,45 4,62
Решение. Анализ приведенных данных показывает, что с увеличением исходной концентрации период полупревращения уменьшается, такой характер зависимости свойственен реакциям второго порядка.
Ответ: реакция второго порядка.
Пример 2
. Расчет скорости реакции по константе скорости и концентрации.
Константа скорости реакции Н2(г) + I2(г) 
В сосуд объемом 2 л ввели по 2 моль водорода и иода. Чему будет равна скорость реакции в тот момент, когда в реакционной смеси образуется 0,2 моль иодоводорода?
Решение. По условию задачи константа скорости реакции имеет единицы измерения [концентрация-1× время-1]. Следовательно, реакция образования газообразного иодоводорода из простых веществ является реакцией второго порядка.
Кинетическое уравнение скорости реакции второго порядка имеет вид:
| v = k × c(H2) × c(I2) |
Исходя из уравнения реакции, определим количество каждого реагента, необходимое для образования 0,2 моль иодоводорода.
Рассчитаем количество исходных реагентов, оставшееся к моменту времени, когда в реакционной смеси образуется 0,2 моль НI.
Рассчитаем скорость реакции:
v = 0,111 л/(моль·с)·0,95 2 моль 2 /л 2 = 0,1 моль/(л·с)
Ответ: 0,1 моль/(л·с).
Пример 3
Расчет периода превращения по кинетическому уравнению первого порядка.
Концентрация пестицида диурона в пробе воды с pH 7,0 была равна 0,07 ммоль/л. Через 2,5 месяца она стала вследствие протекающего гидролиза равна 0,05 ммоль/л. Вычислите период полупревращения реакции гидролиза диурона. Температура пробы поддерживалась постоянной (18 °С).
Решение. При решении задачи основным является уравнение для константы скорости химической реакции первого порядка, записанное в виде:
Вычислив значение k по уравнению, определим период полупревращения вещества по формуле (3.2):
Подставляя в выражение приведенные в условии задачи значения, вычислим:
k = ¾¾¾ ln ¾¾¾¾¾¾ = 0,135 мес-1.
2,5 мес 0,05 ммоль/л
Тогда из выражения :
Ответ: 5,1 месяцев.
Пример 4
Расчет времени, необходимого для достижения заданной концентрации и концентрации реагента в заданный момент времени по кинетическому уравнению первого порядка.
Для проведения исследований были взяты равные массы двух радионуклидов: 137 Cs и 95 Zr. Какая часть радионуклида 137 Cs останется к тому моменту, когда 99% радионуклида 95 Zr подвергнется распаду.
Решение. Для радионуклидов время, за которое в реакцию вступает половина исходного вещества, называется периодом полураспада(t0,5).При решении задачи воспользуемся уравнением для константы скорости химической реакции первого порядка, т.к. радиоактивный распад протекает по первому порядку:
Из уравнения (3.1) выразим:
где t0,5 — время, за которое распадается 99% радионуклида 95 Zr. Исходя из формулы, определим константу скорости химической реакции:
где t 0,5 — период полураспада 95 Zr (справочная величина, табл. 04.01)
Вычислим, какая часть радионуклида 137 Cs останется к тому моменту, когда 99% 95 Zr подвергнется распаду.
По справочным данным t 0,5 ( 95 Zr) = 64 сут.; t 0,5 ( 137 Cs) = 30,17 года (табл. 04.01)
k ( 95 Zr) = ¾¾¾ = 1,1·10 -2 сут -1
k ( 137 Cs) = ¾¾¾ = 0,023 года-1
Вычислим величину t, зная значение k ( 95 Zr) :
t = ¾¾¾¾ ln ¾¾¾ = 419 сут = 1,15 года
Применяя уравнение в экспоненциальной форме, находим:
¾¾¾¾¾ = e 0,023 года-1 ×115 года = 1,03
Ответ: останется 97 %.
Пример 5
Расчет по кинетическому уравнению первого порядка:
— времени, необходимого для достижения заданной концентрации;
— концентрации реагентов в заданный момент времени;
Константа скорости гидролиза сахарозы при 25 °С равна 3,2 ×10 -3 час-1.
а) время, за которое гидролизу подвергнется 10% исходного количества сахарозы;
б) какая часть сахарозы подвергнется гидролизу через 5 суток;
в) период полупревращения реакции.
Решение. Рассматриваемая реакция является реакцией первого порядка, т.к. константа имеет единицы измерения [время -1 ]. Обозначим исходную массу сахарозы mо, а конечную массу — mt. К моменту времени t подвергнется гидролизу 0,1m cахарозы.
Тогда к моменту времени t останется mt = m – 0,1m = 0,9m;
Для ответа на вопрос а) воспользуемся модифицированым уравнением:
Выразим и вычислим величину t из этого уравнения:
t = ¾¾ ln ¾¾ = ¾¾¾¾¾¾ ln ¾¾¾ = 32,9 ч.
k mt 3,2 × 10 -3 час -1 0,9m
Для ответа на вопрос б) преобразуем ln mо — ln mt = kt;
ln ¾¾¾ = 3,2 ×10 -3 час -1 × 120 час
т.е. за 5 суток в реакцию вступит m – 0,68m = 0,32m сахарозы, т.е. 32% от исходной массы сахарозы.
Период полупревращения (вопрос с) рассчитаем по :
k 3, 2 × 10 -3 час -1
Ответ: 32,9 час., 32 % сахарозы, 216 час.
Пример 6
Расчет времени и константы скорости при второй температуре с использованием энергии активации и кинетических параметров при первой температуре.
Разложение спазмолитина в растворе является реакцией первого порядка с энергией активации 75 кДж/моль. Период полупревращения при 20 °С равен 103 часам. Рассчитайте время, за которое разложится 25% спазмолитина при 37 °С.
Решение. Пусть t1 = 20 0 С, а t2 = 37 0 С, т.е. Т1= 293К и Т2 = 310 К.
Рассчитаем константу скорости k1 при Т1= 293К, воспользовавшись (3.2):
k1 = ¾¾ = ¾¾¾¾ = 6,70 × 10 -3 час -1
Для расчета константы скорости k2 при Т2 = 310 К воспользуемся уравнением Аррениуса для двух температур(3.5).
Сначала вычислим значение ln k2/ k1:
k2 75 кДж/моль × 17 К
k1 8,31× 10 -3 кДж/(моль×К) ×293К× 310 К
k2/ k1 = е 1,69 = 5,42 и k2 = 5,42 × 6,7 ×10 -3 = 3,63 ×10 -2 час -1
Рассчитаем время, за которое разложится 25% спазмолитина при 37 0 С:
t = ¾¾¾ × ln(100/75) = 7,93 час »8 час.
Пример 7
Расчет энергии активации по кинетическим данным при разных температурах.
Периоды полупревращения денатурации некоторого вируса равны: при 30 °С 5 час., при 37 °С — 1,76·10 -2 часа. Денатурация описывается кинетическим уравнением первого порядка. Вычислите энергию активации процесса.
Решение. Известно, что для реакций первого порядка значение константы k обратно пропорционально t0,5, поэтому уравнение Аррениуса для двух температур (3.5) можно представить следующим образом:
Преобразуем это выражение относительно Ea:
Подставим в это выражение известные по условию задачи величины:
8,31× 10 -3 кДж/(моль × К) × 303 К × 310 К 5 час
7К 1,76× 10 -2 час
Ответ: 630 кДж/моль.
Пример 8
. Расчет энергии активации по температурному коэффициенту скорости реакции.
Вычислить энергию активации гидролиза этилацетата в щелочном растворе (10 °С — 45 °С); 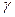
Решение. Зависимость константы скорости химической реакции от температуры выражается приближенным правилом Вант-Гоффа:
k2/k1= 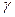
Представим уравнение Вант-Гоффа в логарифмической форме:
Выведем расчетную формулу для энергии активации, используя (3.3) и (3.5):
Подставив в полученное выражение известные по условию задачи значения, вычислим:
8,31Дж/(моль ×К) ×283 К ×318 К× ln1,9
Еа = ¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾ = 48001 Дж/моль 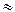
Ответ: 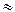
Пример 9
. Расчет температурного коэффициента скорости реакции по энергии активации
Вычислите температурный коэффициент скорости реакции. Разложения пероксида водорода (25 °С — 55 °С), Еа = 75,4 кДж/моль.
Решение: Температурный коэффициент рассчитаем по формуле, используя (3.3) и (3.6):
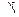
Подставляя известные по условию задачи значения в это уравнение , вычислим:
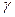
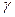
Анализ полученного ответа: Значение 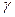
Пример 10
.Сравнение констант скорости каталитической и некаталитической реакции с использованием значений энергии активации.
Оцените, во сколько раз возрастет скорость реакции разложения угольной кислоты при 310 К, если в присутствии карбоангидразы Еа = 49 кДж/моль, а без катализатора Еа = 86 кДж/моль.
Решение. Для того, чтобы оценить эффективность работы катализатора, можно использовать выражение(3.6):
Ответим на поставленный вопрос, подставив известные по условия задачи величины:
k кат (86000 – 49000) Дж/моль
k без кат 8,31 Дж/(моль·К)·310 К
Ответ: Катализатор увеличивает константу скорости в 1,73×10 6 раз.
Пример 11
Расчет периода полупревращения по кинетическим данным при разных температурах.
Период полупревращения некоторой реакции первого порядка равен 15,4 час при 298 К. Как изменится период полупревращения при введении катализатора, снижающего энергию активации на 15000 Дж/моль?
Решение. При введении катализатора в реакционную смесь значение константы скорости увеличивается, а значение периода полупревращения уменьшается. Выразим отношение каталитической и некаталитической реакции:
Преобразуем данное уравнение с учетом (3.6):
k кат/ k без кат = 15,4 час: 0,036 час = 427,7 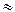
Ответ: введение катализатора снижает период полупревращения реакции в 428 раза.
Пример 12
Энергетические профили реакций.
Для прямой реакции Еа = 80 кДж/моль; DrН° = 25 кДж/моль. Чему равны энергия активации и стандартная энтальпия обратной реакции?
Решение. Учитывая, что прямая реакция является эндотермической ( 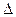
Еа (обрат) = Еа(прям) — 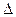
Еа (обрат) = 80 кДж/моль — 25 к Дж/моль = 55 кДж/моль
Ответ: Еа(обрат) = 55 кДж/моль; DrН°(обрат) = -25 кДж/моль
Занятие ___. Дата ____.____. 20___
http://poisk-ru.ru/s3490t4.html
http://lektsii.org/12-62672.html