Урок 14. Расчеты по уравнениям химических реакций
В уроке 14 «Расчеты по уравнениям химических реакций» из курса «Химия для чайников» мы научимся решать задачи, используя уравнения химических реакций.
Вещества вступают в химические реакции в определенных массовых и количественных соотношениях. Следовательно, при проведении реакций в лабораториях и на химических заводах расходуются определенные массы исходных веществ для получения заданной массы продуктов реакции.
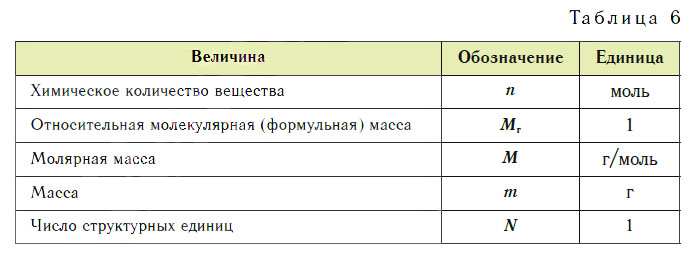
Эти расчеты проводят по уравнениям реакций. Единицы величин, которыми пользуются в химии, представлены в таблице 6.
При проведении любого вычисления по уравнению реакции нужно внимательно прочитать условие задачи. Особое в нимание обратите на расстановку коэффициентов, так как соотношение числа структурных единиц реагирующих веществ и получающихся продуктов реакции выражается в уравнениях коэффициентами так же, как и мольные отношения.
Для решения расчетной задачи необходим определенный порядок действий. Рассмотрим его на нескольких примерах.
Пример 1. Железо масс о й 224 г полностью прореагировало с хлором. Рассчитайте массу образовавшегося вещества FeCl3.
Стехиометрические расчёты
Содержание:
Одним из важнейших химических понятий, на котором основываются стехиометрические расчёты, является химическое количество вещества. Количество некоторого вещества X обозначается n(X). Единицей измерения количества вещества является моль.
Моль – это количество вещества, в котором содержится 6,02·10 23 молекул, атомов, ионов или других структурных единиц, из которых состоит вещество.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Стехиометрические расчёты
Стехиометрическими расчетами называют нахождение значений количества, масс и объемов веществ (реагентов и продуктов), участвующих в химических реакциях. Формульное количество вещества B (nB) и масса этого вещества (mB) связаны между собой соотношением.
Решение задач по уравнениям химических реакций
Вспомните! Уравнения химических реакций. Закон сохранения массы вещества. Составление и решение пропорции
По уравнениям химических реакций можно решать множество количественных задач. Мы остановимся на расчетных задачах по нахождению массы (m) и числа молей 
Решение задач осуществляется по следующему алгоритму:







Задача 1. Сколько граммов хлорида натрия образуется при взаимодействии 92 г натрия с хлором?

Задача 2. Сколько молей углекислого газа образуется при горении 36 г углерода?

Задача 3. Вычислите массу цинка (Zn), который должен взаимодействовать с соляной кислотой с выделением 10 г водорода.

Задача 4. Рассчитайте количество веществ оксида меди (CuO) и углекислого газа, полученных при разложении 5 г малахита 


а) 1 моль (м-т) : 2 моля (CuO) = 0,0225 моль (м-т) : х моль (CuO)
х = 0,045 моль (CuO)

0,0225 моль 
Закон авогадро и молярный объем газов
Какие газы вы знаете? Что такое плотность?
Многие химические вещества существуют в газообразном состоянии, например 




Объем газов зависит от температуры и давления. При постоянном давлении и температуре расстояния между молекулами газообразных веществ примерно одинаковы.
Из курса физики вам известно понятие «плотность»

В таблице 8 приведены некоторые величины, характеризующие известные вам газы.
Рассчитаем объем 1 моля каждого газа (при н.у.):
Как видно из этих расчетов, объемы одного моля различных газов при нормальных условиях (н. у.), т. е. при температуре 0°С и давлении 1 атм (101,3 кПа), примерно одинаковы и составляют 22,4 л. При стандартных условиях (t = 25°С, p = 101,3 кПа) молярный объем составляет 24 л. Эта величина называется молярным объемом и обозначается 

количеству вещества
В 1 моль любых веществ, в том числе и газах, содержится одинаковое число молекул, которое называется числом Авогадро 
В равных объемах газов, взятых при одинаковых условиях, содержится одинаковое число молекул. Этот закон был сформулирован итальянским ученым Авогадро в 1811 году.
Плотностью газа при н. у. называется отношение молярной массы газа на молярный объем.
Плотность газа при нормальных условиях:
Доказательство закона Авогадро
Найдите число молекул и массы кислорода и углекислого газа объемом 50 л, взятых при нормальных условиях (н. у.).
Число молекул равных объемов (50 л) газов, взятых при одинаковых условиях (н. у.), одинаково.
Расчет масс газов.
Массы газов разные.
Определение плотности газов
Найдите плотности кислорода и углекислого газа при нормальных условиях.
Нахождение объема, числа молекул, количества вещества по известной массе газа и обратные задачи
а) Определите объем, число молекул, количество вещества 8,8 г углекислого газа при н. у.
б) Рассчитайте массу, количество вещества и число молекул 67,2 л кислорода при н. у.
в) Рассчитать объем, массу, число молекул в 0,5 моль аммиака (н. у.).
г) Определите объем (н. у), массу и количество вещества сернистого газа числом молекул
Нормальные и стандартные условия, молярный объем, число и закон Авогадро.
Относительная плотность газов
Кроме плотности веществ, в химии часто применяют понятие относительная плотность.
Относительной плотностью (D) одного газа по отношению к другому газу называется отношение масс газов, взятых в равных объемах при одинаковых условиях.
Часто относительную плотность различных газов определяют по отношению к водороду или воздуху.
По формулам относительных плотностей можно рассчитать значение молярной массы газов.
Нахождение относительной плотности
Рассчитайте относительные плотности кислорода и углекислого газа по водороду и воздуху
Расчет молярных масс газов по относительным плотностям газов
Рассчитать молярные массы газов, если известны относительные плотности:
Расчет массы неизвестного газа по значению относительной плотности
Рассчитайте массу 50 л (н. у.) неизвестного газа, если относительная плотность этого газа по воздуху равна 0,586. Какова относительная плотность по водороду?
Закон объемных отношений
Напишем уравнение реакции между газообразными веществами, когда в результате реакции также образуется газ:
Отношение количеств реагирующих и образовавшихся веществ выглядит следующим образом: 2 : 1 : 2. Теперь возьмем отношение объемов этих газов при нормальных условиях:
Как видим, отношения объемов газов соответствуют отношениям коэффициентов перед формулами веществ в уравнении.
При одинаковых условиях объемы реагирующих газов и газообразных продуктов реакции относятся между собой как небольшие целые числа. Это закон объемных отношений Гей-Люссака.
Из рассмотренных примеров можно сделать вывод, что при решении задач удобно пользоваться коэффициентами, т.к. они в уравнениях химических реакций указывают объемные отношения веществ.
Определите объем кислорода, необходимого для окисления 60 л оксида серы (IV) до оксида серы (VI) по уравнению:
Закон объемных отношений.
- 1. Моль — мера количества вещества. В 1 моль любого вещества содержится число Авогадро структурных единиц (6,02-1023).
- 2. Молярная масса вещества (М) численно равна относительной молекулярной массе (Мг).
- 3. Расчеты по химическим уравнениям производятся на основе закона сохранения масс веществ.
- 4. В равных объемах газов, взятых при одинаковых условиях, содержится одинаковое число молекул. (Закон Авогадро.)
- 5. Относительной плотностью одного газа по отношению к другому газу (Dy(X)) называется отношение масс газов, взятых в равных объемах при одинаковых условиях.
- 6. Объемы реагирующих газообразных веществ относятся между собой и к объемам образующихся газообразных продуктов, как небольшие целые числа, равные коэффициентам в уравнении химической реакции. (Закон объемных отношений Гей-Люссака.)
- 7. При нормальных условиях (н. у.) любой газ занимает 22,4 л. Эта величина называется молярным объемом (У = 22,4 л/моль).
Услуги по химии:
Лекции по химии:
Лекции по неорганической химии:
Лекции по органической химии:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
Практические занятия № 1,2. Расчеты по химическим формулам и уравнениям
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Практические занятия № 1,2.
Расчеты по химическим формулам и уравнениям
Цель работы: закрепление знаний по основным химическим понятиям и законам.
Оборудование: Периодическая система химических элементов Д.И.Менделеева.
1.1. Определение молярной массы вещества:
б) оксида кальция (СаО)
в) гидроксида железа( III )( Fe ( OH ) 3 )
г) кремниевой кислоты ( H 2 SiO 3 )
д) фосфата натрия ( Na 3 PO 4 ).
1.2. Определение количества вещества по его массе:
а) азота ( N 2 ), масса которого 7 г
б) оксида натрия ( Na 2 O ), масса которого 3,1г
в) гидроксида кальция ( Ca ( OH ) 2 ), масса которого 3,7 г
г) серной кислоты ( H 2 SO 4 ), масса которой 4,9 г
д) нитрата серебра ( AgNO 3 ), масса которого 0,85 г
1.3. Определение количества вещества по его объему:
а) кислорода ( O 2 ), объем которого 2, 24 л
б) аммиака (Н 3 N ), объем которого 448 л
в) диоксида углерода (СО 2 ), объем которого 6,72л
г) метана (СН 4 ), объем которого 4,48 л
д) сероводорода (Н 2 S ), объем которого 3,36 л.
1.4. Определение относительной плотности одного газа по другому:
a ) диоксида серы ( S О 2 ) по водороду (Н 2 );
6) аммиака ( NH 3 ) по кислороду (О 2 );
в) метана (СН 4 ) по азоту ( N 2 );
г) этана ( С 2 Н 4 ) по воздуху ( M(возд.) = 29 г/моль );
д) ацетилена (С 2 Н 2 ) по хлору (M(Cl 2 )=71 г/моль).
1.5. Вычислите массовую долю элементов (%) в веществе: в гидроксиде натрия ( NaOH ).
2.1 . Определите массу нитрата серебра (AgNO 3 ), необходимого для получения осадка массой 28,7 г хлорида серебра (AgCl) при взаимодействии с избытком хлороводородной (соляной) кислоты (HCl).
2.2. Какой объем газа (Н 2 ) выделится (при н.у.) при взаимодействии 5,4 г алюминия ( Al ) с избытком раствора серной кислоты ( H 2 SO 4 ).
Основные формулы и уравнения реакций:
1.1.Определение молярной массы: а) кислорода (О 2 ): M (О 2 ) = 2 A ( O ) = 2 
б) оксида натрия ( Na 2 O ): M ( Na 2 O ) = 2 

в ) серной кислоты ( Н 2 SO 4 ): M(H 2 SO 4 )= 2 


г) гидроксида бария (Ва(ОН) 2 ): M (Ва(ОН) 2 ) = A ( Ba ) + 2 

1.2. Определите количество вещества: а) иодида натрия( NaI ),масса которого равна 90 г: 1) М ( NaI ) = A ( Na ) + A ( I ) = 23 + 127 = 150 г/моль,
2) ν ( NaI ) = 

б) серы( S ), масса которой 1,6 г: 1) М ( S ) = A ( S ) = 32 г/моль,
2) ν (S) = 

1.3. Определите количество вещества : а) водорода (Н2), объем которого 44,8 л: ν (Н2) = 

б) хлороводорода (Н Cl ), объем которого 3,36 л: ν (Н Cl ) = 

1.4. Определение относительной плотности одного газа по другому:
а) водороду : M (С 2 Н 6 ) = 2 



M ( H 2 ) =2 

D H 2 (С 2 Н 6 ) = 

б) кислороду : M (О 2 ) = 2 

D О2 (С 2 Н 6 ) = 

в) азоту : M ( N 2 ) = 2 

D N 2 (С 2 Н 6 ) = 

1) определяем молярную массу вещества: M ( X a Y b Z c )= aA ( X )+ bA ( Y )+ cA ( Z );
2) определение массовой доли элемента X в веществе ( X a Y b Z c ):
W(X) = 

3) определение массовой доли элемента Y в веществе ( X a Y b Z c ):
W(Y) = 

4) определение массовой доли элемента Z в веществе ( X a Y b Z c ):
W ( Z ) = 
2.1. Определение массы продукта реакции (исходного вещества) по массе исходного вещества (продукта реакции):
ν : 1 моль 1 моль
M : . г/моль . г/моль
2.2. Определение объема продукта реакции по массе исходного вещества:
M : . г/моль V m . л/моль
Практические занятия № 1,2.
Расчеты по химическим формулам и уравнениям.
Цель работы: закрепление знаний по основным химическим понятиям и законам.
Оборудование: Периодическая система химических элементов Д.И.Менделеева.
1.1. Определение молярной массы вещества:
б ) оксида магн ия ( Mg О)
в) гидроксида алюминия ( Al ( OH ) 3 )
г) угольной кислоты ( H 2 CO 3 )
д) нитрата железа ( III ) ( Fe ( NO 3 ) 3 ).
1.2. Определение количества вещества по его массе:
а) брома ( Br 2 ), масса которого 20 г
б) сероводорода (Н 2 S ), масса которого 3,4 г
в) гидроксида бария ( Ba ( OH ) 2 ), масса которого 1,71 г
г) азотной кислоты ( HNO 3 ), масса которой 1,26 г
д) сульфита калия (К 2 S О 3 ), масса которого 7,9 г
1.3. Определение количества вещества по его объему:
а) азота ( N 2 ), объем которого 33,6 л
б) водяного пара (Н 2 О), объем которого 16,8 л
в) диоксида серы ( SO 2 ), объем которого 1,12 л
г) ацетилена (С 2 Н 2 ), объем которого 168 л
д) метаналя ( CH 2 O ), объем которого 5,6 л.
1.4. Определение относительной плотности одного газа по другому:
а) оксида углерода ( II ) ( СО) по водороду (Н 2 );
б) диоксида азота ( N 0 2 ) по кислороду (О 2 );
г) этаналя ( С 2 Н 4 O ) по воздуху ( M(возд.) = 29 г/моль );
д) триоксида серы (SO 3 ) по хлору (M(Cl 2 )=71 г/моль).
1.5. Вычислите массовую долю элементов (%) в веществе: в гидроксиде лития ( LiOH ).
2.1. Какая масса хлорида бария требуется для превращения 19,6 г серной кислоты в сульфат бария?
2.2. Какой объем оксида серы (IV) выделится (при н.у.) при взаимодействии 25,2 г сульфита натрия с избытком хлороводородной (соляной) кислоты?
Основные формулы и уравнения реакций:
1.1.Определение молярной массы: а) кислорода (О 2 ): M (О 2 ) = 2 

б) оксида натрия ( Na 2 O ): M ( Na 2 O ) = 2 

в ) серной кислоты ( Н 2 SO 4 ): M(H 2 SO 4 )= 2 



г) гидроксида бария (Ва(ОН) 2 ): M (Ва(ОН) 2 ) = A ( Ba ) + 2 

1.2. Определите количество вещества: а) иодида натрия( NaI ),масса которого равна 90 г: 1) М ( NaI ) = A ( Na ) + A ( I ) = 23 + 127 = 150 г/моль,
2) ν ( NaI ) = 

б) серы( S ), масса которой 1,6 г: 1) М ( S ) = A ( S ) = 32 г/моль,
2) ν (S) = 

1.3. Определите количество вещества : а) водорода (Н2), объем которого 44,8 л: ν (Н2) = 

б) хлороводорода (Н Cl ), объем которого 3,36 л: ν (Н Cl ) = 

1.4. Определение относительной плотности одного газа по другому:
а) водороду : M (С 2 Н 6 )=2 



M ( H 2 ) =2 

D H 2 (С 2 Н 6 ) = 

б) кислороду : M (О 2 ) = 2 

D О2 (С 2 Н 6 ) = 

в) азоту : M ( N 2 ) = 2 

D N 2 (С 2 Н 6 ) = 

1) определяем молярную массу вещества: M ( X a Y b Z c )= aA ( X )+ bA ( Y )+ cA ( Z );
2) определение массовой доли элемента X в веществе ( X a Y b Z c ):
W(X) = 

3) определение массовой доли элемента Y в веществе ( X a Y b Z c ):
W(Y) = 

4) определение массовой доли элемента Z в веществе ( X a Y b Z c ):
W ( Z ) = 
2.1. Определение массы продукта реакции (исходного вещества) по массе исходного вещества (продукта реакции): Х г 19,6 г
ν: 1 моль 1 моль
M : . г/моль . г/моль
2.2. Определение объема продукта реакции по массе исходного вещества:
M : . г/моль V m . л/моль
Ответы на задания 1 — го варианта:
1. 1 а) M (Н 2 ) = 2 

б) M ( CaO ) = А( Ca ) + A ( O ) = 40 + 16 = 56 г/моль;
в) M ( Fe ( OH ) 3 ) = А( Fe ) + 3 

г) M ( H 2 SiO 3 ) = 2 



д ) M (Na 3 PO 4 ) = 3 



1.2. а) M ( N 2 ) = 2 

ν ( N 2 ) = 

б) M ( Na 2 O ) = 2 

ν ( Na 2 O ) = 

в) M ( C а(ОН) 2 ) = A ( Ca ) + 2 

ν ( Ca ( OH ) 2 ) = 

г ) M(H 2 SO 4 )= 2 



ν ( H 2 SO 4 ) = 

д ) M(AgNO 3 ) = A(Ag) + A(N) + 3 

ν ( AgNO 3 ) = 

1.3. а) ν ( O 2 ) = 

б) ν ( NH 3 ) = 

в) ν ( CO 2 ) = 

г) ν ( CH 4 ) = 

д) ν ( H 2 S ) = 

1.4. а ) D H2 (SO 2 ) = 

б ) D O2 (H 3 N) = 

в) D N 2 ( CH 4 ) = 

г) D возд ( C 2 H 4 ) = 

д ) D Cl2 (C 2 H 2 ) = 

1.5. M(N аОН ) = A(Na) + A (O) + A(H) = 23 + 16 +1 = 40 г / моль .,
W(Na) = 



W(O) = 



W(H) = 100 % — (W(Na) + W(O)) = 100 % — (57,5 %+ 40 %) = 2,5 %.
Ответ : W(Na) = 57,5 %; W(O) = 40 %; W(H) = 2,5 %.
ν : 1 моль 1 моль
M : 170 г/моль 143,5г/моль
m : 170 г 143,5 г
х = m ( AgNO 3 ) = 170 
ν : 2 моль 3 моль
M : 27 г/моль V m 22,4 л/моль
m : 54 г V 67,2 л
Х = V ( H 2) = 5,4 
Ответы на задания 2 — го варианта:
1.1 а) M ( N 2 ) = 2 

б) M ( MgO ) = А( Mg ) + A ( O ) = 24 + 16 = 40 г/моль;
в) M ( Al ( OH ) 3 ) = А( Al ) + 3 

г) M ( H 2 CO 3 ) = 2 



д ) M (Fe(NO 3 ) 3 ) = A(Fe) + 3 



1.2. а) M ( Br 2 ) = 2 

ν ( Br 2 ) = 

б ) M (H 2 S) = 2 

ν ( H 2 S ) = 

в ) M(B а ( ОН ) 2 ) = A(Ba) + 2 

ν (Ba(OH) 2 ) = 

г ) M(HNO 3 )= A(H) +A(N)+3 

ν ( HNO 3 ) = 

д ) M(K 2 SO 3 ) = 2 



ν ( K 2 SO 3 ) = 

1.3. а) ν ( N 2 ) = 

б) ν ( H 2 O ) = 

в) ν ( SO 2 ) = 

г) ν ( C 2 H 2 ) = 

д) ν ( CH 2 O ) = 

1.4. а) D H 2 (С O ) = 

б ) D O2 (NO 2 ) = 

в) D N 2 ( C 2 H 6 ) = 

г) D возд ( C 2 H 4 O ) = 

д ) D Cl2 (SO 3 ) = 

1.5. M(Li ОН ) = A(Li) + A (O) + A(H) = 7 + 16 +1 = 24 г / моль .,
W(Li) = 



W(O) = 



W(H) = 100 % — (W(Na) + W(O)) = 100 % — (29,17 %+ 66,67 %) = 3,63 %.
Ответ : W(Na) = 29,17 %; W(O) = 66,67%; W(H) = 3,63 %.
ν : 1 моль 1 моль
M : 208 г/моль 98 г/моль
Х = m ( BaCl 2 ) = 208 
ν : 1 моль 1 моль
M : 126г/моль V m .22,4 л/моль
m : 126. г V 22,4 л
Х = V ( SO 2 ) = 25,2 
http://natalibrilenova.ru/stehiometricheskie-raschyotyi/
http://infourok.ru/prakticheskie-zanyatiya-rascheti-po-himicheskim-formulam-i-uravneniyam-683079.html