Урок 14. Расчеты по уравнениям химических реакций
В уроке 14 «Расчеты по уравнениям химических реакций» из курса «Химия для чайников» мы научимся решать задачи, используя уравнения химических реакций.
Вещества вступают в химические реакции в определенных массовых и количественных соотношениях. Следовательно, при проведении реакций в лабораториях и на химических заводах расходуются определенные массы исходных веществ для получения заданной массы продуктов реакции.
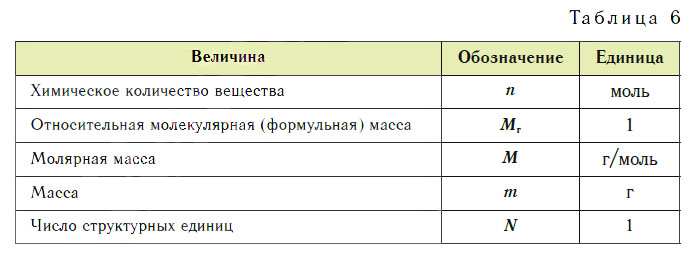
Эти расчеты проводят по уравнениям реакций. Единицы величин, которыми пользуются в химии, представлены в таблице 6.
При проведении любого вычисления по уравнению реакции нужно внимательно прочитать условие задачи. Особое в нимание обратите на расстановку коэффициентов, так как соотношение числа структурных единиц реагирующих веществ и получающихся продуктов реакции выражается в уравнениях коэффициентами так же, как и мольные отношения.
Для решения расчетной задачи необходим определенный порядок действий. Рассмотрим его на нескольких примерах.
Пример 1. Железо масс о й 224 г полностью прореагировало с хлором. Рассчитайте массу образовавшегося вещества FeCl3.
Практические занятия № 1,2. Расчеты по химическим формулам и уравнениям
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Практические занятия № 1,2.
Расчеты по химическим формулам и уравнениям
Цель работы: закрепление знаний по основным химическим понятиям и законам.
Оборудование: Периодическая система химических элементов Д.И.Менделеева.
1.1. Определение молярной массы вещества:
б) оксида кальция (СаО)
в) гидроксида железа( III )( Fe ( OH ) 3 )
г) кремниевой кислоты ( H 2 SiO 3 )
д) фосфата натрия ( Na 3 PO 4 ).
1.2. Определение количества вещества по его массе:
а) азота ( N 2 ), масса которого 7 г
б) оксида натрия ( Na 2 O ), масса которого 3,1г
в) гидроксида кальция ( Ca ( OH ) 2 ), масса которого 3,7 г
г) серной кислоты ( H 2 SO 4 ), масса которой 4,9 г
д) нитрата серебра ( AgNO 3 ), масса которого 0,85 г
1.3. Определение количества вещества по его объему:
а) кислорода ( O 2 ), объем которого 2, 24 л
б) аммиака (Н 3 N ), объем которого 448 л
в) диоксида углерода (СО 2 ), объем которого 6,72л
г) метана (СН 4 ), объем которого 4,48 л
д) сероводорода (Н 2 S ), объем которого 3,36 л.
1.4. Определение относительной плотности одного газа по другому:
a ) диоксида серы ( S О 2 ) по водороду (Н 2 );
6) аммиака ( NH 3 ) по кислороду (О 2 );
в) метана (СН 4 ) по азоту ( N 2 );
г) этана ( С 2 Н 4 ) по воздуху ( M(возд.) = 29 г/моль );
д) ацетилена (С 2 Н 2 ) по хлору (M(Cl 2 )=71 г/моль).
1.5. Вычислите массовую долю элементов (%) в веществе: в гидроксиде натрия ( NaOH ).
2.1 . Определите массу нитрата серебра (AgNO 3 ), необходимого для получения осадка массой 28,7 г хлорида серебра (AgCl) при взаимодействии с избытком хлороводородной (соляной) кислоты (HCl).
2.2. Какой объем газа (Н 2 ) выделится (при н.у.) при взаимодействии 5,4 г алюминия ( Al ) с избытком раствора серной кислоты ( H 2 SO 4 ).
Основные формулы и уравнения реакций:
1.1.Определение молярной массы: а) кислорода (О 2 ): M (О 2 ) = 2 A ( O ) = 2 
б) оксида натрия ( Na 2 O ): M ( Na 2 O ) = 2 

в ) серной кислоты ( Н 2 SO 4 ): M(H 2 SO 4 )= 2 


г) гидроксида бария (Ва(ОН) 2 ): M (Ва(ОН) 2 ) = A ( Ba ) + 2 

1.2. Определите количество вещества: а) иодида натрия( NaI ),масса которого равна 90 г: 1) М ( NaI ) = A ( Na ) + A ( I ) = 23 + 127 = 150 г/моль,
2) ν ( NaI ) = 

б) серы( S ), масса которой 1,6 г: 1) М ( S ) = A ( S ) = 32 г/моль,
2) ν (S) = 

1.3. Определите количество вещества : а) водорода (Н2), объем которого 44,8 л: ν (Н2) = 

б) хлороводорода (Н Cl ), объем которого 3,36 л: ν (Н Cl ) = 

1.4. Определение относительной плотности одного газа по другому:
а) водороду : M (С 2 Н 6 ) = 2 



M ( H 2 ) =2 

D H 2 (С 2 Н 6 ) = 

б) кислороду : M (О 2 ) = 2 

D О2 (С 2 Н 6 ) = 

в) азоту : M ( N 2 ) = 2 

D N 2 (С 2 Н 6 ) = 

1) определяем молярную массу вещества: M ( X a Y b Z c )= aA ( X )+ bA ( Y )+ cA ( Z );
2) определение массовой доли элемента X в веществе ( X a Y b Z c ):
W(X) = 

3) определение массовой доли элемента Y в веществе ( X a Y b Z c ):
W(Y) = 

4) определение массовой доли элемента Z в веществе ( X a Y b Z c ):
W ( Z ) = 
2.1. Определение массы продукта реакции (исходного вещества) по массе исходного вещества (продукта реакции):
ν : 1 моль 1 моль
M : . г/моль . г/моль
2.2. Определение объема продукта реакции по массе исходного вещества:
M : . г/моль V m . л/моль
Практические занятия № 1,2.
Расчеты по химическим формулам и уравнениям.
Цель работы: закрепление знаний по основным химическим понятиям и законам.
Оборудование: Периодическая система химических элементов Д.И.Менделеева.
1.1. Определение молярной массы вещества:
б ) оксида магн ия ( Mg О)
в) гидроксида алюминия ( Al ( OH ) 3 )
г) угольной кислоты ( H 2 CO 3 )
д) нитрата железа ( III ) ( Fe ( NO 3 ) 3 ).
1.2. Определение количества вещества по его массе:
а) брома ( Br 2 ), масса которого 20 г
б) сероводорода (Н 2 S ), масса которого 3,4 г
в) гидроксида бария ( Ba ( OH ) 2 ), масса которого 1,71 г
г) азотной кислоты ( HNO 3 ), масса которой 1,26 г
д) сульфита калия (К 2 S О 3 ), масса которого 7,9 г
1.3. Определение количества вещества по его объему:
а) азота ( N 2 ), объем которого 33,6 л
б) водяного пара (Н 2 О), объем которого 16,8 л
в) диоксида серы ( SO 2 ), объем которого 1,12 л
г) ацетилена (С 2 Н 2 ), объем которого 168 л
д) метаналя ( CH 2 O ), объем которого 5,6 л.
1.4. Определение относительной плотности одного газа по другому:
а) оксида углерода ( II ) ( СО) по водороду (Н 2 );
б) диоксида азота ( N 0 2 ) по кислороду (О 2 );
г) этаналя ( С 2 Н 4 O ) по воздуху ( M(возд.) = 29 г/моль );
д) триоксида серы (SO 3 ) по хлору (M(Cl 2 )=71 г/моль).
1.5. Вычислите массовую долю элементов (%) в веществе: в гидроксиде лития ( LiOH ).
2.1. Какая масса хлорида бария требуется для превращения 19,6 г серной кислоты в сульфат бария?
2.2. Какой объем оксида серы (IV) выделится (при н.у.) при взаимодействии 25,2 г сульфита натрия с избытком хлороводородной (соляной) кислоты?
Основные формулы и уравнения реакций:
1.1.Определение молярной массы: а) кислорода (О 2 ): M (О 2 ) = 2 

б) оксида натрия ( Na 2 O ): M ( Na 2 O ) = 2 

в ) серной кислоты ( Н 2 SO 4 ): M(H 2 SO 4 )= 2 



г) гидроксида бария (Ва(ОН) 2 ): M (Ва(ОН) 2 ) = A ( Ba ) + 2 

1.2. Определите количество вещества: а) иодида натрия( NaI ),масса которого равна 90 г: 1) М ( NaI ) = A ( Na ) + A ( I ) = 23 + 127 = 150 г/моль,
2) ν ( NaI ) = 

б) серы( S ), масса которой 1,6 г: 1) М ( S ) = A ( S ) = 32 г/моль,
2) ν (S) = 

1.3. Определите количество вещества : а) водорода (Н2), объем которого 44,8 л: ν (Н2) = 

б) хлороводорода (Н Cl ), объем которого 3,36 л: ν (Н Cl ) = 

1.4. Определение относительной плотности одного газа по другому:
а) водороду : M (С 2 Н 6 )=2 



M ( H 2 ) =2 

D H 2 (С 2 Н 6 ) = 

б) кислороду : M (О 2 ) = 2 

D О2 (С 2 Н 6 ) = 

в) азоту : M ( N 2 ) = 2 

D N 2 (С 2 Н 6 ) = 

1) определяем молярную массу вещества: M ( X a Y b Z c )= aA ( X )+ bA ( Y )+ cA ( Z );
2) определение массовой доли элемента X в веществе ( X a Y b Z c ):
W(X) = 

3) определение массовой доли элемента Y в веществе ( X a Y b Z c ):
W(Y) = 

4) определение массовой доли элемента Z в веществе ( X a Y b Z c ):
W ( Z ) = 
2.1. Определение массы продукта реакции (исходного вещества) по массе исходного вещества (продукта реакции): Х г 19,6 г
ν: 1 моль 1 моль
M : . г/моль . г/моль
2.2. Определение объема продукта реакции по массе исходного вещества:
M : . г/моль V m . л/моль
Ответы на задания 1 — го варианта:
1. 1 а) M (Н 2 ) = 2 

б) M ( CaO ) = А( Ca ) + A ( O ) = 40 + 16 = 56 г/моль;
в) M ( Fe ( OH ) 3 ) = А( Fe ) + 3 

г) M ( H 2 SiO 3 ) = 2 



д ) M (Na 3 PO 4 ) = 3 



1.2. а) M ( N 2 ) = 2 

ν ( N 2 ) = 

б) M ( Na 2 O ) = 2 

ν ( Na 2 O ) = 

в) M ( C а(ОН) 2 ) = A ( Ca ) + 2 

ν ( Ca ( OH ) 2 ) = 

г ) M(H 2 SO 4 )= 2 



ν ( H 2 SO 4 ) = 

д ) M(AgNO 3 ) = A(Ag) + A(N) + 3 

ν ( AgNO 3 ) = 

1.3. а) ν ( O 2 ) = 

б) ν ( NH 3 ) = 

в) ν ( CO 2 ) = 

г) ν ( CH 4 ) = 

д) ν ( H 2 S ) = 

1.4. а ) D H2 (SO 2 ) = 

б ) D O2 (H 3 N) = 

в) D N 2 ( CH 4 ) = 

г) D возд ( C 2 H 4 ) = 

д ) D Cl2 (C 2 H 2 ) = 

1.5. M(N аОН ) = A(Na) + A (O) + A(H) = 23 + 16 +1 = 40 г / моль .,
W(Na) = 



W(O) = 



W(H) = 100 % — (W(Na) + W(O)) = 100 % — (57,5 %+ 40 %) = 2,5 %.
Ответ : W(Na) = 57,5 %; W(O) = 40 %; W(H) = 2,5 %.
ν : 1 моль 1 моль
M : 170 г/моль 143,5г/моль
m : 170 г 143,5 г
х = m ( AgNO 3 ) = 170 
ν : 2 моль 3 моль
M : 27 г/моль V m 22,4 л/моль
m : 54 г V 67,2 л
Х = V ( H 2) = 5,4 
Ответы на задания 2 — го варианта:
1.1 а) M ( N 2 ) = 2 

б) M ( MgO ) = А( Mg ) + A ( O ) = 24 + 16 = 40 г/моль;
в) M ( Al ( OH ) 3 ) = А( Al ) + 3 

г) M ( H 2 CO 3 ) = 2 



д ) M (Fe(NO 3 ) 3 ) = A(Fe) + 3 



1.2. а) M ( Br 2 ) = 2 

ν ( Br 2 ) = 

б ) M (H 2 S) = 2 

ν ( H 2 S ) = 

в ) M(B а ( ОН ) 2 ) = A(Ba) + 2 

ν (Ba(OH) 2 ) = 

г ) M(HNO 3 )= A(H) +A(N)+3 

ν ( HNO 3 ) = 

д ) M(K 2 SO 3 ) = 2 



ν ( K 2 SO 3 ) = 

1.3. а) ν ( N 2 ) = 

б) ν ( H 2 O ) = 

в) ν ( SO 2 ) = 

г) ν ( C 2 H 2 ) = 

д) ν ( CH 2 O ) = 

1.4. а) D H 2 (С O ) = 

б ) D O2 (NO 2 ) = 

в) D N 2 ( C 2 H 6 ) = 

г) D возд ( C 2 H 4 O ) = 

д ) D Cl2 (SO 3 ) = 

1.5. M(Li ОН ) = A(Li) + A (O) + A(H) = 7 + 16 +1 = 24 г / моль .,
W(Li) = 



W(O) = 



W(H) = 100 % — (W(Na) + W(O)) = 100 % — (29,17 %+ 66,67 %) = 3,63 %.
Ответ : W(Na) = 29,17 %; W(O) = 66,67%; W(H) = 3,63 %.
ν : 1 моль 1 моль
M : 208 г/моль 98 г/моль
Х = m ( BaCl 2 ) = 208 
ν : 1 моль 1 моль
M : 126г/моль V m .22,4 л/моль
m : 126. г V 22,4 л
Х = V ( SO 2 ) = 25,2 
Как решать задачи по химии. Расчет по уравнениям химических реакций.
Как решать задачи по химии? Как проводить простейшие расчеты по уравнениям химических реакций? Сколько выделяется газа, образуется воды, выпадает осадка или сколько получается конечного продукта реакций? Сейчас мы постараемся разобрать все нюансы и ответить на эти вопросы, которые очень часто возникают при изучении химии.
Решение задач в химии является неотъемлемой частью в изучении этой сложной, но очень интересной науки.
Алгоритм решения задач по химии
- Прочитать условия задачи (если они есть). Да, об этом все знают — как же решить задачу без условий — но все же, для полноты инструкции, мы не могли не указать этот пункт.
- Записать данные задачи. На этом пункте мы не будем заострять внимание, так как требования различных учебных заведений, учителей и преподавателей могут значительно отличаться.
- Записать уравнение реакции. Теперь начинается самое интересное! Здесь нужно быть внимательным! Обязательно необходимо верно расставить коэффициенты перед формулами веществ. Если вы забудете это сделать, то все наши усилия буду напрасны.
- Провести соответствующие расчеты по химическому уравнению. Далее рассмотрим, как же сделать эти самые расчеты.
Для этого у нас есть два пути, как решить задачу по химии. Условно, назовем их правильным (используя понятия количества вещества) и неправильным (используя пропорции). Конечно же, мы бы рекомендовали решать задачи правильным путем. Так как у неправильного пути имеется очень много противников. Как правило, учителя считают, что ученики, решающие задачи через пропорции, не понимают самой сути протекания процессов химических реакций и решают задачи просто математически.
Расчет по уравнениям химических реакций с использованием понятия количества вещества
Суть данного метода, состоит в том, что вещества реагируют друг с другом в строгом соотношении. И уравнение реакции, которое мы записали ранее, дает нам это соотношение. Коэффициенты перед формулами веществ дают нам нужные данные для расчетов.
Для примера, запишем простую реакцию нейтрализации серной кислоты и гидроксида натрия.
H_<2>SO_ <4>+ NaOH → Na_<2>SO_ <4>+ H_<2>O
H_<2>SO_ <4>+ 2NaOH → Na_<2>SO_ <4>+ 2H_<2>O
Исходя из этого уравнения, мы видим, что одна молекула серной кислоты взаимодействует с двумя молекулами гидроксида натрия. И в результате этой реакции получается одна молекула сульфата натрия и две молекулы воды.
Сейчас мы немного отступим от разбора задач, чтобы познакомиться с основными понятиями, которые пригодятся нам в решении задач по химии.
Рассчитывать количество молекул, например в 98 граммах серной кислоты — это не самое удобное занятие. Числа будут получаться огромными ( ≈ 6,022140857⋅10 23 молекул в 98 граммах серной кислоты) . Для этого в химии ввели понятие количества вещества (моль) и молярная масса.
1 Моль (единица измерения количества вещества) — это такое количество атомов, молекул или каких либо еще структурных единиц, которое содержится в 12 граммах изотопа углерода-12. Позднее выяснилось, что в 12 граммах вещества углерод-12 содержится 6,022140857⋅10 23 атомов. Соответственно, можно сказать, что 1 моль, это такая масса вещества, в которой содержится 6,022140857⋅10 23 атомов (или молекул) этого вещества.
Но ведь молекулы и атомы имеют различный состав и различное строение. Разные атомы содержат разное количество протонов и нейтронов. Соответственно 1 моль для разных веществ будет иметь разную массу, имея при это одинаковое количество молекул ( атомов). Эта масса называется молярной.
Молярная масса — это масса 1 моля вещества.
Используя данные понятия, можно сказать, что 1 моль серной кислоты реагирует с 2 молями гидроксида натрия, и в результате получается 1 моль сульфата натрия и 2 моль воды. Давайте запишем эти данные под уравнением реакции для наглядности.
\begin
Следом запишем молярные массы для этих веществ
\begin
Теперь, зная массу одного из веществ, мы можем рассчитать, сколько нам необходимо второго вещества для полного протекания реакции, и сколько образуется конечных продуктов.
Для примера, решим по этому же уравнению несколько задач.
Задача. Сколько грамм гидроксида натрия (NaOH) необходимо для того, чтобы 49 грамм серной кислоты (H2SO4) прореагировало полностью?
Итак, наши действия: записываем уравнение химической реакции, расставляем коэффициенты. Для наглядности, запишем данные задачи над уравнением реакции. Неизвестную величину примем за Х. Под уравнением записываем молярные массы, и количество молей веществ, согласно уравнению реакции:
\begin
Записывать данные под каждым веществом — не обязательно. Достаточно это будет сделать для интересующих нас веществ, из условия задачи. Запись выше дана для примера.
Примерно так должны выглядеть данные, записанные по условиям задачи. Не претендуем на единственно правильное оформление, требования у всех разные. Но так, как нам кажется, смотрится все довольно наглядно и информативно.
Первое наше действие — пересчитываем массу известного вещества в моли. Для этого разделим известную массу вещества (49 грамм) на молярную массу:
49\98=0,5 моль серной кислоты
Как уже упоминалось ранее, по уравнению реакции 1 моль серной кислоты реагирует с 2 моль гидроксида натрия. Соответственно с 0,5 моль серной кислоты прореагирует 1 моль гидроксида натрия.
n(NaOH)=0.5*2=1 моль гидроксида натрия
Найдем массу гидроксида натрия, умножив количество вещества на молярную массу:
1 моль * 40 г/моль = 40 грамм гидроксида натрия.
Ответ: 40 грамм NaOH
Как видите, в решении задачи по уравнению реакции нет ничего сложного. Задача решается в 2-3 действия, с которыми справятся ученики начальных классов. Вам необходимо всего лишь запомнить несколько понятий.
Решение задач по химии через пропорцию
Ну и расскажем про второй способ вычислений по уравнениям химических реакций — вычисления через пропорцию. Этот способ может показаться немного легче, так как в некоторых случаях можно пропустить стадию перевода массы вещества в его количество. Чтобы было более понятно, объясню на том же примере.
Так же, как и в прошлом примере, запишем уравнение реакции, расставим коэффициенты и запишем над уравнением и под уравнением известные данные.
Для этого способа, нам так же понадобится записать под уравнением реакции, следом за молярной массой, массу вещества, соответствующую его количеству по уравнению. Если проще, то просто перемножить две строки под уравнением реакции, количество моль и молярную массу. Должно получиться так:
\begin
А теперь внимание, начинается магия! Нас интересует строка данных над уравнением, и самая нижняя строка под уравнением. Составим из этих данных пропорцию.
Далее находим неизвестное значение Х из пропорции и радуемся полученному значению:
Х=49*80/98=40 грамм
Как видим, получается тот же результат. Прежде всего, при решении задач в химии, главное все же — понимание химических процессов. Тогда решение задачи не станет для вас проблемой!
http://infourok.ru/prakticheskie-zanyatiya-rascheti-po-himicheskim-formulam-i-uravneniyam-683079.html
http://in-chemistry.ru/kak-reshat-zadachi-po-himii-raschet-po-uravneniyam-himicheskih-reaktsij