Урок 14. Расчеты по уравнениям химических реакций
В уроке 14 «Расчеты по уравнениям химических реакций» из курса «Химия для чайников» мы научимся решать задачи, используя уравнения химических реакций.
Вещества вступают в химические реакции в определенных массовых и количественных соотношениях. Следовательно, при проведении реакций в лабораториях и на химических заводах расходуются определенные массы исходных веществ для получения заданной массы продуктов реакции.
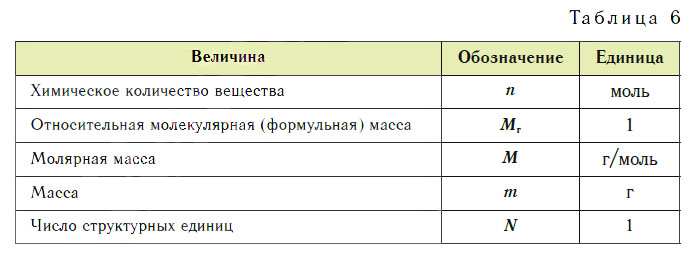
Эти расчеты проводят по уравнениям реакций. Единицы величин, которыми пользуются в химии, представлены в таблице 6.
При проведении любого вычисления по уравнению реакции нужно внимательно прочитать условие задачи. Особое в нимание обратите на расстановку коэффициентов, так как соотношение числа структурных единиц реагирующих веществ и получающихся продуктов реакции выражается в уравнениях коэффициентами так же, как и мольные отношения.
Для решения расчетной задачи необходим определенный порядок действий. Рассмотрим его на нескольких примерах.
Пример 1. Железо масс о й 224 г полностью прореагировало с хлором. Рассчитайте массу образовавшегося вещества FeCl3.
Расчеты по химическим уравнением
Разделы: Химия
Чему бы ты ни учился, ты
учишься для себя.
Петроний
Цели урока:
- познакомить учащихся с основными способами решения задач по химическим уравнениям:
- находить количество, массу и объём продуктов реакции по количеству, массе или объёму исходных веществ,
- продолжить формирование навыков работы с текстом задачи, умение аргументировано выбирать способ решения учебной задачи, умения составлять уравнения химических реакций.
- развивать умения анализировать, сравнивать, выделять главное, составлять план действия, делать выводы.
- воспитывать терпимость к другим, самостоятельность в принятии решений, умение объективно оценить результаты своего труда.
Формы работы: фронтальная, индивидуальная, парная, групповая.
Тип урока: комбинированный с применением ИКТ
Ход и содержание урока
I Организационный момент.
Здравствуйте ребята. Сегодня, мы с вами научимся решать задачи по уравнениям химических реакций. Слайд 1 (cм. презентацию).
Цели урока Слайд 2.
II.Актуализация знаний, умений, навыков.
Химия очень интересная и в то же время сложная наука. Для того чтобы знать и понимать химию, надо не только усваивать материал, но и уметь применять полученные знания. Вы узнали какие признаки указывают на протекание химических реакций, научились составлять уравнения химических реакций. Я надеюсь, что вы хорошо усвоили эти темы и без труда ответите на мои вопросы
Какое явление не является признаком химических превращений:
а) появление осадка; в) изменение объема;
а) уравнения реакций соединения
б) уравнения реакций замещения
в) уравнения реакций разложения Слайд 4
- Новая тема.
Для того, чтобы научиться решать задачи, необходимо составить алгоритм действий, т.е. определить последовательность действий.
Алгоритм для расчета по химическим уравнениям (у каждого учащегося на столе)
Для того, чтобы решить расчетную задачу по химии, можно воспользоваться следующим алгоритмом – сделать пять шагов:
1. Составить уравнение химической реакции.
2. Над формулами веществ записать известные и неизвестные величины с соответствующими единицами измерения (только для чистых веществ, без примесей). Если по условию задачи в реакцию вступают вещества, содержащие примеси, то сначала нужно определить содержание чистого вещества.
3. Под формулами веществ с известными и неизвестными записать соответствующие значения этих величин, найденные по уравнению реакций.
4. Составить и решить пропорцию.
5. Записать ответ.
Приступаем к решению задач, применяя алгоритм
Вычисление массы вещества по известной массе другого вещества, участвующего в реакции
Вычислите массу кислорода, выделившегося в результате разложения
порции воды массой 9 г.
Найдем молярную массу воды и кислорода:
Запишем уравнение химической реакции:
Над формулой в уравнении реакции запишем найденное
значение количества вещества, а под формулами веществ —
стехиометрические соотношения, отображаемые
Вычислим количество вещества, массу которого требуется найти.
Для этого составляем пропорцию
откуда х = 0,25 моль Слайд 7
Следовательно, n(O2)=0,25 моль
Найдем массу вещества, которую требуется вычислить
m(O2) = 0,25 моль • 32 г/моль = 8 г
Ответ: m(О2) = 8 г Слайд 8
Вычисление объема вещества по известной массе другого вещества, участвующего в реакции
Вычислите объем кислорода (н. у.), выделившегося в результате разложения порции воды массой 9 г.
Vm=22,4л/моль Слайд 9
Запишем уравнение реакции. Расставим коэффициенты
Над формулой в уравнении реакции запишем найденное значение количества вещества, а под формулами веществ — стехиометрические соотношения, отображаемые химическим уравнением
Вычислим количество вещества, массу которого требуется найти. Для этого составим пропорцию
откуда х = 0,25 моль
Найдем объем вещества, который требуется вычислить
Ответ: 5,6 л Слайд 11
III.Закрепление изученного материала.
Задачи для самостоятельного решения:
1.При восстановлении углем оксидов Fe2O3 и SnO2 получили по 20 г Fe и Sn. Сколько граммов каждого оксида было взято?
2.В каком случае образуется больше воды:
а) при восстановлении водородом 10 г оксида меди (I) (Cu2O) или
б) при восстановлении водородом 10 г оксида меди(II) (CuO)? Слайд 12
Проверим решение задачи 1
M(Fe)=56г/моль,
m(Fe2O3)=
Проверим решение задачи 2
4.
х моль = 0,07моль,
m (H2O) = 
n(CuO) = 10г/ 80г/моль = 0,125 моль
х моль = 0,125моль, n(H2O)=0,125 моль
Ответ: 2,25г Слайд 15
Домашнее задание: изучить материал учебника с. 45-47, решить задачу
Какую массу оксида кальция и какой объм углекислого газа (н.у.)
можно получить при разложении карбоната кальция массой 250г?
CaCO3 = CaO + CO Cлайд 16.
1. Габриелян О.С. Программа курса химии для 8-11 классов общеобразовательных учреждений. М. Дрофа 2006г.
2. Габриелян О.С. Химия. 8 класс. Учебник для общеобразовательных учреждений. Дрофа. М. 2005г.
3. Горбунцова С.В. Тесты по основным разделам школьного курса хииии. 8 — 9 классы.ВАКО, Москва,2006г.
4. Горковенко М.Ю.Поурочные разработки по химии. К учебникам О.С.Габриеляна, Л.С.Гузея, В.В.Сорокина, Р.П.Суровцевой и Г.Е.Рудзитиса, Ф.Г.Фельдмана. 8 класс.ВАКО, Москва, 2004г.
5. Габриелян О.С. Химия. 8 класс: Контрольные и проверочные работы. – М.: Дрофа, 2003.
6.Радецкий А.М., Горшкова В.П. Дидактический материал по химии для 8-9 классов: Пособие для учителя. – М.: Просвещение, 2000
Расчеты по химическим уравнениям
Для того, чтобы решить расчетную задачу по химии, можно воспользоваться следующим алгоритмом – сделать пять шагов:
1. Составить уравнение химической реакции.
2. Над формулами веществ записать известные и неизвестные величины с соответствующими единицами измерения (только для чистых веществ, без примесей). Если по условию задачи в реакцию вступают вещества, содержащие примеси, то сначала нужно определить содержание чистого вещества.
3. Под формулами веществ с известными и неизвестными записать соответствующие значения этих величин, найденные по уравнению реакций.
4. Составить и решить пропорцию.
5. Записать ответ.
Соотношение некоторых физико-химических величин и их единиц
Масса (m) : г ; кг ; мг
Кол-во в-ва (n) : моль ; кмоль ; ммоль
Молярная масса (M): г/моль ; кг/кмоль ; мг/ммоль
Объём (V) : л ; м 3 /кмоль; мл
Молярный объём(Vm) : л/моль ; м 3 /кмоль; мл/ммоль
Число частиц (N): 6•1023 (число Авагадро – NA); 6•1026 ; 6•1020
Разработка урока по химии с презентацией на тему «Расчёты по химическим уравнениям» (8 класс)
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
«Актуальность создания школьных служб примирения/медиации в образовательных организациях»
Свидетельство и скидка на обучение каждому участнику
Выберите документ из архива для просмотра:
Выбранный для просмотра документ Конспект к уроку Расчёты по химическим уравнениям 8 класс.docx
Учитель химии высшей квалификационной категории МОУ «Гимназия № 1»
Воскресенского муниципального района
Лобанова Оксана Дмитриевна
Расчёты по химическим уравнениям. 8 класс. (2 урок)
Дидактическая (обучающая): обобщить и систематизировать знания учащихся по теме «Расчёты по химическим уравнениям».
отработка умений и навыков написания химических уравнений и расстановки коэффициентов;
закрепление умений производить расчеты по химическим уравнениям.
акцентировать внимание на правильном оформлении результатов работы.
Развивающая: развитие познавательных умений, аналитического мышления, логики.
научить применять знания, полученные на уроках, на практике;
учить анализировать, обобщать, делать самостоятельные выводы.
Воспитательная: воспитание положительного отношения к знаниям, чувства ответственности учащегося за свою работу.
воспитывать способность к самореализации;
воспитание уверенности в своих силах, настойчивости;
развитие культуры общения, умения высказывать свои взгляды, суждения.
репродуктивный (воспроизведение информации, выполнение упражнений);
проблемно-поисковый, игровые элементы.
Методы контроля: устный фронтальный и индивидуальный опрос, самостоятельная работа.
Межпредметные связи: математика.
Учащийся должен знать:
формулы для расчётов массы, объёма, количества;
единицы измерения массы, объёма, количества.
Учащийся должен уметь:
составлять уравнения химических реакций на основе закона сохранения массы веществ;
вычислять по химическим уравнениям массу, объём или количество вещества по известным массе, объёму или количеству вещества одного из вступающих в реакцию веществ или продуктов реакции;
вычислять массу (количество вещества, объем) продукта реакции, если известна масса исходного вещества, содержащего определенную долю примесей;
вычислять массу (количество вещества, объем) продукта реакции, если известна масса раствора и массовая доля растворенного вещества.
О. С. Габриелян. Химия 8 класс: учебник для общеобразовательных учреждений. ─ М.: Дрофа, 2011. ─266 с.
О. С. Габриелян, Н. П. Воскобойникова, А.В. Яшукова. Настольная книга учителя, 8 класс. ─М.: Дрофа, 2002. ─416 с.
Дидактические материалы: карточки с разноуровневыми заданиями.
Учебно-наглядные пособия: периодическая система химических элементов Д. И. Менделеева.
Вводное слово учителя.
Проверка домашнего задания. Повторение алгоритма решения задач.
Отработка навыка решения задач.
Игра на составление химических элементов.
Рефлексия (подведение итогов урока).
Создание проблемной ситуации. Домашнее задание.
1. Организационный момент. Приветствие, проверка отсутствующих, готовности к уроку; организация внимания; сообщение темы, целей и задач урока, мотивация, что учащиеся должны знать и уметь, сообщение плана урока. (Слайд 2)
2. Вводное слово учителя. (Слайд 3) . Проверим знания величин и их единиц измерений, расчетных формул на нахождение количество вещества, используя массу и объем.
Задание 1: На магнитной доске закреплены карточки с обозначением величин и единиц измерений. Сопоставить величину и единицу измерения.
Задание 2: Используя данные карточки, составить формулу для нахождения количества вещества по известной массе или объёму вещества.
3. Проверка домашнего задания. Алгоритм решения задач. (Слайд 4) . Учащийся называет ответ задачи. Класс проверяет. На примере домашней задачи вспомним алгоритм решения задач по химическим уравнениям.
Домашняя задача. Рассчитайте, какая масса кислорода образуется при разложении 108 г воды.
Дано: m ( H 2 O ) = 108 г, Найти: m ( O 2 ) — ?
M ( H 2 O ) = 18 г/моль
n ( H 2 O ) = m / M = 108 г / 18 г/моль = 6 моль
n ( O 2 ) = 0,5 n ( H 2 O ) = 6 моль/ 2 = 3 моль
m ( O 2 ) = n ( O 2 ) × M ( O 2 ) = 3 моль × 32 г /моль = 96 г
Ответ: m ( O 2 ) = 96 г
4. Отработка навыка решения задач. На прошлом уроке мы начали решать задачи, сегодня мы обобщим и углубим эти знания.
(Слайд 5) Задача 1. Вычислите объём водорода (н. у.), который выделится при взаимодействии цинка с 730 г 20%-го раствора соляной кислоты. Zn + HCl → ZnCl 2 + H 2
Дано: m (раствора HCl ) = 730 г, w ( HCl ) = 20%. Найти: V ( H 2 ) — ?
Нужно найти сколько содержится соляной кислоты в растворе по формуле: m ( HCl ) = w ( HCl ) × m (раствора HCl ) = 0,2 × 730 г = 146 г
n ( HCl ) = m ( HCl ) / M ( HCl ) = 146 г/ 36,5 г/моль = 4 моль
n ( H 2 ) = 0,5 n ( HCl ) = 0, 5 × 4 моль = 2 моль
V ( H 2 ) = n ( H 2 ) × Vm = 2 моль × 22,4 л/моль = 44,8 л
Ответ: V ( H 2 ) = 44,8 л
(Слайд 6) Задача 2. Какое количество вещества натрия потребуется для взаимодействия со 160 г серы, содержащей 20% примесей?
Дано: m ( S ) = 160 г, w прим = 20%. Найти : n (Na) — ?
m (S) = 0,8 × 160 = 128 г
n (S) = m (S)/M (S) = 128 г /32 г / моль = 4 моль
n (Na) = 2 n (S) = 4 моль × 2 = 8 моль
Ответ: n ( Na ) = 8 моль.
5. Физкультминутка. (Слайд 7) Немного отвлечёмся, подвигаемся и повторим материал.
Я буду называть формулы веществ. Вы определяете класс веществ и соответствующий вариант поднимается.
1 вариант – оксиды; 2 вариант – основания; 3 вариант – кислоты; 4 вариант – соли.
Если вы согласны со следующими утверждениями, то кивайте, если нет, то отрицательно помашите головой.
При химических реакциях одни вещества превращаются в другие. (Да)
Закон сохранения массы веществ открыт Д. И. Менделеевым. (Нет)
В воздухе содержится 21% кислорода по объёму. (Да)
Реакция горения сопровождается выделением теплоты и света. (Да)
Экзотермические реакции протекают с поглощением тепла. (Нет)
При физических явлениях изменяется состав веществ. (Нет)
В воздухе содержится 78% азота по объёму. (Да)
Коэффициенты в уравнениях химических реакций показывают количества исходных и конечных веществ. (Да)
Закон сохранения массы веществ открыт М. В. Ломоносовым. (Да)
Изменение цвета – признак физического явления. (Нет)
Выпадение осадка, газа – признаки химических реакций. (Да)
Молекулы и атомы электронейтральные частицы. ( Да)
7. Игра на составление уравнений химических реакций. (Слайд 7)
6. Самостоятельная работа. (Слайд 8) Сейчас вы приступите к выполнению самостоятельной работы. У вас на столах задания 2-х уровней. Первый уровень – в условие задачи есть уравнение реакции, надо составить пропорцию и решить её. В задачах второго уровня надо расставить коэффициенты, использовать величины «массовая доля растворённого вещества» или «массовая доля примесей». Выберите соответствующий вам уровень и решите задачу.
7. Рефлексия (подведение итогов урока). (Слайд 9) Обменяйтесь листочками, возьмите карандаш и проверьте ответ соседа по парте. Сдайте листочки.
Создание проблемной ситуации. (Слайд 10) Вспомните, что такое реакции горения? Одно из условий протекания данной реакции – наличие кислорода. Вспомните, сколько кислорода по объёму содержится в воздухе? (φ ( O 2 ) = 21%). Вот эта величина содержится в домашней задаче. Подумайте, как её применить при решении задачи.
Домашнее задание. (Слайд 11) Решите задачу.
Ответы к самостоятельной работе.
1 уровень: n ( Fe ) = 28 г/ 56г/моль = 0,5 моль; n ( Cu ) = 0,5 моль
2 уровень: m ( C ) = 30 г × 0,8 = 24 г; n (С) = 24 г/12г/моль = 2 моль; n ( Fe ) = 4 моль; m ( Fe ) = 224 г
1 уровень: n ( CuO ) = 160 г/80г/моль = 2 моль; n ( H 2 ) = 2 моль; V ( H 2 ) = 44,8 л
2 уровень: m ( HCl ) = 365 г × 0,2 = 73 г; n ( HCl ) = 2 моль; n ( H 2 ) = 1 моль; V ( H 2 ) = 22,4 л
1 уровень: n ( MgO ) = 160 г/ 40г/моль = 4 моль; n ( MgSO 4 ) = 4 моль
2 уровень: m ( NaOH ) = 800 г × 0,2 = 160 г; n ( CO 2 ) = 2 моль; V ( CO 2 ) = 44,8 л
1 уровень: n ( H 2 ) = V / Vm = 89,6 л/22,4л/моль = 4 моль; n ( Fe ) = 4 моль
2 уровень: m ( Na 2 O ) = 77,5 г × 0,8 = 62 г; n ( Na 2 O ) = 1 моль; n ( NaOH ) = 2 моль
Выбранный для просмотра документ Расчёты по химическим уравнениям. 8 класс.pptx
http://urok.1sept.ru/articles/612236
http://infourok.ru/razrabotka-uroka-po-himii-s-prezentaciey-na-temu-raschyoti-po-himicheskim-uravneniyam-klass-443319.html