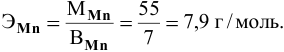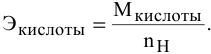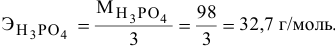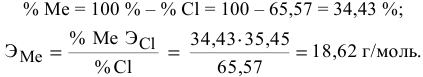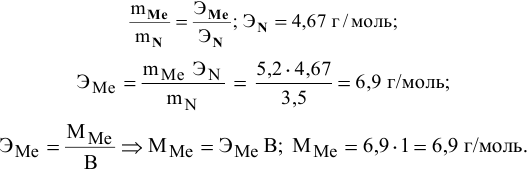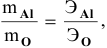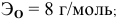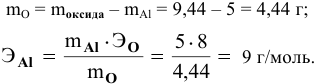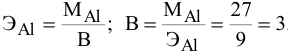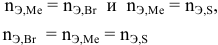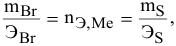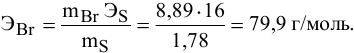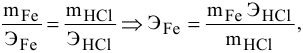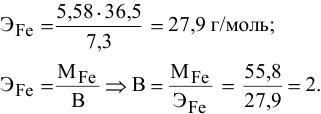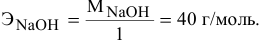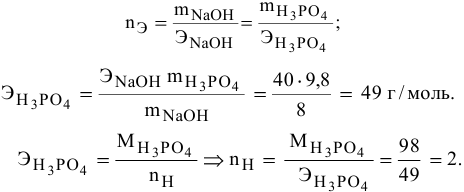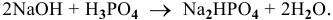Эквивалент. Закон эквивалентов
Материалы портала onx.distant.ru
Эквивалент. Закон эквивалентов
Эквивалент – реальная или условная частица вещества Х, которая в данной кислотно-основной реакции или реакции обмена эквивалентна одному иону водорода Н + (одному иону ОН — или единичному заряду), а в данной окислительно- восстановительной реакции эквивалентна одному электрону.
Фактор эквивалентности fэкв(X) – число, показывающее, какая доля реальной или условной частицы вещества Х эквивалентна одному иону водорода или одному электрону в данной реакции, т.е. доля, которую составляет эквивалент от молекулы, иона, атома или формульной единицы вещества.
Наряду с понятием “количество вещества”, соответствующее числу его моль, используется также понятие количество эквивалентов вещества.
Закон эквивалентов: вещества реагируют в количествах, пропорциональных их эквивалентам. Если взято n(экв1) моль эквивалентов одного вещества, то столько же моль эквивалентов другого вещества n(экв2) потребуется в данной реакции, т.е.
При проведении расчетов необходимо использовать следующие соотношения:
1. Молярная масса эквивалента вещества X равна его молярной массе, умноженной на фактор эквивалентности:
2. Количество эквивалентов вещества X определяется делением его массы на молярную массу эквивалента:
3. Объём моль-эквивалента газа Х при н.у. равен молярному объёму газа, умноженному на фактор эквивалентности:
4. Молярная масса эквивалента сложного вещества равна сумме молярных масс эквивалентов составляющих это вещество атомов (ионов).
5. Молярная масса эквивалента оксида равна молярной массе эквивалента элемента плюс молярная масса эквивалента кислорода.
6. Молярная масса эквивалента гидроксида металла равна молярной массе эквивалента металла плюс молярная масса эквивалента гидроксила, например:
М[½Са(ОН)2] = 20 + 17 = 37 г/моль.
7. Молярная масса эквивалента сульфата металла равна молярной массе эквивалента металла плюс молярная масса эквивалента SO4 2- , например,
М(½ СаSO4) = 20 + 48 = 68 г/моль.
Эквивалент в кислотно-основных реакциях
На примере взаимодействия ортофосфорной кислоты со щелочью с образованием дигидро-, гидро- и среднего фосфата рассмотрим эквивалент вещества H3PO4.
Эквивалент NaOH соответствует формульной единице этого вещества, так как фактор эквивалентности NaOH равен единице. В первом уравнении реакции молярное соотношение реагентов равно 1:1, следовательно, фактор эквивалентности H3PO4 в этой реакции равен 1, а эквивалентом является формульная единица вещества H3PO4.
Во втором уравнении реакции молярное отношение реагентов H3PO4 и NaOH составляет 1:2, т.е. фактор эквивалентности H3PO4 равен 1/2 и её эквивалентом является 1/2 часть формульной единицы вещества H3PO4 .
В третьем уравнении реакции количество веществ реагентов относятся друг к другу как 1:3. Следовательно, фактор эквивалентности H3PO4 равен 1/3, а её эквивалентом является 1/3 часть формульной единицы вещества H3PO4.
Таким образом, эквивалент вещества зависит от вида химического превращения, в котором принимает участие рассматриваемое вещество.
Следует обратить внимание на эффективность применения закона эквивалентов: стехиометрические расчёты упрощаются при использовании закона эквивалентов, в частности, при проведении этих расчётов отпадает необходимость записывать полное уравнение химической реакции и учитывать стехиометрические коэффициенты. Например, на взаимодействие без остатка 0,25 моль-экв ортофосфата натрия потребуется равное количество эквивалентов вещества хлорида кальция, т.е. n(1/2CaCl2) = 0,25 моль.
Эквивалент в окислительно-восстановительных реакциях
Фактор эквивалентности соединений в окислительно-восстановительных реакциях равен:
где n – число отданных или присоединенных электронов.
Для определения фактора эквивалентности рассмотрим три уравнения реакций с участием перманганата калия:
В результате получаем следующую схему превращения KMnO4.
в кислой среде: Mn +7 + 5e = Mn +2
в нейтральной среде: Mn +7 + 3e = Mn +4
в щелочной среде: Mn +7 + 1e = Mn +6
Схема превращений KMnO4 в различных средах
Таким образом, в первой реакции fэкв(KMnO4) = 1/5, во второй – fэкв(KMnO4) = 1/3, в третьей – fэкв(KMnO4) = 1.
Следует подчеркнуть, что фактор эквивалентности дихромата калия, реагирующего в качестве окислителя в кислой среде, равен 1/6:
Примеры решения задач
Задача 1. Определить фактор эквивалентности сульфата алюминия, который взаимодействует со щелочью.
Решение. В данном случае возможно несколько вариантов ответа:
Задача 2. Определить факторы эквивалентности Fe3О4 и KCr(SO4)2 в реакциях взаимодействия оксида железа с избытком хлороводородной кислоты и взаимодействия двойной соли KCr(SO4)2 со стехиометрическим количеством щёлочи КОН с образованием гидроксида хрома (III).
Задача 3. Определить факторы эквивалентности и молярные массы эквивалентов оксидов CrО, Cr2О3 и CrО3 в кислотно-основных реакциях.
CrО3 – кислотный оксид. Он взаимодействует со щёлочью:
Молярные массы эквивалентов рассматриваемых оксидов равны:
Мэкв(CrО) = 68(1/2) = 34 г/моль,
Задача 4. Определить объём 1 моль-экв О2, NH3 и H2S при н.у. в реакциях:
Vэкв(NH3) = 22,4× 1/3 = 7,47 л – в первой реакции.
Vэкв(NH3) = 22,4× 1/5 = 4,48 л – во второй реакции.
В третьей реакции для сероводорода Vэкв(H2S)=22,4 1/6 = 3,73 л.
Задача 5. 0,45 г металла вытесняют из кислоты 0,56 л (н.у.) водорода. Определить молярную массу эквивалента металла, его оксида, гидроксида и сульфата.
Задача 6. Рассчитать массу перманганата калия, необходимую для окисления 7,9 г сульфита калия в кислой и нейтральной средах.
fэкв(K2SО3) = 1/2 (в кислой и нейтральной среде).
В кислой среде Мэкв(KMnO4) = 158·1/5 = 31,6 г/моль, m(KMnO4) = 0,1·31,6 = 3,16 г.
В нейтральной среде Мэкв (KMnO4) = 158·1/3 = 52,7 г/моль, m(KMnO4) = 0,1·52,7 =5,27 г.
Задача 7. Рассчитать молярную массу эквивалента металла, если оксид этого металла содержит 47 мас.% кислорода.
Выбираем для расчётов образец оксида металла массой 100 г. Тогда масса кислорода в оксиде составляет 47 г, а масса металла – 53 г.
В оксиде: nэкв (металла) = nэкв(кислорода). Следовательно:
53:Мэкв(Ме) = 47:(32·1/4). В результате получаем Мэкв(Ме) = 9 г/моль.
Задачи для самостоятельного решения
2.1. Молярная масса эквивалента металла равна 9 г/моль. Рассчитать молярную массу эквивалента его нитрата и сульфата.
Ответ: 71 г/моль; 57 г/моль.
2.2. Молярная масса эквивалента карбоната некоторого металла составляет 74 г/моль. Определить молярные массы эквивалентов этого металла и его оксида.
Ответ: 44 г/моль; 52 г/моль.
2.3. Рассчитать объём 1 моля эквивалента сероводорода (н.у.), который окисляется до оксида серы (IV).
Ответ: 3,73 л.
2.4. Определить молярную массу эквивалента Ni(OH)Cl в реакциях:
Ni(OH)Cl + NaOH = Ni(OH)2 + NaCl.
Ответ: 55,6 г/моль; 111,2 г/моль.
2.5. При взаимодействии 4,8 г неизвестного металла и 13 г цинка с соляной кислотой выделяется одинаковый объём водорода. Вычислить молярные массы эквивалентов металла, его оксида и его хлорида.
Ответ: МЭ(металла)=12 г/моль; МЭ(оксида)=20 г/моль, МЭ(хлорида)=47,5 г/моль.
2.6. Рассчитать молярные массы эквивалентов металла и его гидроксида, если хлорид этого металла содержит 79,7 мас.% хлора, а молярная масса эквивалента хлора равна 35,5 г/моль.
Ответ: МЭ(металла)=9 г/моль; МЭ(оксида)=26 г/моль.
2.7. Какой объём 0,6 М раствора H2O2 пойдёт на окисление 150 мл 2н. раствора FeSO4 в реакции:
Ответ: 250 мл.
2.8. Определить объём хлора (н.у), необходимый для окисления 100 мл 0,5н раствора K2MnO4.
Ответ: 0,56 л.
2.9. 0,66 г кислоты требуются для нейтрализации 10 мл 1М раствора КОН. Найти молярные массы эквивалентов кислоты и ее кальциевой соли в обменной реакции.
Ответ: МЭ(кислоты)=66 г/моль; МЭ(соли)=85 г/моль.
2.10. Бромид металла в результате обменной реакции полностью переведен в сульфат, при этом масса уменьшилась в 1,47 раз. Найти молярную массу эквивалента металла. Определить какой это металл.
Ответ: МЭ(металла)=20 г/моль; Са.
Расчет эквивалентов соединений
где M — моль| молекул соединения
n – число атомов элемента, который стоит первым в формуле соединения
Z – модуль степени| окисления этого элемента
Эквивалент химического соединения можно определить как сумму эквивалентов составляющих его частей:
Экислоты = Эводорода + Экислотного остатка
а) Э ( Al2O3) = Э (Al +3 ) + Э(О -2 ) = 1/3 М(Al +3 ) + ½ М(О -2 )
б) Э (Ca(OH)2 = Э (Ca +2 ) + Э (ОН — )= ½ М(Ca +2 ) + М (ОН — )
Задание: Рассчитать эквиваленты соединений:
Относительная атомная масса (атомная масса)— это число, которое показывает во сколько раз масса данного атома тяжелее атома Гидрогена (Аr (элемент) ).
Маса атома Гидрогена равна 1 / 12 части массы атома изотопа Карбон -12 ( 12 С). Эта величина называется атомной единицей массы ( а.е.м. ).
Масса атома Гидрогена равна одной атомной единице массы. Следовательно атомная масса Гидрогена равна 1.
m (Н) = 1 а.е.м. Аr (Н) = 1
Аr (Fe ) = m (Fe) / m (H) = 55,85 ≈ 56
Индекс (r ) указывает на относительный характер величины, т.к. является первой буквой в латинском слове relative , что означает в переводе на русский язык относительный.
Внимание ! Значение относительных атомных масс элементов приведены в периодической системе ( дробные числа ).
Задание : Рассмотрите периодическую систему и запишите относительные атомные массы элементов: а) Сульфур; б) Натрий; в) Волфрам; г) Тантал; д) Оксиген , округляя значения до целого числа.
8. Относительная молекулярная масса ( молекулярная масса )— это число, которое показывает во сколько раз масса данной молекулы больше массы атома Гидрогена ( Мr (молекулы)).
Относительная молекулярная масса рассчитывается по формулам молекул как сумма атомных масс элементов, входящих в состав молекулы, с учетом числа атомов каждого элемента.
Мr (H2SO4 ) = 2 · Аr (Н) + Аr (S ) + 4 · Аr (О) = 2 ·1 + 32 + 4·16 =98
Задание: Рассчитать молекулярные массы :
9. Молярная масса — это масса вещества, взятого в количестве один моль (М(структ. ед.) , г / моль )
Так как 1 моль любого вещества содержит 6,02 ∙ 10 23 структурных единиц (см. выше по тексту ), то молярная масса – это масса
6,02 ∙ 10 23 структурных единиц определенного вида.
Если вещество состоит из атомов, то молярная масса его численно равна относительной атомной массе; единицы измерения г / моль.
Аr (Н) = 1 ← относительная атомная масса
М (Н) = 1 г / моль ← молярная масса атомов Гидрогена
Аr (Fe ) = 56 ← относительная атомная масса
М (Fe ) = 56 г / моль ← молярная масса атомов Fe
Задание ! Продолжите примеры.
Если вещество состоит из молекул, то молярная масса этого вещества численно равна его молекулярной массе.
Единицы измерения г / моль.
Задание ! Продолжить примеры.
10. Молярный объем — это объем газообразного вещества, взятого количеством один моль ( V М , л; мл и т.д. )
Молярный объем имеет массу моля и содержит число Авогадро
(6,02 ∙ 10 23 ) структурных единиц газа.
Молярный объем может изменяться при изменении температуры и давления газа.
При нормальных условиях (н.у.) один моль газа занимает объем 22,4 л .
Нормальные условия характеризуются параметрами:
Давление Р = 1,01 • 10 5 Па = 760 мм.рт.ст. = 1 атм.
Температура Т = 273К ; t = 0 0 С
11. Молярная масса эквивалента вещества — это масса моля эквивалента элемента или соединения (МЭ (стр. ед.) , г / моль )
Масса 1 эквивалента называется его эквивалентной массой (mэ).
где Аr – относительная атомная масса | элемента
Z – модуль степени| окисления элемента в соединении
где M – молярная масса | соединения
n – число атомов элемента, который стоит первым в формуле
Z – модуль степени| окисления этого элемента
а) Э(Н) = 1 М(Н) следовательно МЭ (Н) = 1М(Н) = 1 г/ моль
Молярные массы эквивалентов оксидов, гидроксидов, кислот и солей можно определить:
Мэ(О) = М(О) / 2 = 16/2 =8 г/моль
Мэ(ОН — ) = М(ОН — ) / 1 = 17 г/моль
Мэ(кислоты) = Мэ(водорода) + Мэ(кислотного остатка)
Мэ(Н) = М(Н) /1 = 1 г/ моль
Мэ (Fe2O3) = 1/3 M(Fe 3+ ) + ½ M(O 2- ) = 56/3 + 8= 26,6 г/моль
Мэ (Са(ОН)2) = ½ М(Са 2+ ) + М(ОН — ) = 40/2 + 17 = 37 г/моль
Мэ (H2SO4 ) = М(Н + ) + ½ М(SO4 2- ) = 1 + 96/2 = 49 г/моль
Мэ (Al(NO3)3 = 1/3 M(Al +3 ) + M(NO3 — ) = 27/3 + 62 = 71г/моль
Задание: Рассчитать эквиваленты и молярные массы эквивалентов:
В окислительно-восстановительной реакции эквивалент вещества равен его малекулярной массе деленной на число отданных или принятых одной молекулой электронов.
В │ Mg 0 – 2e → Mg +2 │2│процесс окисления
О │ 2H + + 2e → H2 0 │2│процесс восстановления
В │ Mg 0 – 2e → Mg +2 │8│процесс окисления
О │ S +6 + 8e → S -2 │2│процесс восстановления
Объем, занимаемый при данных условиях эквивалентной массой газообразного вещества, называется эквивалентным объемом.
Молярный объем (объем, который занимает один моль газообразного вещества) при нормальных условиях равен 22,4 л.
а) М(Н2) = 2 г/моль Мэ(Н) = 1г/моль
2 г Н2 занимают объем 22,4 л
1 г Н2 занимает объем 11,2 л, значит Vэ(Н2) = 11,2 л
б) М(О2) = 32 г/моль занимает объем 22,4 л
Мэ(О) = 8 г/моль занимает объем 22,4 / 4 = 5,6 л
Внимание ! Способы расчета эквивалентов и молярных масс эквивалентов смотрите выше по тексту.
ОСНОВНЫЕ ЗАКОНЫ
1. Закон сохранения массы веществ ( Ломоносов М.В. , 1748г.)
Массы веществ, вступающие в реакцию ( реагентов ) всегда равны массам веществ, образующихся в результате реакции
При написании уравнений реакций закон сохранения массы будет удовлетворен, если числа атомов каждого элемента в левой и правой частях уравнения будут равны.
Для достижения такого равенства перед формулами веществ расставляют коэффициенты. Эти коэффициенты называются стехиометрическими. Расчеты по уравнениям реакций ведутся с учетом коэффициентов и тоже называются стехиометрическими.
Химические формулы веществ определяют не только их состав, но и определенную массу этого вещества – молярную массу.
M (HCl) = 36,5 г /моль
M ( FeCl3) = 162,5 г /моль
M ( H2O) = 18 г /моль
Коэффициенты при формулах в уравнении реакции указывают на число моль вещества.
Пример действия закона сохранения массы
160 6· 36,5 2· 162,5 3· 18
160 + 219 325 + 54
Единицы измерения массы могут быть разними ( мг, кг , т ), но соотношение масс должны сохраняться.
2. Закон эквивалентов( Рихтер, 1793г)
а) вещества реагируют друг с другом в строго эквивалентных соотношениях
Число моль,ν 2 1 3 1
Число эквивал, nЭ 1 1 1 1
Число моль реагентов и продуктов может быть различным. Число эквивалентности – одинаково.
б) массы реагентов и массы продуктов относятся между собой как молярные массы эквивалентов этих веществ.
в) в тех случаях, когда в реакции участвуют газообразные вещества, закон эквивалентов выражается следующим соотношением:
Vэ1 , Vэ2 – эквивалентные объемы этих газов
Если же одно из реагирующих веществ находится в твердом состоянии, а другое в газообразном, то закон эквивалентов выражается следующим равенством:
где m – масса твердого вещества;
Мэ – молярная масса эквивалента твердого вещества;
V – объем газообразного вещества;
Vэ – эквивалентный объем.
3. Закон постоянства состава соединений( Пруст, 1799 г.)
Каждое индивидуальное молекулярное соединение имеет постоянный качественный и количественный состав независимо от способа его получения.
Например: H2SO4 — качественный состав молекулы : Гидроген, Сульфур,
количественный состав|склад|: два атома Гидрогена;
один атом Сульфура;
четыре атома Оксигена.
4. Закон кратных отношений( Дальтон, 1803 г.)
Если два элемента образуют друг с другом несколько соединений, то на одну и ту же массу одного элемента приходятся такие массы другого элемента, которые относятся между собой как небольшие целые числа.
| Состав оксида | Масса Нитрогена в 1 моль оксида | Масса Оксигена в 1 моль оксида | Отношение массы Оксигена к массе Нитрогена |
| N2O | 0,57 | ||
| NO | 1,14 | ||
| N2O3 | 1,71 | ||
| NO2 | 2,29 | ||
| N2O5 | 2,85 |
Если числа четвертой колонки разделить на самое маленькое из них
( 0,57), то получим ряд целых чисел 1 , 2 , 3 , 4 , 5
5. Закон объемных отношений ( Гей – Люссак, 1805 г.)
Объемы газов, которые вступают в реакцию, относятся друг к другу и к объемам образующихся газообразных продуктов как небольшие целые числа.
1моль| 3моль| 2моль|
1объем 3объема| 2объема
6. Закон Авогадро(Авогадро, 1811 г.)
В равных объемах различных газов при одинаковых условиях
( давлении и температуре ) содержится одинаковое число структурних единиц газов ( атомов, молекул).
1. Один моль любого вещества содержит число Авогадро ( NA= 6,02 ∙ 10 23 ) структурных единиц независимо от условий.
2. Молярные объемы различных газов при одинаковых условиях равны. При нормальних условиях один моль любого газа занимает объем 22,4 л.
3. Массы равных объемов различных газов при одинаковых условиях относятся как их молекулярные или молярные массы. Это отношение называется относительной плотностью одного газа по другому.
ДВ — относительная плотность газа А по газу В. Это число, которое показывает во сколько раз масса одной структурной единицы ( или моля ) газа А больше массы структурной единицы ( или моля ) газа В.
Внимание ! При решении задач с участием газообразных веществ иногда возникает необходимость перерасчета параметров газа из нормальных условий ( Р0 , Т0 , V0 ; см. выше « Молярный объем ») в условия, отличающиеся от нормальных ( Р , Т , V ) или наоборот.
В подобных случаях используют:
а) объединенное уравнение газового состояния:
б) уравнение Менделеева – Клапейрона :
где – P0 ,V0 , T0 давление, объем, температура при нормальных условиях;
P, V, T — давление, объем, температура при условиях, отличающихся от нормальных
m — масса объема газа (V)
M – молярная масса газа.
R – универсальная газовая постоянная ( значение R изменяется с изменением единиц измерения давления и объема ).
R = 0,082 атм| • л / К
R = 8,314 Па • м 3 / К
R = 62360 мм.рт.ст. • мл / К
ОБРАЗЦЫ РЕШЕНИЯ ЗАДАЧ
Задача №1.Рассчитайте молекулярные и молярные массы веществ: а) Na2SO4 ; б) Zn(OH)2 ; в) Br2 ; г) Mg
Молекулярные массы веществ ( Мr ) рассчитываются по формулам как сумма атомных масс элементов, входящих в формулу, с учетом числа атомов каждого элемента.
а) Мr (Na2SO4 ) = 2 Ar(Na)+ Ar(S)+ 4Ar(O)= 2·23 + 32 + 4·16 = 142
Исходя из определения относительной молекулярной массы ( см. выше по тексту ), это число может не иметь единиц измерения, либо может быть измерено атомными единицами массы ( а.е.м. ).
Молярные массы веществ численно равны молекулярным.
б) Мr( Zn(OH)2) = Ar (Zn ) + 2Ar (O) + 2 Ar(H) = 65 + 2 ·16 + 2·1 = = 99
M (Zn(OH)2 ) = 99 г / моль
в) Мr ( Br2 ) = 2 Ar ( Br) = 2 · 80 = 160
M ( Br2 ) = 160 г / моль
г) Для отдельно взятого атома (Mg ) можно рассчитать только атомную массу.
Молярная масса атомов численно равна его атомной массе.
Ar ( Mg ) = 24 ; М (Mg ) = 24 г/ моль.
Задача №2.Какое количество вещества содержится в 90 г воды ?


приводится формула (1) ν = m (Н2О ) / М ( Н2О) ;
ν Н2О — ? где m ( Н2О ) – масса воды по условию задачи
М ( Н2О ) – молярная масса воды
М ( Н2О ) = 2 · 1 + 16 = 18 г / моль
Подставляя в формулу (1) значения М ( Н2О ) = 18 г/ моль; m (Н2О ) = 90 г рассчитываем число моль Н2О в 90 г .
ν = 90 / 18 = 5 (моль).
Ответ: в 90 г воды содержится 5 моль вещества.
Задача №3. Какой объем займут при нормальных условиях 200 г аммиака NH3 ?


ν (NH3 ) = 200 / 17 = 11,8 ( моль)
Ответ: 200 г аммиака при н. у. будут иметь объем 263,5 л .
Задача № 4. Сколько молекул содержится в 500 г фосфатной кислоты Н3РО4 ?
Внимание!Если в задаче упоминается « число молекул », это значит, что при решении обязательно следует использовать число Авогадро. NA= 6,02 ∙ 10 23 структурных единиц в одном моле вещества.


=200 · 6,02 · 10 23 / 98 = 1,23 · 10 24 ( молекул )
Ответ: в 500 г Н3РО4 содержится 1,23 · 10 24 молекул.
Задача № 5.В сосуде объемом 2 м 3 находится карбон (IV) оксид ( СО2 ) под давлением 3 атмосферы и при температуре 127 0 С . Каким будет объем газа при нормальных условиях ?
Внимание !Если в задаче обсуждается два варианта условий существования газа, то для приведения газа к тем или другим условиям используют объединенное уравнение газового состояния ( см. выше по тексту ).
где – P0 ,V0 , T0 давление, объем, температура при нормальных условиях;
P, V, T — давление, объем, температура при условиях, отличающихся от нормальных

V = 2 м 3 P V T0 = P0 V0 T откуда следует V0 = P V T0 / Р0 Т
t = 127 0 С Прежде чем подставить значение в формулу, необходимо
Р0 = 1 атм перевести температуру из шкалы Цельсия в шкалу Кель-
Т0 = 273 К вина. Т = 127 + 273 = 400 К

Внимание !При подставлении значений в формулы с большим числом параметров пишите единицы измерения каждого параметра. Это предупредит ошибки по причине разнообразия в системе единиц измерения.
Ответ : при нормальных условиях объем газа будет составлять 4,09 м 3 .
Внимание !Для проверки правильности решения ( ориентировочно ) обдумайте, может ли предложенное в задаче изменение условий существования газа привести к такому изменению объема, какое получилось в ответе задачи.
Из условий задачи видно, что давление газа уменьшилось по сравнению с исходным. Это должно привести к увеличению объема. Температура тоже уменьшилась. Но это должно привести к уменьшению объема. Однако, давлении уменьшилось в 3 раза, в то время как температура уменьшилась незначительно. Поэтому следует ожидать увеличения объема. Ответ задачи это подтверждает. Значит решение верно ( ориентировочно ).
Задача № 6.Рассчитайте молярную массу газа, если 20 г его при температуре 700 К и давлении 6,06 · 10 5 Па занимают объем 3,19 л.
Если в задаче наряду с параметрами газа ( P V T ) упоминаются его масса и его молярная масса, то для решения задачи следует использовать уравнение Менделеева – Клапейрона ( см. выше по тексту ).

m газа = 20 г Преобразовав уравнение Менделеева – Клапей-
Т = 700 К рона имеем : P · V · М = m · R · T из которого:
Р = 6,06 · 10 5 Па М = m · R· T / P · V

20 г · 0,082 л · атм / К · 700 К

6,06 · 10 5 Па · 3,19 л
Так как в значении R = 0,082 л · атм / К давление измеряется в атмосферах, то для корректности решения единицы измерения давления газа в условии задачи надо перевести тоже в атмосферы.
1 атм = 1,01 · 10 5 Па. Следовательно Р = 6,06 · 10 5 Па = 6 атм.
20 г · 0,082 л · атм / К · 700 К
Ответ: молярная масса газа 30 г / моль .
Задача № 7. Рассчитайте массу феррум ( III ) гидроксида, который образуется в результате реакции взаимодействия феррум ( III ) сульфата с 3,2 тонны натрий гидроксида. Рассчитать процентный состав Fe2(SO4)3
Если в условии задачи упоминается реакция, то прежде всего следует написать уравнение этой реакции и расставить коэффициенты, чтобы числа атомов каждого элемента были равны в левой и правой частях уравнения. Достижение равенства указывает на то, что закон сохранения массы удовлетворен и уравнение можно использовать для стехиометрических расчетов, т. е. расчетов по массовым соотношениям веществ в реакции. Каждой формуле вещества соответствует масса этого вещества – его молярная масса. Коэффициенты при формуле в уравнении реакции указывают на число молярных масс данного вещества, которые участвуют в реакции. Отсутствие коэффициента соответствует одному молю вещества.


m ( Fe(OH)3 ) — ? 240г 214 г
M (NaOH) =40г/моль 240 т 214 т
M ( Fe(OH)3 ) = 107г/моль




Молярные массы веществ измеряются в граммах, т.е. из уравнения следует, что если в реакцию вступили 240 г NaOH, то образуется 214 г Fe(OH)3 . При сохранении этого соотношения единицы измерения масс могут быть другими: мг, кг, т, в общем случае весовые части.
Так как в условии задачи масса NaOH выражена в тоннах, то целесообразно вести расчет в тоннах. Решая пропорцию имеем:
m ( Fe(OH)3 ) = 3,2 · 214 : 240 = 2,85 (т) Fe(OH)3
Внимание ! Аналогичными расчетами можно определить массы Fe2(SO4)3 и Na2SO4 , которые участвуют в реакции.
Примечание: 1 т = 1 · 10 3 кг = 1 · 10 6 мг
1 мг = 1 · 10 -3 кг = 1 · 10 -6 т
Расчет процентного состава вещества:
Для расчета процентного состава вещества используется только значение молярной массы.
М(Fe2(SO4)3 ) = 56· 2 + 32 · 3 + 16 · 12 = 112 + 96 + 192 = 400 г/моль
1) Процентное содержание Fe : 400 г составляют 100%
Х = 112 · 100/ 400 = 28
Процентное содержание Fe составляет 28%
2) Процентное содержание S : 400 г составляют 100%
У = 96 · 100 / 400 = 24
Процентное содержание S составляет 24 %
3) Процентное содержание О: можно рассчитать: а) аналогично расчетам для Fe и S
400 г составляют 100%
Z = 192 · 100 / 400 = 48
б) если вся масса составляет 100 %, то содержание кислорода можно рассчитать отняв от 100 % содержание Fe и S
100 – 28 – 24 = 48
Процентное содержание О составляет 48 %
Ответ: если с феррум ( III ) сульфатом прореагируют 3,2 т натрий гидроксида, то образуется 2,85 т феррум ( III ) гидроксида.
Задача № 8. Какой объем карбон (IV) оксида ( при н.у.) образуется при термическом разложении ( прокаливании) 5 тонн гидроген карбоната натрия ?


V (CO2) при н.у. — ? 2 · 84 г /моль 22,4 л
M (NaHCO3) = 84 г/моль




По уравнениям реакции можно производить расчеты объемов газообразных веществ помня, что 1 моль газа при нормальных условиях занимает объем 22,4 л. Из уравнения видно, что при разложении 168 г NaHCO3 образуется 22,4 л CO2 . С учетом того, что 1 тонна больше 1 грамма в 10 6 раз, то и образующийся объем CO2 тоже будет в 10 6 раз больше 22,4 л , что составляет 2,24 · 10 7 л.
Решая пропорцию имеем:
V (CO2) = 5 т · 2,24 · 10 7 л : 168 т = 6,7 · 10 5 л
Так как 10 3 л = 1 м 3 , то V (CO2) при н.у. = 6,7 · 10 2 м 3
Ответ: Если разложить при нагревании 5 т NaHCO3 , то объем CO2 измеренный при нормальных условиях составит 6,7 · 10 2 м 3
Внимание ! Аналогичным расчетом можно определить объем выделяющегося при реакции водяного пара.
Примечание: 1 м 3 = 1 · 10 3 л = 1 · 10 6 мл
1 мл = 1 · 10 -3 л = 1 · 10 -6 м 3
Задача № 9.Какую валентность проявляет железо, если для растворения 5,58г его в потребовалось 7,3 г хлоридной кислоты? Какова формула образующегося хлорида железа?
Решение: Согласно закону эквивалентов:
M(Fe) / Э (Fe) = m (HCl) / Э (HCl)
Э(Fe) = m(Fe) · Э(HCl) : m(HCl)
Э (HCl) = M (HCl) = 36,5
Э(Fe) = 5,58 · 36,5 : 7,3 = 27,9
Э(Fe) = M(Fe) / Z ; Z = M(Fe) / Э(Fe) = 55,8 : 27,9 = 2
Ответ: валентность железа равна двум. Химическая формула, образующегося хлорида FeCl2
Задача № 10.Некоторая масса металла, эквивалентная масса которого равна 28 г/моль, вытесняет из кислоты 0,7 л водорода, измеренного при нормальных условиях. Определить массу металла.
Решение: Зная, что эквивалентный объем водорода равен 11,2 л, составляем пропорцию:
28 г металла эквивалентны 11,2 л Н2
Х г металла эквиваленты 0,7 л Н2
Х = 0,7 · 28 : 11,2 = 1.76 г
Ответ: Масса металла равна 1,76 г.
Задача № 11.При сгорании металла образуется 9,43 г его оксида. Молярная масса эквивалента оксида металла равна 17 г/моль. Какая масса металла прореагировала?
Мэ(металла) = Мэ(оксида) – Мэ(кислорода) = 17 – 8 = 9 г/моль
По закону эквивалентов:
m(оксида) / MЭ(оксида) = m(металла) / MЭ (металла)
m(металла) = 9,43 · 9 : 17 = 4,99 г
Ответ: масса металла равна 4,99 г.
Задача № 12.Металл образует два хлорида, содержащих соответственно 73,86% и 84,96% металла. Вычислите молярные массы металла в каждом соединении.
Решение: Вычислим содержание хлора в первом хлориде,приняв массу хлорида за 100% ; 100 – 73,86 = 26,14%, т,е, на 73,86 частей массы металла приходится 26,14 частей хлора или на 73,86 г металла приходится 26,14 г хлора.
Зная, что молярная масса эквивалента хлора равна 35,5 г/моль, можем определить молярную массу эквивалента металла.
В первом хлориде по закону эквивалентов:
m(хлорид иона) / MЭ(хлорид иона) = m(металла) / MЭ (металла)
MЭ (металла 1) = 73,86 · 35,5 : 26,14 = 100,3 г/моль
Аналогично для второго хлорида: на 84,9г металла приходится 15,04 г хлора. Отсюда молярная масса эквивалента металла во втором хлориде равна:
MЭ (металла 2 ) = 84,96 · 35,5 : 15,04 = 200,5 г/моль
Ответ: MЭ (металла 1) = 100,3 г/моль; MЭ (металла 2) = 200,5 г/моль.
Задания для самоконтроля:
№ 1.Какой объем займет SO3 массой 2,2 г (н.у.) ?
№ 2. Где больше молекул в 3 г Н2О или в 4,48 л СО2 ?
Определить массу молекулы карбон (IV) оксида.
№ 3. Какой объем займет карбон (IV) оксид при н.у., если при темпера-
туре 27 0 С и давлении 1,5 атм он занимает объем 1 м 3 ?
№ 4.Вычислить молекулярную массу газа, 50 мл которого при 17 0 С и
780 мм.рт.ст. имеют массу 0,222 г .
№ 5. Какова масса оксида кальция, необходимая для получения
№ 6.Какой объем азота (н.у.) получится при разложении нитрита
аммония массой 193 г ?
№ 7.5,2 г металла взаимодействуют с 3,5 г азота, образуя нитрид.
Какой это металл, если его валентность равна 1, а валентность
№ 8. Вычислить эквивалентную массу металла, зная, что его хлорид
содержит 65,57% хлора.
№ 9. Из 3,85 г нитрата металла получено 1,6 г его гидроксида. Вычислить
Задачи с решениями на эквивалент, эквивалентную массу. Закон эквивалентов
Эквивалент, эквивалентная масса. Закон эквивалентов
Задача:
Определить эквивалентную массу марганца в 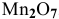
Решение:
По химической формуле определяем валентность марганца: 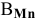
Задача:
Определить эквивалентную массу 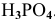
Решение:
Для кислот эквивалентная масса определяется по формуле
Так как число атомов водорода кислоты пн, участвующих в реакции, не указывается, в расчетной формуле принимается максимальное число атомов водорода в кислоте, способных участвовать в реакции: 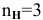
Задача:
Вычислить эквивалентную массу металла, зная, что его хлорид содержит 65,57 % хлора. Эквивалентная масса хлора равна 35,45 г/моль.
Решение:
Так как 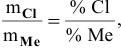
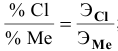
Задача:
5,2 г металла взаимодействуют с 3,5 г азота, образуя нитрид. Какой это металл, если его валентность равна 1, а валентность азота — 3?
Решение:
Согласно закону эквивалентов
Неизвестный металл — литий, с молярной массой, равной 6,9 г/моль.
Задача:
5 г алюминия, взаимодействуя с кислородом, образуют 9,44 г оксида алюминия. Найти эквивалентную массу алюминия и его валентность. Определить химическую формулу оксида алюминия.
Решение:
где
Химическая формула оксида алюминия — 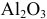
Задача:
Определенное количество металла взаимодействует с 1,78 г серы или с 8,89 г брома. Определить эквивалентную массу брома, если эквивалентная масса серы равна 16 г/моль.
Решение:
Так как количества эквивалентных масс реагирующих между собой веществ равны:
получаем:
или
откуда
Задача:
Какую валентность проявляет железо, если для растворения 5,58 г его потребовалось 7,3 г соляной кислоты? Какова формула образующегося хлорида железа?
Решение:
где 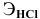
Формула образующегося хлорида — 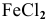
Задача:
Определить количества соляной, уксусной и серной (разбавленной) кислот, необходимые для растворения 10 г цинка (валентность цинка равна 2).
Решение:
Задача:
Составить уравнение реакции взаимодействия гидроксида натрия с ортофосфорной кислотой, если известно, что 8 г NaOH реагируют с 9,8 г фосфорной кислоты без остатка.
Решение:
Кислотность щелочи равна 1, поэтому эквивалентная масса NaOH будет следующей:
Так как основность фосфорной кислоты равна 3, то число атомов водорода, участвующих в реакции, может быть 1, 2 и 3. Для написания уравнения реакции необходимо определить число атомов водорода в фосфорной кислоте 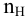
Уравнение химической реакции следующее:
Эти задачи взяты со страницы решения задач по неорганической химии:
Возможно эти страницы вам будут полезны:




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
http://poisk-ru.ru/s4585t8.html
http://lfirmal.com/zadachi-s-resheniyami-na-ekvivalent-ekvivalentnuyu-massu-zakon-ekvivalentov/