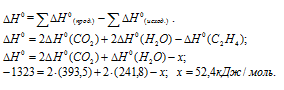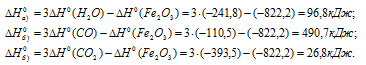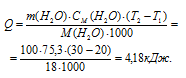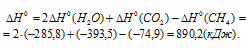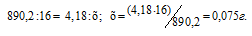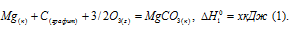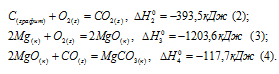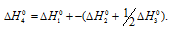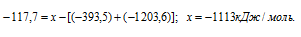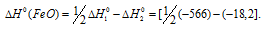Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e1759e23b260100 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
1)Рассчитайте по термохимическому уравнению C₃H₈ + 5O₂⇒3CO₂ + 4H₂O + 2220кДж какое количество теплоты выделится при горении пропана, если израсходовано 16 г?
Химия | 5 — 9 классы
1)Рассчитайте по термохимическому уравнению C₃H₈ + 5O₂⇒3CO₂ + 4H₂O + 2220кДж какое количество теплоты выделится при горении пропана, если израсходовано 16 г.
Кислорода 2)Опредилите массу осадка, образовавшегося в результате окисления 0, 2 моль уксусного альдегида избытком аммиачного раствора оксида серебра.
3)Какой объем оксида углерода(ι∨) выделится при н.
У. в результате взаимодействия соляной кислоты массой 7, 3 г и карбоната натрия?
4)опредилите массу осадка, образовавшегося в результате окисления 0, 2 моль уксусного альдегида избытком аммиачного раствора оксида серебра.
$C_3H_8+5O_2=3CO_2+4H_2O+Q$ 160 г 2220 кДж
при взаимодействии с пропаном 160 г кислорода выделяется 2220 кДж теплоты, а
при — — / / — — / / — — 16 г____________________х кДЖ, откуда
х = 16 * 2220 / 160 = 222 кДж
при взаимодействии 1 моль альдегида образуется 216 г серебра, а
при — — / / — — / / — — 0, 2 моль__________________х г, откуда
х = 0, 2 * 216 / 1 = 432 г
при взаимодействии 73 г кислоты выделяется 22, 4 л углекислого газа, а
при — — / / — — / / — — 7, 3 г__________________х л, откуда
х = 7, 3 * 22, 4 / 73 = 2, 24 л.
При окислении 2, 88 г предельного альдегида избытком аммиачного раствора оксида серебра выделилось 8, 64 г серебра?
При окислении 2, 88 г предельного альдегида избытком аммиачного раствора оксида серебра выделилось 8, 64 г серебра.
Установите молекулярную формулу альдегида.
При окислении 4, 3г альдегида аммиачным раствором оксида серебра выделилось 10, 8г металла?
При окислении 4, 3г альдегида аммиачным раствором оксида серебра выделилось 10, 8г металла.
Назовите альдегид, напишите Соответствующее уравнение.
При окислении альдегида массой 8, 8 г, содержащего одну альдегидную группу, избытком аммиачного раствора оксида серебра (I) образовалось серебро массой 43, 2 г?
При окислении альдегида массой 8, 8 г, содержащего одну альдегидную группу, избытком аммиачного раствора оксида серебра (I) образовалось серебро массой 43, 2 г.
Рассчитайте массу (г) полученной одноосновной кислоты.
Вычислите массу этанола, который был окислен аммиачным раствором оксида серебра, если при этом образовалось 3, 2 моль уксусной кислоты?
Вычислите массу этанола, который был окислен аммиачным раствором оксида серебра, если при этом образовалось 3, 2 моль уксусной кислоты.
Смесь метаналя и бутаналя массой 15, 9г обработали избытком аммиачного раствора оксида серебра?
Смесь метаналя и бутаналя массой 15, 9г обработали избытком аммиачного раствора оксида серебра.
При этом образовалось 64, 8г осадка.
Определите массовую долю муравьиного альдегида а в смеси.
Здравствуйте?
Буду очень признателен за решение) В результате восстановления оксида серебра уксусным альдегидом образовалось 2, 7г серебра.
Какая масса альдегида была при этом окислена ?
Нужна помощь?
При взаимодействии уксусного альдегида массой 0, 66г с избытком аммиачного раствора оксида серебра выпал осадок, масса которого равна_г(ответ записать с точностью до сотых).
Вычислить массу серебра, образовавшегося при взаимодействии 200г 20% — ного раствора формальдегида с избытком аммиачного раствора оксида серебра?
Вычислить массу серебра, образовавшегося при взаимодействии 200г 20% — ного раствора формальдегида с избытком аммиачного раствора оксида серебра.
1)опредилите массу осадка, образовавшегося в результате окисления 0, 2 моль уксусного альдегида избытком аммиачного раствора оксида серебра?
1)опредилите массу осадка, образовавшегося в результате окисления 0, 2 моль уксусного альдегида избытком аммиачного раствора оксида серебра.
2)вычислить массу и количество вещества оксида кальция, полученного при разложении 100грамм карбоната кальция, содержащего 2% примеси.
3)напиши уравнение реакции с помощью которых можно осуществить следующие превращения : Na⇒Na₂O₂⇒Na₂O⇒NaOH⇒Na₂SO₄.
Вычислите образовавшуюся массу уксусной кислоты, если в реакцию с этаналем вступил аммиачный раствор оксида серебра, содержащего 5 моль Ag2?
Вычислите образовавшуюся массу уксусной кислоты, если в реакцию с этаналем вступил аммиачный раствор оксида серебра, содержащего 5 моль Ag2.
Вы находитесь на странице вопроса 1)Рассчитайте по термохимическому уравнению C₃H₈ + 5O₂⇒3CO₂ + 4H₂O + 2220кДж какое количество теплоты выделится при горении пропана, если израсходовано 16 г? из категории Химия. Уровень сложности вопроса рассчитан на учащихся 5 — 9 классов. На странице можно узнать правильный ответ, сверить его со своим вариантом и обсудить возможные версии с другими пользователями сайта посредством обратной связи. Если ответ вызывает сомнения или покажется вам неполным, для проверки найдите ответы на аналогичные вопросы по теме в этой же категории, или создайте новый вопрос, используя ключевые слова: введите вопрос в поисковую строку, нажав кнопку в верхней части страницы.
В электрохимическом ряду напряжений металлов алюминий предшествует железу. В гальванопаре алюминий — железо происходит ускоренная коррозия алюминия : (анод Al, + ) Al⁰ — 3e = Al³⁺ в зависимости от химического состава пресной или морской воды на като..
1)CaCO3 = CaO + CO2 CaO + H2O = Ca(OH)2 Ca(OH)2 + K2CO3 = CaCO3 + 2KOH CaCO3 + 2HNO3 = Ca(NO3)2 + H2CO3 2) 4P + 5O2 = 2P2O5 P2O5 + 3H2O = 2H3PO4 2H3PO4 + 3CaCO3 = Ca3(PO4)2 + 3H2CO3 Ca3(PO4)2 + 6HNO3 = 2H3PO4 + 3Ca(NO3)2.
А) Na > Li Б) Li > Be В) Mg > Al Г) K в группе сверху вниз и в периоде справа налево увеличиваются Металлические свойства.
4) 2 Al + 3S = Al2S3 На 2 моль Al надо 3 моль S На х моль Al — 0. 3 моль S Значит n(Al) = (2•0. 3) / 3 = 0. 2 моль Количество моль Al2S3 по уравнению видно : в три раза меньше, чем серы : 0. 3 / 3 = 0. 1 моль 3) количество вещества серы в три ра..
1. BaSO4 (выпадает в осадок) + 2HCl 2. Fe(NO3)3 + 3AgCl (выпадает в осадок) 3. 2NaOH + BaCO3 (выпадает в осадок).
Сложно не всем понятна легко допустить ошибку огромное кол — во вычислений имеет долю опасности.
Смеси : — Бензин ; — Кровь ; — Зола. Чистые вещества : — Соль ; — Золото.
Cu(OH)2 = CuO + H2O M(Cu(OH)2) = 98г / моль M(CuO) = 80г / моль n(Cu(OH)2) = 196 / 98 = 2моль nCu(OH)2 : nCuO = 1 : 1 n(CuO) = 2моль m(CuO) = 2 * 80 = 160г CuO + H2 = Cu + H2O n(CuO) = 2моль nCuO : nH2 = 1 : 1 n(H2) = 2моль V(H2) = 2 * 22, 4 = 44, 8л..
Гидроксид меди(основание) азотная кислота (кислоты) оксид фосфора 5 класс оксиды гидроксиды алюминия 3 основание оксид плюмбума (оксид).
То, где есть группа ОН – это основания, или гидрооксиды (меди, алюминия), второе – азотная кислота, третье оксид фосфора, последнее – оксид свинца.
Закономерности протекания химических реакций. Теплоты образования веществ
Задача 293.
Определить 
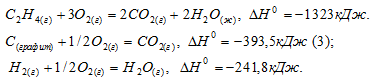
Решение:
Обозначим искомую величину [ 

Ответ: 52,4 кДж/моль.
Задача 294.
Сравнить 
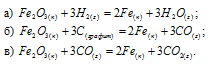
Решение:
По табличным данным стандартные энтальпии образования Fe2O3(к), Н2O(г) и СО(г) соответственно равны -822,2, -241,8, -110,5 и -393,5 кДж/моль (стандартные энтальпии образования простых веществ принято считать равными нулю). Для расчета 
Ответ: а) 96,8 кДж; б) 490,7 кДж; в) 26,8 кДж.
Задача 295.
Найти массу метана, при полном сгорании которой (с образованием жидкой воды) выделяется теплота, достаточная для нагревания 100 г воды от 20 до 30°С. Мольную теплоемкость воды принять равной 75,3Дж/(моль . К).
Решение:
Мольная теплоёмкость (CM) – это количество теплоты, необходимое для нагревания одного киломоля вещества на один градус. Находим количество теплоты необходимое для нагревания 100 г воды от 20 0 С до 30 0 С по формуле:
Табличные данные стандартных энтальпий образования СН4(г), Н2О(ж) и СО2(г) соответственно равны -74,9, -285,8 и -393,5кДж/моль. Стандартные энтальпии простых веществ принято считать равными нулю.
Уравнение реакции горения метана имеет вид:
Стандартную энтальпию реакции рассчитаем, используя уравнение из следствия закона Гесса:
Теперь, учитывая, что при сгорании 1 моля метана выделяется 890,2 кДж теплоты, рассчитаем его массу, которая необходима для выделения 4,18 кДж теплоты из пропорции:
Ответ: 0,075г.
Задача 296.
Вычислить 
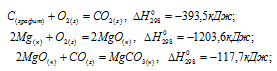
Решение:
Обозначим искомую величину через x, запишем термохимическое уравнение образования MgCO3 из простых веществ:
Затем запишем уравнения реакций образования CO2, MgO и MgCO3 из CO2 и MgO:
Из уравнений (1), (2) и (3) можно получить уравнение (4). Для этого нужно из уравнения (1) вычесть сумму уравнения (2) и ½ уравнения (3), получим:
Подставляя значения энтальпий образования веществ, находим искомую величину:
Ответ: -1113 кДж/моль.
Задача 297.
Исходя из 
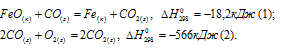
вычислить 
FeO(к) + Н2(г) = Fe(к) + Н2О(г) (3)
Решение:
Так как оксид железа (II) при взаимодействии с оксидом углерода (II) образует железо и оксид углерода (IV), то значение 
Тогда 
http://himia.my-dict.ru/q/1034035_1rasscitajte-po-termohimiceskomu-uravneniu-ch-5o3co/
http://buzani.ru/zadachi/khimiya-glinka/1130-pravila-klechkovskogo-zadachi-175-182