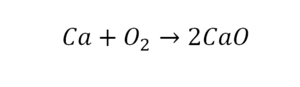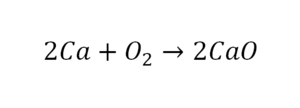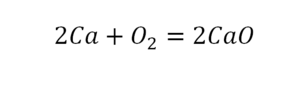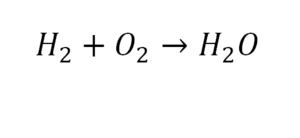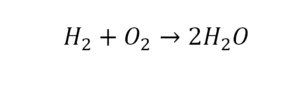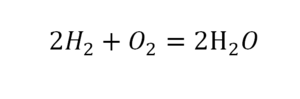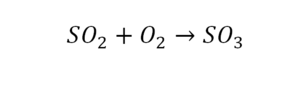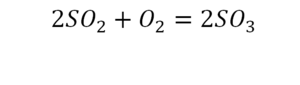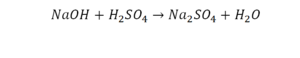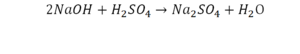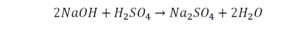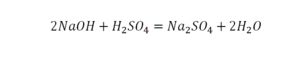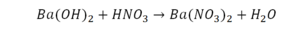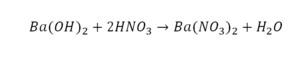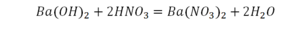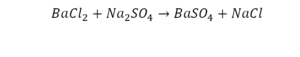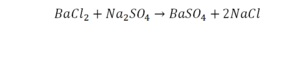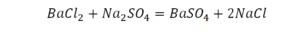Как расставлять коэффициенты в химических уравнениях
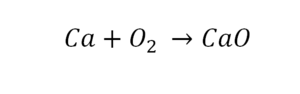
Такая запись является схемой химической реакции. Когда возникает знак «=», то это называется «уравнение». Попробуем его решить.
Пример разбора простых реакций
В кальции один атом, так как коэффициент не стоит. Индекс здесь тоже не написан, значит, единица. С правой стороны уравнения Са тоже один. По кальцию нам не надо работать.
Видео: Коэффициенты в уравнениях химических реакций.
Смотрим следующий элемент — кислород. Индекс 2 говорит о том, что здесь 2 иона кислорода. С правой стороны нет индексов, то есть одна частица кислорода, а с левой — 2 частицы. Что мы делаем? Никаких дополнительных индексов или исправлений в химическую формулу вносить нельзя, так как она написана правильно.
Коэффициенты — это то, что написано перед наименьшей частью. Они имеют право меняться. Для удобства саму формулу не переписываем. С правой части один умножаем на 2, чтобы получить и там 2 иона кислорода.
После того как мы поставили коэффициент, получилось 2 атома кальция. С левой стороны только один. Значит, теперь перед кальцием мы должны поставить 2.
Теперь проверяем итог. Если количество атомов элементов равно с обеих сторон, то можем поставить знак «равно».
Другой наглядный пример: два водорода слева, и после стрелочки у нас тоже два водорода.
Смотрим дальше:
- Два кислорода до стрелочки, а после стрелочки индексов нет, значит, один.
- Слева больше, а справа меньше.
- Ставим коэффициент 2 перед водой.
Умножили всю формулу на 2, и теперь у нас изменилось количество водорода. Умножаем индекс на коэффициент, и получается 4. А с левой стороны осталось два атома водорода. И чтобы получить 4, мы должны водород умножить на два.
Видео: Расстановка коэффициентов в химическом уравнении
Вот тот случай, когда элемент в одной и в другой формуле с одной стороны, до стрелочки.
Один ион серы слева, и один ион — справа. Две частицы кислорода, плюс еще две частицы кислорода. Значит, что с левой стороны 4 кислорода. Справа же находится 3 кислорода. То есть с одной стороны получается четное число атомов, а с другой — нечетное. Если же мы умножим нечетное в два раза, то получим четное число. Доводим сначала до четного значения. Для этого умножаем на два всю формулу после стрелочки. После умножения получаем шесть ионов кислорода, да еще и 2 атома серы. Слева же имеем одну микрочастицу серы. Теперь уравняем ее. Ставим слева уравнения перед серой 2.
Уравняли.
Сложные реакции
Этот пример более сложный, так как здесь больше элементов вещества.
Это называется реакцией нейтрализации. Что здесь нужно уравнивать в первую очередь:
- С левой стороны один атом натрия.
- С правой стороны индекс говорит о том, что здесь 2 натрия.
Напрашивается вывод, что надо умножить всю формулу на два.
Видео: Составление уравнений химических реакций
Теперь смотрим, сколько серы. С левой и правой стороны по одной. Обращаем внимание на кислород. С левой стороны мы имеем 6 атомов кислорода. С другой стороны – 5. Меньше справа, больше слева. Нечетное количество надо довести до четного значения. Для этого формулу воды умножаем на 2, то есть из одного атома кислорода делаем 2.
Теперь с правой стороны уже 6 атомов кислорода. С левой стороны также 6 атомов. Проверяем водород. Два атома водорода и еще 2 атома водорода. То есть будет четыре атома водорода с левой стороны. И с другой стороны также четыре атома водорода. Все элементы уравнены. Ставим знак «равно».
Видео: Химические уравнения. Как составлять химические уравнения.
Здесь пример интересен тем, что появились скобки. Они говорят о том, что если множитель стоит за скобкой, то каждый элемент, стоящий в скобках, умножается на него. Начать необходимо с азота, так как его меньше, чем кислорода и водорода. Слева азот один, а справа, с учетом скобок, его два.
Справа два атома водорода, а нужно четыре. Мы выходим из положения, просто умножая воду на два, в результате чего получили четыре водорода. Отлично, водород уравняли. Остался кислород. До реакции присутствует 8 атомов, после — тоже 8.
Отлично, все элементы уравнены, можем ставить «равно».
Последний пример.
На очереди у нас барий. Он уравнен, его трогать не нужно. До реакции присутствует два хлора, после нее — всего один. Что же нужно сделать? Поставить 2 перед хлором после реакции.
Видео: Балансирование химических уравнений.
Теперь за счет коэффициента, который только что поставлен, после реакции получилось два натрия, и до реакции тоже два. Отлично, все остальное уравнено.
Также уравнивать реакции можно методом электронного баланса. Этот метод имеет ряд правил, по которым его можно осуществлять. Следующим действием мы должны расставить степени окисления всех элементов в каждом веществе для того, чтобы понять где произошло окисление, а где восстановление.
Пров. работа «Расстановка коэффициентов, типы реакций» 8кл.
методическая разработка по химии (8 класс) по теме
Раздаточный материал для проверочной работы-пятиминутки (4варианта). К сожалению, при загрузке полностью изменился вид (на А4 помещены 3 карточки, каждая с 4 вариантами А,Б,В,Г)
Скачать:
| Вложение | Размер |
|---|---|
| 8prkoef._tip.doc | 31 КБ |
Предварительный просмотр:
Расставить коэффициенты в уравнениях реакций, указать тип реакций:
1) SO 2 + O 2 SO 3
2) Al(OH) 3 Al 2 O 3 + H 2 O
3) FeСl 3 + Zn ZnCl 2 + Fe
4) KOH + HNO 3 KNO 3 + H 2 O
5) CuO + HCl CuCl 2 + H 2 O
Расставить коэффициенты в уравнениях реакций, указать тип реакций:
1) Cr(OH) 3 Cr 2 O 3 + H 2 O
2) CO + O 2 CO 2
3) K + H 3 PO 4 K 3 PO 4 + H 2
4) MgO + H 2 SO 4 MgSO 4 + H 2 O
5) Ba(OH) 2 + HNO 3 Ba(NO 3 ) 2 + H 2 O
Расставить коэффициенты в уравнениях реакций, указать тип реакций:
1) SO 2 + O 2 SO 3
2) Al(OH) 3 Al 2 O 3 + H 2 O
3) FeСl 3 + Zn ZnCl 2 + Fe
4) KOH + HNO 3 KNO 3 + H 2 O
5) CuO + HCl CuCl 2 + H 2 O
Расставить коэффициенты в уравнениях реакций, указать тип реакций:
1) Cr(OH) 3 Cr 2 O 3 + H 2 O
2) CO + O 2 CO 2
3) K + H 3 PO 4 K 3 PO 4 + H 2
4) MgO + H 2 SO 4 MgSO 4 + H 2 O
5) Ba(OH) 2 + HNO 3 Ba(NO 3 ) 2 + H 2 O
Расставить коэффициенты в уравнениях реакций, указать тип реакций:
1) SO 2 + O 2 SO 3
2) Al(OH) 3 Al 2 O 3 + H 2 O
3) FeСl 3 + Zn ZnCl 2 + Fe
4) KOH + HNO 3 KNO 3 + H 2 O
5) CuO + HCl CuCl 2 + H 2 O
Расставить коэффициенты в уравнениях реакций, указать тип реакций:
1) Cr(OH) 3 Cr 2 O 3 + H 2 O
2) CO + O 2 CO 2
3) K + H 3 PO 4 K 3 PO 4 + H 2
4) MgO + H 2 SO 4 MgSO 4 + H 2 O
5) Ba(OH) 2 + HNO 3 Ba(NO 3 ) 2 + H 2 O
Б
Расставить коэффициенты в уравнениях реакций, указать тип реакций:
1) NaOH + H 2 SO 4 Na 2 SO 4 + H 2 O
2) Fe 2 O 3 + H 2 Fe + H 2 O
3) NO + O 2 NO 2
4) FeO + H 2 SO 4 FeSO 4 + H 2 O
5) CuOH Cu 2 O + H 2 O
Расставить коэффициенты в уравнениях реакций, указать тип реакций:
1) ZnO + HNO 3 Zn(NO 3 ) 2 + H 2 O
2) Fe(OH) 3 Fe 2 O 3 + H 2 O
3) Al + HCl AlCl 3 + H 2
4) HCl + AgNO 3 AgCl + HNO 3
5) N 2 + H 2 NH 3
Расставить коэффициенты в уравнениях реакций, указать тип реакций:
1) NaOH + H 2 SO 4 Na 2 SO 4 + H 2 O
2) Fe 2 O 3 + H 2 Fe + H 2 O
3) NO + O 2 NO 2
4) FeO + H 2 SO 4 FeSO 4 + H 2 O
5) CuOH Cu 2 O + H 2 O
Расставить коэффициенты в уравнениях реакций, указать тип реакций:
1) ZnO + HNO 3 Zn(NO 3 ) 2 + H 2 O
2) Fe(OH) 3 Fe 2 O 3 + H 2 O
3) Al + HCl AlCl 3 + H 2
4) HCl + AgNO 3 AgCl + HNO 3
5) N 2 + H 2 NH 3
Расставить коэффициенты в уравнениях реакций, указать тип реакций:
1) NaOH + H 2 SO 4 Na 2 SO 4 + H 2 O
2) Fe 2 O 3 + H 2 Fe + H 2 O
3) NO + O 2 NO 2
4) FeO + H 2 SO 4 FeSO 4 + H 2 O
5) CuOH Cu 2 O + H 2 O
Расставить коэффициенты в уравнениях реакций, указать тип реакций:
1) ZnO + HNO 3 Zn(NO 3 ) 2 + H 2 O
2) Fe(OH) 3 Fe 2 O 3 + H 2 O
3) Al + HCl AlCl 3 + H 2
4) HCl + AgNO 3 AgCl + HNO 3
5) N 2 + H 2 NH 3
По теме: методические разработки, презентации и конспекты
Мастер-класс по химии «Расстановка коэффициентов в химических уравнениях»
Данный мастер класс был представлен мной в рамках городского конкурса «Педагог года 2009», на котором в результате я заняла 1 место.
Презентация «Упражнение в расстановке коэффициентов методом электронного баланса»
В презентации представлен алгоритм расстановки коэффициентов методом электронного баланса, а также 18 схем реакций для упражнений в расстановке коэффициентов с проверкой.
Исследование связи между корнями и коэффициентами квадратного уравнения.
Конспект урока по теме «Исследование связи между корнями и коэффициентами квадратного уравнения» — урок обобщения знаний. Содержит различные виды и формы работ. Основной форм является мини — исс.
Сценарий урока на тему: «Коэффициент трения скольжения»
Работа представляет собой сценарий урока по физике в 10 классе на тему «Коэффициент трения скольжения». Применяется для изучения новой темы.
положение о пров. дня здоровья
положение о пров. дня здоровья.
Пров. раб. «Важнейшие классы неорганических веществ» 8 класс
Раздаточный материал для пров. работы. Цель: проверка умений определять формулы оксидов, кислот, оснований, солей; знание номенклатуры.
Особая опасность провала под лед.
Ежегодно ГИМС напоминает об опасности выезда и выхода на лед. Особенно в весенние месяцы, когда начинается активное таянье снега.В апреле движение по льду на автом.
Урок по химии на тему расстановка коэффициентов в уравнениях химических реакций» (8 кл.)
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Расстановка коэффициентов в уравнениях химических реакций
Учитель химии МБОУ ОСОШ №2
Володченко Светлана Николаевна
РАССТАНОВКА КОЭФФИЦИЭНТОВ В УРАВНЕНИЯХ ХИМИЧЕСКИХ РЕАКЦИЙ
Число атомов одного элемента в левой части уравнения должно быть равно числу атомов этого элемента в правой части уравнения.
Задание 1 (для групп). Определите число атомов каждого химического элемента, участвующего в реакции.
1. Вычислите число атомов:
а ) водорода : 8NH3, NaOH, 6NaOH, 2NaOH, НзРО 4, 2H2SO4, 3H2S04, 8H2SO4;
6) кислорода : C02, 3C02, 2C02, 6CO,, H2SO4, 5H2SO4, 4H2S04, HN03.
2. Вычислите число атомов: а) водорода:
1) NaOH + HCl 2)CH4+H20 3)2Na+H2
1) 2СО + 02 2) С02 + 2Н.О. 3)4NO2 + 2H2O + O2
Алгоритм расстановки коэффициентов в уравнениях химических реакций
2. Среди элементов с разным числом атомов в левой и правой частях схемы выбрать тот, число атомов которого больше
О-3 атома справа
3. Найти наименьшее общее кратное (НОК) числа атомов этого элемента в левой части уравнения и числа атомов этого элемента в правой части уравнения
4. Разделить НОК на число атомов этого элемента в левой части уравнения, получить коэффициент для левой части уравнения
5. Разделить НОК на число атомов этого элемента в правой части уравнения, получить коэффициент для правой части уравнения
6. Если выставленный коэффициент изменил число атомов еще какого-либо элемента, то действия 3, 4, 5 повторить еще раз.
А1 -1 атом А1 — 4
. Первичная проверка усвоения знаний(8-10 мин .).
. В левой части схемы два атома кислорода, а в правой — один. Число атомов нужно выровнять с помощью коэффициентов.
2) СаСО 3 + 2HCl→ СаСl 2 + Н 2 О + СО 2 ↑
Задание 2 Расставьте коэффициенты в уравнениях химических реакций (обратите внимание, что коэффициент изменяет число атомов только одного элемента ):
1.Что такое уравнение химической реакции?
2.Что записывают в правой части уравнения? А в левой?
3.Что означает знак «+» в уравнении?
4. Зачем расставляют коэффициенты в уравнениях хим
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 924 человека из 80 регионов
Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 20 человек из 11 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Курс добавлен 23.11.2021
- Сейчас обучается 35 человек из 23 регионов
Ищем педагогов в команду «Инфоурок»
Дистанционные курсы для педагогов
«Взбодрись! Нейрогимнастика для успешной учёбы и комфортной жизни»
Свидетельство и скидка на обучение каждому участнику
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 579 772 материала в базе
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
Другие материалы
- 18.04.2016
- 3913
- 11
- 18.04.2016
- 1154
- 7
- 18.04.2016
- 1439
- 5
- 18.04.2016
- 5565
- 27
- 18.04.2016
- 647
- 0
- 18.04.2016
- 1337
- 5
- 18.04.2016
- 1008
- 0
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 18.04.2016 3309
- DOCX 24.3 кбайт
- 66 скачиваний
- Оцените материал:
Настоящий материал опубликован пользователем Володченко Светлана Николаевна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 5 лет и 10 месяцев
- Подписчики: 0
- Всего просмотров: 17703
- Всего материалов: 7
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
РДШ организовало сбор гуманитарной помощи для детей из ДНР
Время чтения: 1 минута
В Воронеже продлили удаленное обучение для учеников 5-11-х классов
Время чтения: 1 минута
Минпросвещения упростит процедуру подачи документов в детский сад
Время чтения: 1 минута
В Забайкалье в 2022 году обеспечат интернетом 83 школы
Время чтения: 1 минута
Объявлен конкурс дизайн-проектов для школьных пространств
Время чтения: 2 минуты
В Ростовской и Воронежской областях организуют обучение эвакуированных из Донбасса детей
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
http://nsportal.ru/shkola/khimiya/library/2014/03/30/prov-rabota-rasstanovka-koeffitsientov-tipy-reaktsiy-8kl
http://infourok.ru/urok-po-himii-na-temu-rasstanovka-koefficientov-v-uravneniyah-himicheskih-reakciy-kl-1039155.html