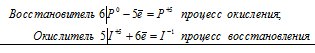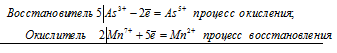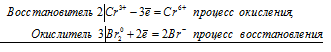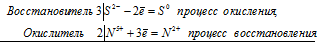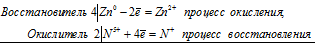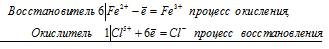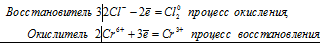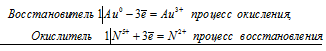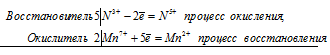Расставьте коэффициенты методом электронного баланса. KNO2 + KMnO4 + H2O → MnO2 + KNO3 + KOH
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,296
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,203
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
На основании электронных уравнений расставьте коэффициенты в уравнениях реакций, идущих по схемам: KMnO4 KOH K2 SO3 K2MnO4 H2O K2 SO4 S HNO3 H2 SO4 NO
| 🎓 Заказ №: 22173 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
На основании электронных уравнений расставьте коэффициенты в уравнениях реакций, идущих по схемам: KMnO4 KOH K2 SO3 K2MnO4 H2O K2 SO4 S HNO3 H2 SO4 NO Для каждой реакции укажите, какое вещество является окислителем. Какое – восстановителем; какое вещество окисляется, какое восстанавливается.
Решение: 6 4 2 2 4 6 2 4 2 3 7 4 KMnO KOH K SO K MnO H O K SO В ходе данной окислительно-восстановительной реакции степень окисления марганца понижается от +7 до +6, а степень окисления серы повышается от +4 до +6 7 6 Mn e Mn 2 восстановление KMnO4 – окислитель 4 6 2 S e S 1 окисление K2SO3 – восстановитель 2KMnO4 KOH K2 SO3 2K2MnO4 H2O K2 SO4 В правой части 6 атомов калия, в левой части 5 атомов калия. Для уравнивания ставим перед формулой KOH коэффициент 2.
Научись сам решать задачи изучив химию на этой странице:
|
Услуги:
|
Готовые задачи по химии которые сегодня купили:




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Как правильно расставить коэффициенты в уравнении реакции окисления-восстановления
Решение задач на составление уравнений окислительно-восстановительных реакций
Задание 231.
Реакции выражаются схемами:
Р + НClО3 + Н2О ⇔ Н3РО4 + НCl;
Н3AsO3 + KMnO4 +Н2SO4 ⇔ Н3AsO4 + K2SO4 + MnSO4 + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
а)Р + НClО 3 + Н 2О ⇔ Н 3РО 4 + НCl;
уравнения электронного баланса:
6P 0 + 5I +5 = 6P +5 + I -1
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов тридцать. Разделив это число на 6, получаем коэффициент 5 для окислителя и продукта его восстановления, а при делении 30 на 5 получаем коэффициент 6 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: P – восстановитель, НIО3 – окислитель; P окисляется до Н3PO4, НIО3 – восстанавливается до HI.
5As 3+ + 2Mn 7+ = 5As 5+ + 2Mn 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов десять. Разделив это число на 5, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
5Н 3 AsO 3 +2KMnO 4 + 3Н 2 SO 4 ⇔ 5Н 3 AsO 4 + K 2 SO 4 + 2MnSO 4 + 3H 2 O
В данной реакции: Н 3 AsO 3 – восстановитель, KMnO 4 – окислитель; Н 3 AsO 3 окисляется до Н 3 AsO 4, KMnO 4 – восстанавливается до MnSO 4.
Задание 232.
Реакции выражаются схемами:
NaCrO2 + Br2 + NaOH ⇔ Na2CrO4 + NaBr + H2O
FeS + HNO3 ⇔ Fe(NO3)2 + S + NO + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
2Cr 3+ + 3Br2 0 = 2Cr 6+ + 6Br —
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 2, получаем коэффициент 3 для окислителя и продукта его восстановления, а при делении 6 на 3 получаем коэффициент 2 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: NaCrO2 – восстановитель, Br2 – окислитель; NaCrO2 окисляется до Na2CrO4, Br2 – восстанавливается до NaBr.
3S 2- + 2N 5+ = 3S 0 + 2N 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 3, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 6 на 2 получаем коэффициент 3 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: FeS – восстановитель, HNO3 – окислитель; FeS окисляется до S, HNO3 – восстанавливается до NO.
Задание 233.
Реакции выражаются схемами:
HNO3 + Zn ⇔ N2O + Zn(NO3)2 + H2O;
FeSO4 + KClO3 + H2SO4 ⇔ Fe2(SO4)3 + KCl + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
4Zn 0 + 2N 5+ = 4Zn 2+ + 2N +
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов восемь. Разделив это число на 4, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 8 на 2 получаем коэффициент 4 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: Zn – восстановитель, HNO3 – окислитель; Zn окисляется до Zn(NO3)2, HNO3 – восстанавливается до N2O.
6Fe 2+ + Cl 5+ = 6Fe 3+ + Cl —
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 6, получаем коэффициент 1 для окислителя и продукта его восстановления, а при делении 6 на 1 получаем коэффициент 6 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: FeSO4 – восстановитель, KClO3 – окислитель; FeSO4 окисляется до Fe2(SO4)3, KClO3 – восстанавливается до KCl.
Задание 234.
Реакции выражаются схемами:
K2Cr2O7 + HCl ⇔ Cl2 + CrCl3 + KCl + H2O;
Au + HNO3 + HCl ⇔ AuCl3 + NO + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
2Cr 6+ + 6Cl — = 2Cr 3+ + 3Cl2 0
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 3, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 6 на 2 получаем коэффициент 3 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: HCl – восстановитель, K2Cr2O7 – окислитель; HCl окисляется до Сl2, K2Cr2O7 – восстанавливается до CrCl3.
Au 0 + N 5+ = Au 3+ + N 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Здесь число отданных электронов и число принятых электронов равно 3, поэтому коэффициенты при восстановителе и окислителе, и перед продуктами окисления и восстановления равны 1. Молекулярное уравнение реакции:
В данной реакции: Au – восстановитель, HNO3 – окислитель; Au окисляется до AuCl3, HNO3 – восстанавливается до NO.
Задание 235.
Могут ли происходить окислительно-восстановительные реакции между веществами: а) NH3 и КМnO4 б) HNO2 и HI; в) НСI и Н2S? Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме:
КМnO4 + КNO2 + Н2SO4 ⇔ МnSO4 + КNO3 + К2SO4 + Н2O
Решение:
а) Степень окисления в NH3 n(N) = -3 (низшая); в KMnO4 n(Mn) = +7 (высшая). Так как азот находится в своей низшей степени окисления, а марганец – в своей высшей степени окисления, то взятые вещества могут взаимодействовать друг с другом, причём NH3 является окислителем, а KMnO4 – восстановителем.
б) в HNO2 n(N) = +3 (промежуточная); в HI n(I) = -1 (низшая). Следовательно, взаимодействие этих веществ возможно, причем HI является окислителем, а HNO2 – восстановителем.
в) в HCl n(Cl) = -1 (низшая); в H2S n(S) = -2 (низшая). Так как и хлор, и сера находятся в своей низшей степени окисления, то оба вещества проявляют только восстановительные свойства и взаимодействовать друг с другом не могут.
г) КМnO4 + КNO2 + Н2SO4 ⇔ МnSO4 + КNO3 + К2SO4 + Н2O
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
2Mn 7+ + 5N 3+ = 2Mn 2+ + 5N 5+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов десять. Разделив это число на 5, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
http://lfirmal.com/%D0%9D%D0%B0-%D0%BE%D1%81%D0%BD%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B8-%D1%8D%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%BD%D0%BD%D1%8B%D1%85-%D1%83%D1%80%D0%B0%D0%B2%D0%BD%D0%B5%D0%BD%D0%B8%D0%B9-%D1%80-71/
http://buzani.ru/zadachi/khimiya-shimanovich/936-okislitelno-vosstanovitelnye-reaktsii-zadaniya-231-235