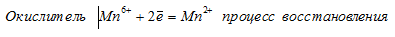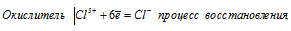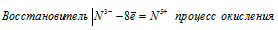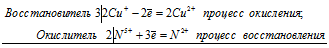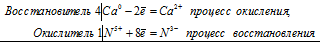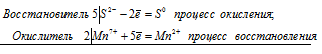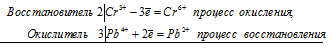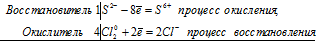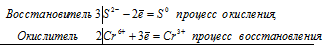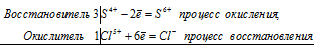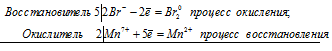Задачи к разделу Окислительно-восстановительные реакции
В данном разделе собраны задачи по теме Окислительно-восстановительные реакции. Приведены примеры задач на составление уравнений реакций, нахождение окислительно-восстановительного потенциал, и константы равновесия ОВР и другие.
Задача 1. Какие соединения и простые вещества могут проявлять только окислительные свойства? Выберите такие вещества из предложенного перечня: NH3, CO, SO2, K2MnO4, Сl2, HNO2. Составьте уравнение электронного баланса, расставьте коэффициенты в уравнении реакции:
Решение.
Простые вещества, атомы которых не могут отдать электрон, а могут только присоединить его в реакциях являются только окислителями. Из простых веществ только окислителем может быть фтор F2, атомы которого имеют наивысшую электроотрицательность. В сложных соединениях – если атом, входящий в состав этого соединения (и меняющий степень окисления) находится в своей наивысшей степени окисления, то данное соединение будет обладать только окислительными свойствами.
Из предложенного списка соединений, нет веществ, которые обладали бы только окислительными свойствами, т.к. все они находятся в промежуточной степени окисления.
Наиболее сильный окислитель из них – Cl2, но в реакциях с более электроотрицательными атомами будет проявлять восстановительные свойства.
Составим электронные уравнения:
N +5 +3e — = N +2 | 8 окислитель
S -2 — 8e — = S +6 | 3 восстановитель
Сложим два уравнения
8N +5 +3S -2 — = 8N +2 + 3S +6
Подставим коэффициенты в молекулярное уравнение:
Задача 2. Почему азотистая кислота может проявлять как окислительные, так и восстановительные свойства? Составьте уравнения реакций HNO2: а) с бромной водой; б) с HI; в) с KMnO4. Какую функцию выполняет азотистая кислота в этих реакциях?
Решение.
HN +3 O2 — Степень окисления азота в азотистой кислоте равна +3 (промежуточная степень окисления). Азот в этой степени окисления может как принимать, так и отдавать электроны, т.е. может являться как окислителем, так восстановителем.
N +3 – 2 e = N +5 | 1 восстановитель
Br2 0 + 2 e = 2Br — | 1 окислитель
N +3 + Br2 = N +5 + 2Br —
б) HNO2 + 2HI = I2 + 2NO + 2H2O
N +3 + e = N +2 | 1 окислитель
2I — — 2 e = I 2 | 1 восстановитель
N +3 + 2I — = N +2 + I2
N +3 – 2 e = N +5 | 5 восстановитель
Mn +7 + 5 e = Mn +2 | 2 окислитель
5N +3 + 2Mn +7 = 5N +5 + 2Mn +2
Задача 3. Определите степени окисления всех компонентов, входящих в состав следующих соединений: HСl, Cl2, HClO2 , HClO3 , Cl2O7 . Какие из веществ являются только окислителями, только восстановителями, и окислителями и восстановителями? Расставьте коэффициенты в уравнении реакции:
КСlO3 → КС1 + КСlO4.
Укажите окислитель и восстановитель.
Решение.
Хлор может проявлять степени окисления от -1 до +7.
Соединения, содержащие хлор в его высшей степени окисления, могут быть только окислителями, т.е. могут только принимать электроны.
Соединения, содержащие хлор в его низшей степени окисления, могут быть только восстановителями, т.е. могут только отдавать электроны.
Соединения, содержащие хлор в его промежуточной степени окисления, могут быть как восстановителями, так и окислителями, т.е. могут отдавать, так и принимать электроны.
H +1 Сl -1 , Cl 0 2, H +1 Cl +3 O2 -2 , H +1 Cl +5 O3 -2 , Cl2 +7 O7 -2
Таким образом, в данном ряду
Только окислитель — Cl2O7
Только восстановитель – HСl
Могут быть как окислителем, так и восстановителем — Cl2, HClO2 , HClO3
КСlO3 → КС1 + КСlO4.
Составим электронные уравнения
Cl +5 +6e — = Cl — | 2 | 1 окислитель
Cl +5 -2e — = Cl +7 | 6 | 3 восстановитель
Расставим коэффициенты
4Cl +5 = Cl — + 3Cl +7
Задача 4. Какие из приведенных реакций являются внутримолекулярными? Расставьте коэффициенты в уравнениях реакций. Укажите восстановитель, окислитель.
Решение.
В реакциях внутримолекулярного окисления-восстановления перемещение электронов происходит внутри одного соединения, т.е. и окислитель и восстановитель входят в состав одного и того же сложного вещества (молекулы)
а) 2KNO3 = 2KNO2 + O2 — внутримолекулярная ОВР
N +5 +2e — = N +3 | 2 окислитель
2 O -2 -4 e — = O2 0 | 1 восстановитель
2N +5 + 2O -2 = 2N +3 + O2 0
б) 3Mq + N2 = Mq3N2 — межмолекулярная ОВР
N2 +6e — = 2N -3 | 2 | 1 окислитель
Mg 0 -2 e — = Mg +2 | 6 | 3 восстановитель
N2 + 3Mg 0 = 2N -3 + 3Mg +2
в) 2KClO3 = 2KCl + 3O2 — внутримолекулярная ОВР
Cl +5 +6e — = Cl — | 4 | 2 окислитель
2 O -2 -4 e — = O2 0 | 6 | 3 восстановитель
2Cl +5 + 6O -2 = 2Cl — + 3O2 0
Задача 5. Какие ОВР относятся к реакциям диспропорционирования? Расставьте коэффициенты в реакциях:
а) Cl2 + KOH = KCl + KClO3 + H2O;
б) KClO3 = KCl + KClO4 .
Решение.
В реакциях диспропорционирования окислителем и восстановителем являются атомы одного и того же элемента в одинаковой степени окисления (обязательно промежуточной). В результате образуются новые соединения, в которых атомы этого элемента обладают различной степенью окисления.
а) 3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O;
Cl2 0 +2e — = 2Cl — | 10| 5 окислитель
Cl2 0 -10e — = 2Cl +5 | 2 | 1 восстановитель
5Cl2 0 + Cl2 0 = 10Cl — + 2Cl +5
3Cl2 0 = 5Cl — + Cl +5
б) 4KClO3 = KCl + 3KClO4
Cl +5 +6e — = Cl — | 2 | 1 окислитель
Cl +5 -2 e — = Cl +7 | 6 | 3 восстановитель
4Cl +5 = Cl — + 3Cl +7
Задача 6. Составьте электронные уравнения и подберите коэффициенты ионно-электронным методом в реакции
Решение.
MnO4 — + 8H + +5e — = Mn 2+ + 4H2O | 2 окислитель
NO2 — + H2O — 2e — = NO3 — + 2H + | 5 восстановитель
Сложим две полуреакции, умножив каждую на соответствующий коэффициент:
После сокращения идентичных членов, получаем ионное уравнение:
Подставим коэффициенты в молекулярное уравнение и уравняем его правую и левую части:
Задача 7. Определите методом электронного баланса коэффициенты в уравнениях окислительно-восстановительных реакций:
Решение.
Составим электронные уравнения
Zn 0 – 2 e = Zn 2+ | 8 | 4 | восстановитель
N +5 + 8 e = N 3- | 2 | 1 | окислитель
4Zn 0 + N +5 = 4Zn 2+ + N 3-
Составим электронные уравнения
Zn 0 – 2 e = Zn 2+ | 2 | 1 восстановитель
S +6 + 2 e = S +4 | 2 | 1 окислитель
Zn 0 + S +6 = Zn 2+ + S +4
Задача 8. Можно ли в качестве окислителя в кислой среде использовать K2Cr2O7 в следующих процессах при стандартных условиях:
а) 2F — -2e — = F2, E 0 = 2,85 В
б) 2Сl — -2e — = Cl2, E 0 = 1,36 В
в) 2Br — -2e — = Br2, E 0 = 1,06 В
г) 2I — -2e — = I2, E 0 = 0,54 В
Стандартный окислительно-восстановительный потенциал системы
Cr2O7 2- + 14H + + 6e — = 2Cr 3+ + 7H2O равен E 0 =1,33 В
Решение.
Для определения возможности протекания ОВР в прямом направлении необходимо найти ЭДС гальванического элемента:
ЭДС = Е 0 ок — Е 0 восст
Если найденная величина ЭДС > 0, то данная реакция возможна.
Итак, определим, можно ли K2Cr2O7 использовать в качестве окислителя в следующих гальванических элементах:
Таким образом, в качестве окислителя дихромат калия можно использовать только для процессов:
2Br — -2e — = Br2 и 2I — -2e — = I
Задача 9. Вычислите окислительно-восстановительный потенциал для системы
MnO4 — + 8H + +5e — = Mn 2+ + 4H2O
Если С(MnO4 — )=10 -5 М, С(Mn 2+ )=10 -2 М, С(H + )=0,2 М.
Решение.
Окислительно-восстановительный потенциал рассчитывают по уравнению Нернста:
В приведенной системе в окисленной форме находятся MnO4 — и H + , а в восстановленной форме — Mn 2+ , поэтому:
E = 1,51 + (0,059/5)lg(10 -5 *0,2/10 -2 ) = 1,46 В
Задача 10. Рассчитайте для стандартных условий константу равновесия окислительно-восстановительной реакции:
Решение.
Константа равновесия K окислительно-восстановительной реакции связана с окислительно-восстановительными потенциалами соотношением:
lgK = (E1 0 -E2 0 )n/0,059
Определим, какие ионы в данной реакции являются окислителем и восстановителем:
MnO4 — + 8H + +5e — = Mn 2+ + 4H2O | 2 окислитель
Br — + H2O — 2e — = HBrO + H + | 5 восстановитель
Общее число электронов, принимающих участие в ОВР n = 10
E1 0 (окислителя) = 1,51 В
E2 0 (восстановителя) = 1,33 В
Подставим данные в соотношение для К:
lgK = (1,51 — 1,33 )10/0,059
K = 3,22*10 30
Примеры ОВР с ответами приведены также в разделе тест Окислительно-восстановительные реакции
Расставьте коэффициенты в уравнениях окислительно восстановительных
Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой:
Определите окислитель и восстановитель.
1) Составлен электронный баланс:
2) Расставлены коэффициенты в уравнении реакции:
3) Указано, что сера в степени окисления +6 является окислителем, а иод в степени окисления −1 — восстановителем.
Но кислород — тоже меняет свой заряд, можно его вместо йода выписать? Это ошибка?
Кислород остается в степени окисления -2
Почему там — 2 электрона?
потому что два йода.
Используя метод электронного баланса, составьте уравнение реакции по схеме:
Определите окислитель и восстановитель
1) Составим электронный баланс:
2) Определены коэффициенты, и составлено уравнение реакции:
3) Указаны окислитель и восстановитель:
окислитель — восстановитель —
Методы составления уравнений окислительно-восстановительных реакций
Решение задач по химии на определение коэффициентов в уравнении реакции методом электронного баланса
Задание 226.
Составьте электронные уравнения и укажите, какой процесс — окисление или восстановление — происходит при следующих превращениях:
Мn 6+ ⇔ Мn 2+ ; С1 5+ ⇔ С l- ; N 3- ⇔ N 5+ . На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме:
Сu2O + HNO3 ⇔ Cu(NO3)2 + NO + H2O.
Решение:
При превращении Мn 6+ ⇔ Мn 2+ происходит процесс восстановления (присоединение электронов).
При превращении С1 5+ ⇔ С l- происходит процесс восстановления (присоединение электронов).
При превращении N 3- ⇔ N 5+ происходит процесс окисления (отдача электронов).
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях:
6Сu + + 2N 5+ = 6Cu 2+ + 2N 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 3, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 6 на 2 получаем коэффициент 3 для восстановителя и продукта его окисления. Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором. Молекулярное уравнение реакции:
Задание 227.
Реакции выражаются схемами:
HNO3 + Ca ⇔ NH4NO3 + Ca(NO3)2 + H2O;
K2S + KMnO4 +Н2SO4 ⇔ S + K2SO4 + MnSO4 + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
4Са 0 + N 5+ = 4Са 2+ + N 3-
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов восемь. Разделив это число на 8, получаем коэффициент 1 для окислителя и продукта его восстановления, а при делении 8 на 2 получаем коэффициент 4 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: Са – восстановитель, HNO3 – окислитель; Са окисляется до Ca(NO3)2, HNO3 – восстанавливается до NH4NO3.
5S 2- + 2Mn 7+ ⇔ 5S 0 + 2Mn 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов десять. Разделив это число на 5, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: К2S – восстановитель, KMnO4 – окислитель; К2S окисляется до К2SO4, KMnO4 – восстанавливается до MnSO4.
Задание 228.
Исходя из степени окисления хрома, йода и серы в соединениях К2Cr2O7, КI и Н2SO4, определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
NaCrO 2 + РbO 2 + NаОН ⇔ Na 2 CrO 4 + Na 2 PbO 2 + Н 2 O
Решение:
а) Степень окисления хрома, йода и серы в указанных соединениях соответственно равна +6 (высшая), -1 (низшая) и +6 (высшая). Отсюда: К2Cr2O7 только окислитель; КI — только восстановитель; Н2SO4 — только окислитель.
б) NaCrO 2 + РbO 2 + NаОН ⇔ Na 2 CrO 4 + Na 2 PbO 2 + Н 2 O
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
2Сr 3+ + 3Pb 4+ ⇔ 2Сr 6+ + Pb 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 2, получаем коэффициент 3 для окислителя и продукта его восстановления, а при делении 6 на 3 получаем коэффициент 2 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
Задание 229.
Реакции выражаются схемами:
H2S + Cl2 + H2O ⇔ H2SO4 + HCl
K 2Cr 2O 7 + H 2 S + Н 2 SO 4 ⇔ S + Cr 2 (SO 4 ) 3 + K 2 SO 4 + H 2 O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
Уравнения электронного баланса:
S -2 + 4Cl2 0 ⇔ S +6 + 8Cl -1
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов восемь. Разделив это число на 2, получаем коэффициент 4 для окислителя и продукта его восстановления, а при делении 8 на 8 получаем коэффициент 1 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: Н2S – восстановитель, Cl2 – окислитель; Н2S окисляется до Н2SO4, Cl2 – восстанавливается до HCl.
б) K 2Cr 2O 7 + H 2 S + Н 2 SO 4 ⇔ S + Cr 2 (SO 4 ) 3 + K 2 SO 4 + H 2 O
3S 2- + 2Cr 6+ ⇔3S 0 + 2Cr 3+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 3, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 6 на 3 получаем коэффициент 2 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
Задание 230.
Реакции выражаются схемами:
KClO3 + Na2SO3 ⇔ KCl + Na2SO4;
KMnO4 + HBr ⇔ Br2 + KBr + MnBr2 + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
3S 4+ + Cl 5+ = 3S 6+ + Cl —
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 6, получаем коэффициент 1 для окислителя и продукта его восстановления, а при делении 6 на 2 получаем коэффициент 3 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: Na2SO3 – восстановитель, KClO3 – окислитель; Na2SO3 окисляется до Na2SO4, KClO3 – восстанавливается до KCl.
10Br — + 2Mn 7+ ⇔ 5Br2 0 + 2Mn 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов десять. Разделив это число на 5, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: HBr – восстановитель, KMnO4 – окислитель; HBr окисляется до Br2, KMnO4 – восстанавливается до MnBr2.
http://chem-oge.sdamgia.ru/test?theme=20
http://buzani.ru/zadachi/khimiya-shimanovich/935-okislitelno-vosstanovitelnye-reaktsii-zadaniya-226-230