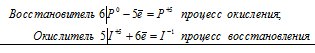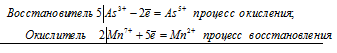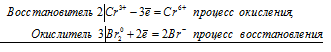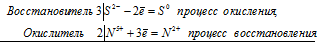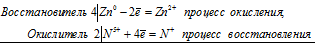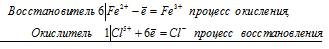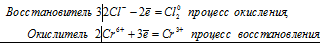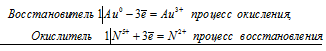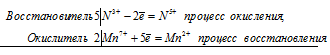Степени окисления элементов. Как найти степени окисления?
Чтобы правильно расставлять степени окисления , необходимо держать в голове четыре правила.
1) В простом веществе степень окисления любого элемента равна 0. Примеры: Na 0 , H 0 2 , P 0 4 .
2) Следует запомнить элементы, для которых характерны постоянные степени окисления . Все они перечислены в таблице.
| Элемент | Характерная степень окисления | Исключения |
| H | +1 | Гидриды металлов: LIH -1 |
| F | -1 | F 2 |
| O | -2 | F 2 O +2 ; пероксиды, надпероксиды, озониды |
| Li, Na, K, Rb, Cs, Fr | +1 |   |
| Be, Mg, Ca, Sr, Ba, Ra | +2 |   |
| Al | +3 |   |
3) Высшая степень окисления элемента, как правило, совпадает с номером группы, в которой находится данный элемент (например, фосфор находится в V группе, высшая с. о. фосфора равна +5). Важные исключения: F, O.
4) Поиск степеней окисления остальных элементов основан на простом правиле:
Несколько простых примеров на определение степеней окисления
Пример 1 . Необходимо найти степени окисления элементов в аммиаке (NH 3 ).
Решение . Мы уже знаем (см. 2), что ст. ок. водорода равна +1. Осталось найти эту характеристику для азота. Пусть х — искомая степень окисления. Составляем простейшее уравнение: х + 3 • (+1) = 0. Решение очевидно: х = -3. Ответ: N -3 H 3 +1 .
Пример 2 . Укажите степени окисления всех атомов в молекуле H 2 SO 4 .
Решение . Степени окисления водорода и кислорода уже известны: H(+1) и O(-2). Составляем уравнение для определения степени окисления серы: 2 • (+1) + х + 4 • (-2) = 0. Решая данное уравнение, находим: х = +6. Ответ: H +1 2 S +6 O -2 4 .
Пример 3 . Рассчитайте степени окисления всех элементов в молекуле Al(NO 3 ) 3 .
Решение . Алгоритм остается неизменным. В состав «молекулы» нитрата алюминия входит один атом Al(+3), 9 атомов кислорода (-2) и 3 атома азота, степень окисления которого нам и предстоит вычислить. Соответствующее уравнение: 1 • (+3) + 3х + 9 • (-2) = 0. Ответ: Al +3 (N +5 O -2 3 ) 3 .
Пример 4 . Определите степени окисления всех атомов в ионе (AsO 4 ) 3- .
Решение . В данном случае сумма степеней окисления будет равна уже не нулю, а заряду иона, т. е., -3. Уравнение: х + 4 • (-2) = -3. Ответ: As(+5), O(-2).
Что делать, если неизвестны степени окисления двух элементов
А можно ли определить степени окисления сразу нескольких элементов, пользуясь похожим уравнением? Если рассматривать данную задачу с точки зрения математики, ответ будет отрицательным. Линейное уравнение с двумя переменными не может иметь однозначного решения. Но ведь мы решаем не просто уравнение!
Пример 5 . Определите степени окисления всех элементов в (NH 4 ) 2 SO 4 .
Решение . Степени окисления водорода и кислорода известны, серы и азота — нет. Классический пример задачи с двумя неизвестными! Будем рассматривать сульфат аммония не как единую «молекулу», а как объединение двух ионов: NH 4 + и SO 4 2- . Заряды ионов нам известны, в каждом из них содержится лишь один атом с неизвестной степенью окисления. Пользуясь опытом, приобретенным при решении предыдущих задач, легко находим степени окисления азота и серы. Ответ: (N -3 H 4 +1 ) 2 S +6 O 4 -2 .
Вывод: если в молекуле содержится несколько атомов с неизвестными степенями окисления, попробуйте «разделить» молекулу на несколько частей.
Как расставлять степени окисления в органических соединениях
Пример 6 . Укажите степени окисления всех элементов в CH 3 CH 2 OH.
Решение . Нахождение степеней окисления в органических соединениях имеет свою специфику. В частности, необходимо отдельно находить степени окисления для каждого атома углерода. Рассуждать можно следующим образом. Рассмотрим, например, атом углерода в составе метильной группы. Данный атом С соединен с 3 атомами водорода и соседним атомом углерода. По связи С-Н происходит смещение электронной плотности в сторону атома углерода (т. к. электроотрицательность С превосходит ЭО водорода). Если бы это смещение было полным, атом углерода приобрел бы заряд -3.
Атом С в составе группы -СН 2 ОН связан с двумя атомами водорода (смещение электронной плотности в сторону С), одним атомом кислорода (смещение электронной плотности в сторону О) и одним атомом углерода (можно считать, что смещения эл. плотности в этом случае не происходит). Степень окисления углерода равна -2 +1 +0 = -1.
Ответ: С -3 H +1 3 C -1 H +1 2 O -2 H +1 .
Не смешивайте понятия «валентность» и «степень окисления»!
Степень окисления часто путают с валентностью. Не совершайте подобной ошибки. Перечислю основные отличия:
- степень окисления имеет знак (+ или -), валентность — нет;
- степень окисления может быть равна нулю даже в сложном веществе, равенство валентности нулю означает, как правило, что атом данного элемента не соединен с другими атомами (всякого рода соединения включения и прочую «экзотику» здесь обсуждать не будем);
- степень окисления — формальное понятие, которое приобретает реальный смысл лишь в соединениях с ионными связями, понятие «валентность», наоборот, наиболее удобно применять по отношению к ковалентным соединениям.
Степень окисления (точнее, ее модуль) часто численно равен валентности, но еще чаще эти величины НЕ совпадают. Например, степень окисления углерода в CO 2 равна +4; валентность С также равна IV. А вот в метаноле (CH 3 OH) валентность углерода остается той же, а степень окисления С равна -1.
Небольшой тест на тему «Степень окисления»
Потратьте несколько минут, проверьте, как вы усвоили эту тему. Вам необходимо ответить на пять несложных вопросов. Успехов!
Для желающих еще немного потренироваться рекомендую соответствующий тематический тест.
Расставьте степени окисления веществ в уравнении
Степень окисления, равную +4, сера имеет в соединении
1)
2)
3)
4)
Степень окисления кислорода в подавляющем большинстве соединений равна −2, галогенов −1, водорода и щелочных металлов +1 (но водород в гидридах имеет степень окисления −1), щелочноземельных металлов +2.
Молекула электронейтральна, поэтому количество «+» равно количеству «−». Подставив известные степени окисления находим, что степень окисления +4 у серы в диоксиде.
Правильный ответ указан под номером 1.
Одинаковую степень окисления атомы серы имеют в соединениях и
1)
2)
3)
4)
Степень окисления кислорода в подавляющем большинстве соединений равна −2, галогенов −1, водорода и щелочных металлов +1 (но водород в гидридах имеет степень окисления −1), щелочноземельных металлов +2.
Молекула электронейтральна, поэтому количество «+» равно количеству «−». Подставив известные степени окисления находим, что в сернистой кислоте степень окисления серы +4, такая же в диоксиде серы, вариант ответа №2.
Во втором варианте степень окисления серы +4, а в первом и четвертом +6. Проверяла несколько раз.
Все правильно. Но в ответ нужно указать вариант, степень окисления серы в котором такая же как в сернистой кислоте. Таким является вариант под номером 2.
Одинаковую степень окисления атомы серы имеют в соединениях и
1)
2)
3)
4)
Степень окисления кислорода в подавляющем большинстве соединений равна −2, галогенов −1, водорода и щелочных металлов +1 (но водород в гидридах имеет степень окисления −1), щелочноземельных металлов +2.
Молекула электронейтральна, поэтому количество «+» равно количеству «−». Подставив известные степени окисления находим, что в триоксиде серы её степень окисления +6, такая же в сульфате алюминия.
Как правильно расставить коэффициенты в уравнении реакции окисления-восстановления
Решение задач на составление уравнений окислительно-восстановительных реакций
Задание 231.
Реакции выражаются схемами:
Р + НClО3 + Н2О ⇔ Н3РО4 + НCl;
Н3AsO3 + KMnO4 +Н2SO4 ⇔ Н3AsO4 + K2SO4 + MnSO4 + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
а)Р + НClО 3 + Н 2О ⇔ Н 3РО 4 + НCl;
уравнения электронного баланса:
6P 0 + 5I +5 = 6P +5 + I -1
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов тридцать. Разделив это число на 6, получаем коэффициент 5 для окислителя и продукта его восстановления, а при делении 30 на 5 получаем коэффициент 6 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: P – восстановитель, НIО3 – окислитель; P окисляется до Н3PO4, НIО3 – восстанавливается до HI.
5As 3+ + 2Mn 7+ = 5As 5+ + 2Mn 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов десять. Разделив это число на 5, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
5Н 3 AsO 3 +2KMnO 4 + 3Н 2 SO 4 ⇔ 5Н 3 AsO 4 + K 2 SO 4 + 2MnSO 4 + 3H 2 O
В данной реакции: Н 3 AsO 3 – восстановитель, KMnO 4 – окислитель; Н 3 AsO 3 окисляется до Н 3 AsO 4, KMnO 4 – восстанавливается до MnSO 4.
Задание 232.
Реакции выражаются схемами:
NaCrO2 + Br2 + NaOH ⇔ Na2CrO4 + NaBr + H2O
FeS + HNO3 ⇔ Fe(NO3)2 + S + NO + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
2Cr 3+ + 3Br2 0 = 2Cr 6+ + 6Br —
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 2, получаем коэффициент 3 для окислителя и продукта его восстановления, а при делении 6 на 3 получаем коэффициент 2 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: NaCrO2 – восстановитель, Br2 – окислитель; NaCrO2 окисляется до Na2CrO4, Br2 – восстанавливается до NaBr.
3S 2- + 2N 5+ = 3S 0 + 2N 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 3, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 6 на 2 получаем коэффициент 3 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: FeS – восстановитель, HNO3 – окислитель; FeS окисляется до S, HNO3 – восстанавливается до NO.
Задание 233.
Реакции выражаются схемами:
HNO3 + Zn ⇔ N2O + Zn(NO3)2 + H2O;
FeSO4 + KClO3 + H2SO4 ⇔ Fe2(SO4)3 + KCl + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
4Zn 0 + 2N 5+ = 4Zn 2+ + 2N +
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов восемь. Разделив это число на 4, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 8 на 2 получаем коэффициент 4 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: Zn – восстановитель, HNO3 – окислитель; Zn окисляется до Zn(NO3)2, HNO3 – восстанавливается до N2O.
6Fe 2+ + Cl 5+ = 6Fe 3+ + Cl —
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 6, получаем коэффициент 1 для окислителя и продукта его восстановления, а при делении 6 на 1 получаем коэффициент 6 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: FeSO4 – восстановитель, KClO3 – окислитель; FeSO4 окисляется до Fe2(SO4)3, KClO3 – восстанавливается до KCl.
Задание 234.
Реакции выражаются схемами:
K2Cr2O7 + HCl ⇔ Cl2 + CrCl3 + KCl + H2O;
Au + HNO3 + HCl ⇔ AuCl3 + NO + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
2Cr 6+ + 6Cl — = 2Cr 3+ + 3Cl2 0
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 3, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 6 на 2 получаем коэффициент 3 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: HCl – восстановитель, K2Cr2O7 – окислитель; HCl окисляется до Сl2, K2Cr2O7 – восстанавливается до CrCl3.
Au 0 + N 5+ = Au 3+ + N 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Здесь число отданных электронов и число принятых электронов равно 3, поэтому коэффициенты при восстановителе и окислителе, и перед продуктами окисления и восстановления равны 1. Молекулярное уравнение реакции:
В данной реакции: Au – восстановитель, HNO3 – окислитель; Au окисляется до AuCl3, HNO3 – восстанавливается до NO.
Задание 235.
Могут ли происходить окислительно-восстановительные реакции между веществами: а) NH3 и КМnO4 б) HNO2 и HI; в) НСI и Н2S? Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме:
КМnO4 + КNO2 + Н2SO4 ⇔ МnSO4 + КNO3 + К2SO4 + Н2O
Решение:
а) Степень окисления в NH3 n(N) = -3 (низшая); в KMnO4 n(Mn) = +7 (высшая). Так как азот находится в своей низшей степени окисления, а марганец – в своей высшей степени окисления, то взятые вещества могут взаимодействовать друг с другом, причём NH3 является окислителем, а KMnO4 – восстановителем.
б) в HNO2 n(N) = +3 (промежуточная); в HI n(I) = -1 (низшая). Следовательно, взаимодействие этих веществ возможно, причем HI является окислителем, а HNO2 – восстановителем.
в) в HCl n(Cl) = -1 (низшая); в H2S n(S) = -2 (низшая). Так как и хлор, и сера находятся в своей низшей степени окисления, то оба вещества проявляют только восстановительные свойства и взаимодействовать друг с другом не могут.
г) КМnO4 + КNO2 + Н2SO4 ⇔ МnSO4 + КNO3 + К2SO4 + Н2O
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
2Mn 7+ + 5N 3+ = 2Mn 2+ + 5N 5+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов десять. Разделив это число на 5, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
http://chem-oge.sdamgia.ru/test?theme=4
http://buzani.ru/zadachi/khimiya-shimanovich/936-okislitelno-vosstanovitelnye-reaktsii-zadaniya-231-235