Оксалат кальция
| Оксалат кальция | |
|---|---|
 | |
| Систематическое наименование | Оксалат кальция |
| Традиционные названия | Щавелевокислый кальций |
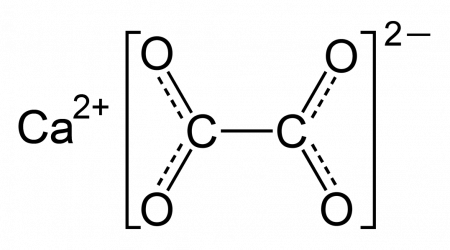
| Хим. формула | CaC2O4 |
| Рац. формула | CaC2O4 |
| Состояние | Бесцветные кристаллы |
| Молярная масса | 128,10 г/моль |
| Плотность | 2,2 г/см³ |
| Растворимость | |
| • в воде | 0,00067 18 г/100 мл |
| Рег. номер CAS | 25454-23-3 |
| PubChem | 16212978 |
| Рег. номер EINECS | 209-260-1 |
| SMILES | |
| ChEBI | 60579 |
| ChemSpider | 30549 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Оксалат кальция — соль щелочноземельного металла кальция и органической двухосновной щавелевой кислоты с формулой CaC2O4, бесцветные кристаллы, образует кристаллогидрат.
Содержание
Получение
- Обменными реакциями:
CaCl2 + (NH4)2C2O4 → CaC2O4↓ + 2NH4Cl
Физические свойства
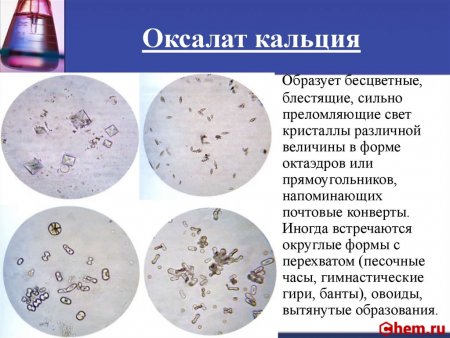
Оксалат кальция образует бесцветные кубические кристаллы. Из водных растворов образует кристаллогидрат CaC2O4•H2O — бесцветные моноклинные кристаллы. В литературе есть упоминание о кристаллогидрате CaC2O4•3H2O.
Химические свойства
Реагирует с сильными кислотами:
Чистую щавелевую кислоту можно получить, действуя серной кислотой на оксалат кальция.
Аналитические реакции катионов II группы
4.1 Аналитические реакции катионов кальция Са 2+
1.Катионы кальция Са 2+ образуют с анионами сульфата SO4 2− белый осадок малорастворимого в воде сульфата кальция, который при медленной кристаллизации выделяется в форме игольчатых кристаллов минерала гипса CaSO4 ∙ 2 H2O:
Для увеличения полноты осаждения к раствору добавляют равный объем этанола, поскольку в водно-спиртовом растворе растворимость сульфата кальция понижается по сравнению с растворимостью в воде.
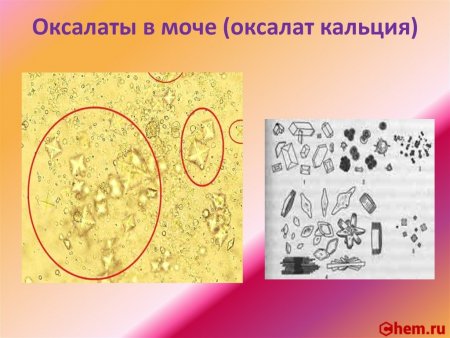
Для проведения реакции микрокристаллоскопическим методом каплю раствора, содержащего катион Са 2+ , помещают на предметное стекло, затем добавляют каплю раствора H2SO4 и смесь упаривают. При этом образуются игольчатые кристаллы гипса (CaSO4 ∙ 2 H2O), хорошо видимые в микроскоп (рис. 4.1).
Крупные кристаллы гипса легко отличить от мелких кристаллов BaSO4 и SrSO4. В присутствии катионов Ba 2+ и Sr 2+ к анализируемому раствору добавляют каплю раствора серной кислоты H2SO4, смесь выпаривают досуха. Осадок нагревают с дистиллированной водой. Сульфат кальция, как наиболее растворимый сульфат катионов II группы, переходит в раствор. При упаривании полученного раствора выпадают кристаллы гипса, хорошо видимые под микроскопом.
Рис.4.1. Кристаллы гипса (CaSO4 ∙ 2 H2O) под микроскопом.
Осадок сульфата кальция нерастворим в кислотах и щелочах, но растворяется в насыщенном водном растворе сульфата аммония с образованием комплекса:
что позволяет отделить катионы Са 2+ от катионов Ba 2+ и Sr 2+ .
При нагревании с растворимыми карбонатами осадок CaSO4 переходит в белый осадок карбоната кальция:
Карбонат кальция растворим в кислотах, поэтому нагревание CaSO4 с раствором соды с последующим растворением образовавшегося CaCO3 используют для отделения катионов кальция вместе с катионами стронция и бария (II группа) от катионов других аналитических групп и для перевода их в раствор.
2.Катионы Са 2+ образуют с анионом оксалата (C2O4 2− ) белый кристаллический осадок оксалата кальция CaC2O4:
Реакцию проводят в слабокислой среде (рН ≈ 6,0-6,5) в присутствии уксусной кислоты, в которой оксалат кальция не растворяется. Осадок CaC2O4 не растворяется в аммиаке, но растворяется в разбавленных минеральных кислотах с образованием щавелевой кислоты Н2C2O4:
Данной реакции мешают катионы Ba 2+ , Sr 2+ , Mg 2+ , которые с оксалатом образуют аналогичные осадки.
3.Катионы Са 2+ образуют с гексацианоферратом (II) калия K4[Fe(CN)6] при нагревании раствора в присутствии катионов аммония белый кристаллический осадок смешанного гексацианоферрата (II) аммония и кальция (NH4)2Ca[Fe(CN)6]:
белый крист. осадок
Осадок не растворяется в уксусной кислоте. Данной реакции мешают катионы Ba 2+ и другие, образующие осадки ферроцианидов.
4.При взаимодействии концентрированных растворов солей Са 2+ с раствором хромата калия K2CrO4 образуется желтый осадок хромата кальция:
В присутствии уксусной кислоты или ацетата натрия осадок не образуется.
Испытывают его растворимость в уксусной кислоте и ацетате калия: в обоих случаях осадок растворяется.
5.Другие реакции катионов Са 2+ . Катионы кальция образуют осадки: с растворимыми карбонатами — белый осадок CaCO3 (растворим в кислотах); с гидрофосфатом натрия Na2HPO4 – белый осадок CaHPO4 (растворим в кислотах).
4.2 Аналитические реакции катионов стронция Sr 2+
1.Катионы Sr 2+ образуют с анионами сульфата белый осадок сульфата стронция SrSO4:
Осадок не растворяется в щелочах, а также в растворе сульфата аммония (NH4)2SO4 (в отличие от осадка сульфата кальция – см. реакцию 4.2).
Испытывают растворимость осадка в растворах щелочи и сульфата аммония (осадок не растворяется).
Осадок SrSO4 образуется также при действии на растворимые соли стронция “гипсовой воды” (насыщенный водный раствор CaSO4), поскольку растворимость в воде сульфата стронция меньше, чем сульфата кальция:
Реакция солей стронция с гипсовой водой протекает при нагревании раствора, ей мешает наличие катиона бария Ва 2+ .
При нагревании осадка SrSO4 с насыщенным раствором соды он, как и сульфат кальция, переходит в осадок карбоната стронция SrСO3, растворимый в кислотах.
2.Катионы Sr 2+ образуют при нагревании с анионами карбоната белый кристаллический осадок карбоната стронция:
Осадок растворим в кислотах (СН3СООН, HCl, HNO3).
3.При взаимодействии концентрированных растворов солей стронция с раствором хромата калия K2CrO4 образуется осадок хромата стронция желтого цвета:
В присутствии уксусной кислоты или ее соли осадок не образуется.
Испытывают растворимость осадка в уксусной кислоте или растворе ацетата калия – осадок растворяется.
4.При взаимодействии солей стронция с оксалатом калия (аммония) образуется белый кристаллический осадок оксалата стронция SrC2O4:
Осадок оксалата растворим в кислотах.
5.Реактив гексацианоферрат (II) калия K4[Fe(CN)6] не образует осадка при взаимодействии с солями стронция:


6.Другие реакции катионов стронция. Катионы Sr 2+ образуют белый осадок SrHPO4 при реакциях в растворах с гидрофосфатом натрия Na2HPO4. Осадок гидрофосфата стронция растворим в кислотах.
4.3 Аналитические реакции катионов бария Ва 2+
1.При взаимодействии с анионами сульфата катионы Ва 2+ образуют белый кристаллический осадок сульфата бария:
Осадок не растворяется в кислотах и щелочах, за исключением концентрированной серной кислоты. В последнем случае образуется раствор гидросульфата бария:
При нагревании с растворами карбонатов осадок сульфата бария переходит в малорастворимый в воде карбонат бария ВаСО3, который хорошо растворим в кислотах (СН3СООН, HCl, HNO3).
Проведению данной реакции мешают катионы Са 2+ , Sr 2+ , Pb 2+ , которые также образуют нерастворимые сульфаты.
2.Катионы бария Ва 2+ образуют с анионами хромата CrO4 2− или бихромата Cr2O7 2− (в присутствии раствора ацетата натрия) желтый осадок хромата бария:
Образование хромата, а не бихромата бария в случае реакции (4.16) объясняется тем, что хромат ВаCrO4 обладает меньшей растворимостью, чем бихромат Ва2Cr2O7. В водном растворе устанавливается равновесие:
Равновесие смещено вправо, поэтому в растворе накапливаются катионы водорода Н + . Для их нейтрализации в раствор вносят ацетат натрия СН3СООNa. Анионы ацетата связывают катионы водорода. При этом возрастает полнота осаждения хромата бария.
Осадок хромата бария растворяется в сильных кислотах, но не растворяется в уксусной кислоте.
Проведению данной реакции мешают катионы Ag + , Pb 2+ , Cd 2+ , Co 2+ , Ni 2+ . Катионы кальция Са 2+ и стронция Sr 2+ не мешают открытию катионов бария с помощью бихромата.
3.При взаимодействии солей бария с оксалатом натрия (аммония) выпадает белый кристаллический осадок оксалата бария:
Осадок растворяется в кислотах: HCl, HNO3.
Испытывают растворимость осадка в кислотах (HCl, HNO3).
4.Катионы бария в присутствии солей аммония образуют с раствором гексацианоферрата (II) калия белый кристаллический осадок двойной соли:
белый крист. осадок
5.Другие реакции катионов бария. Растворимые соли бария образуют осадки: при взаимодействии с гидрофосфатом натрия Na2HPO4 – белый осадок ВаHPO4 (растворим в кислотах); с карбонатами щелочных металлов – белый осадок карбоната бария ВаСО3 (растворим в кислотах); с сульфитами щелочных металлов – белый осадок ВаSO3 (растворим в кислотах).
В табл. 4.1 представлены продукты некоторых аналитических реакций катионов II аналитической группы по кислотно-основной классификации и свойства данных продуктов.
Продукты некоторых аналитических реакций катионов II группы
Растворение оксалата кальция в соляной кислоте уравнение
Решение (для нахождения ПР используем табл. 3 Приложения).
При растворении PbC 2 O 4 в воде протекает диссоциация по уравнению:
PbC2O4 

Если S – растворимость PbC 2 O 4 (моль/л), то
S = [Pb 2+ ] = [C2O4 2- ] 
Задача 2. Вычислите произведение растворимости хромата серебра Ag 2 Cr О4, если в 100 мл воды растворяется 1,85·10 -3 г этой соли.
Найдем растворимость хромата серебра моль/л. Молярная масса Ag 2 Cr О4 равна 329,73 г/моль.

где 

Ag2Cr О 4 
Произведение растворимости хромата серебра:
Задача 3 . При каком рН достигается практически полное осаждение ионов Са 2+ в виде СаС2О4 из раствора, содержащего 0,005 моль/л ионов кальция, при 50% избытке осадителя и общем объеме раствора 100 мл?
Избыток осадителя в растворе составляет
0,005 ∙ 0,5 = 0,0025 моль в 100 мл
или 2,5∙10 -2 моль/л. Следовательно, такова концентрация осадителя по окончании осаждения.
Общая концентрация осадителя с учетом образования С2О4 2- и НС2О4 — равна
Для практически полного осаждения необходимо, чтобы

[НС2О4 — ] = 2,5∙10 -2 – 2,3∙10 -3 

(Значения ПР и константы диссоциации взяты из табл. 3 и табл. 4 Приложения).
рН = — lg 5,4∙10 -4 = 3,3.
Задача 4. Рассчитайте растворимость СаС2О4 1) в воде, 2) в 2М растворе HCl .
1) СаС2О4 
Произведение растворимости оксалата кальция:

Растворимость оксалата кальция (числовое значение ПР находим в табл. 3 Приложения):

2) В растворе, содержащем ионы водорода Н + , образующиеся вследствие диссоциации HCl , протекают реакции
С 2 O4 2- + H + 
HC2O4 — + H + 
ПР у = 

где К1 и К2 — константы ступенчатой диссоциации щавелевой кислоты Н2С2О4 (табл. 4 Приложения). Концентрация ионов водорода, образующихся при диссоциации HCl :
[ H + ] = CHCl = 2 моль/л.

Растворимость CaC 2 O 4 в 2М растворе соляной кислоты

Задача 5. Вычислите растворимость карбоната кальция Ca C O3 в воде, в 0,01 М растворе нитрата калия KNO3 и в 0,01 М растворе нитрата магния Mg(NO3)2, если ПРCa C O3 =3,8 × 10 -9 (табл. 3 Приложения).
Обозначим растворимость Ca C O3 через S, тогда
ПР CaCO3 = [ Ca 2+ ] × [ CO3 2- ] = S × S=S 2 =3,8 × 10 -9 ,
S =
Найдем растворимость Ca C O3 в 0,01 М растворе KNO3. Ионная сила раствора будет определяться концентрацией и зарядами всех присутствующих в растворе ионов, но ионы K + и NO 3 — в растворе содержатся в гораздо большем количестве, чем Ca 2+ и CO 3 2- . Поэтому можно приближено рассчитать ионную силу по двум концентрациям:
= 1 /2 (0,01 × 1 2 +0,01 × 1 2 )=0,01.
В табл. 6 Приложения для ионной силы раствора, равной 0,01, находим величины коэффициентов активности f Ca 

ПР CaCO3 = [ Ca 2+ ] × [ CO3 2- ] × f Ca 

или S =
Найдем растворимость карбоната кальция в 0,01 М растворе нитрата магния Mg(NO3)2
Ионная сила раствора и коэффициенты активности равны (если пренебречь концентрациями ионов малорастворимой соли):
I = 1 /2 ( [ Mg 2+ ] × 2 2 + [ NO3 — ] × 1 2 )=
= 1 /2 (0,01 × 4 + 0,02 × 1) = 0,03.
В табл . 6 Приложения нет ионной силы, равной 0,03. Поэтому значения коэффициентов активности найдем с помощью линейной интерполяции f Ca 

ПР CaCO = [ Ca 2+ ] × [ CO3 2- ] × f Ca 

или S =
Таким образом, растворимость карбоната кальция в 0,01 М растворе нитрата калия приблизительно в 1,5 раза больше, чем в чистой воде, а растворимость Ca C O3 в 0,01 М растворе нитрата магния приблизительно в 1,9 раза больше, чем в чистой воде.
Задача 6. В каком порядке будет происходить осаждение оксалатов, если к смеси, содержащей 1 моль/л ионов Ва 2+ и 0,005 моль/л ионов Са 2+ , приливать раствор оксалата аммония (NH4)2C2O4?
H айдем по справочнику (табл. 3 Приложения) величины произведений для BaC2O4 и CaC2O4
ПР
ПР
[ С2О4 2- ] 

[ С2О4 2- ] 

Меньшая концентрация оксалат-ионов (1,1 × 10 -7 моль/л) необходима для осаждения ионов бария. Следовательно, осадок ВаС2О4 будет образовываться в первую очередь. Вторым будет осаждаться СаС2О4. Однако к началу выпадения осадка СаС2О4 не весь Ва 2+ выпадет в осадок в виде ВаС2О4. К началу образования осадка СаС2О4 в системе должно установиться соотношение



Таким образом, концентрация ионов Ва 2+ в растворе к началу осаждения СаС2О4 составит
[ Ва 2+ ] = 

Это означает, что 0,24 моль/л Ва 2+ будут осаждаться совместно с ионами Са 2+ .
Задача 7 . Выпадет ли осадок при смешении равных объемов 0,05 М раствора ацетата свинца Pb(CH3COO)2 и 0,5 М раствора хлорида калия КC l ?
1 Концентрации ионов свинца и хлора в момент сливания будут равны:
[ Pb 2+ ] = 2,5 × 10 -2 моль/л, [ C l — ] = 2,5 × 10 -1 моль/л.
2 Произведение концентраций ионов в этом случае равно:
[ Pb 2+ ] [ C l — ] 2 = 2,5 × 10 -2 × (2,5 × 10 -1 ) 2 = 1,56 × 10 -3 .
Полученная величина произведения концентраций ионов почти в 100 раз превышает величину произведения растворимости. Поэтому раствор окажется пересыщенным в отношении данной соли и часть PbC l 2 выпадает в осадок.
Задача 8. Вычислите число молекул воды в молекуле кристаллогидрата хлорида магния, если из навески его 0,5000 г получили 0,2738 г Mg 2 P 2 O 7 .
Пересчитаем массу Mg 2 P 2 O 7 на массу кристаллогидрата MgCl 2 · x H 2 O :


Подставляя числовые значения, получаем
Находим число молекул воды в кристаллогидрате:

Задача 9. При определении железа в препарате сульфата железа( III ) взвешивают BaSO 4 . Запишите выражение для гравиметрического фактора.
Между Fe и BaSO 4 существует стехиометрическое соотношение
Гравиметрический фактор будет равен
Задача 10. Образец содержит приблизительно 2% K 2 SO 4 и 5% KNO 3 . Рассчитайте массу навески образца, необходимую для получения 0,3 г KClO 4 .
Если масса навески образца m обр , то
Задача 11. Вычислите потери (г, %) при промывании 0,5000 г осадка тетрафенилбората калия K ( C 6 H 5 )4 B (М=358,33 г/моль) 250,0 мл воды.
Равновесие в растворе над осадком
K ( C 6 H 5 )4 B (т) 
Если х – растворимость осадка (моль/л), то х=[ K + ]=[( C 6 H 5 )4 B — ],
х = 
Потери за счет растворимости равны:

или 
Задача 12. Какой объем раствора AgNO 3 c массовой долей 2% потребуется для осаждения хлорида из навески CaCl 2 ∙6 H 2 O массой 0,4382 г?
Массу AgNO 3 вычисляем на основании закона эквивалентов

Подставляя числовые значения, получаем

Плотность 2% раствора AgNO 3 близка к единице, поэтому можно записать пропорцию
в 100 г (мл) раствора содержится 2 г AgNO 3
V х = 
http://poisk-ru.ru/s43447t2.html
http://www.chem-astu.ru/chair/study/anchem/r_5_9.htm