Подробный разбор задач (задание 33 экзамена)
Задача 3. Медный купорос ( CuSO4·5H2O ) массой 12,5 г растворили в воде и получили раствор с массовой долей соли 20%. К этому раствору добавили 5,6 г железа и после завершения реакции еще 117 г 10%-ного раствора сульфида натрия. Определите массовую долю сульфида натрия в конечном растворе.
Источник: Я сдам ЕГЭ. Типовые задания. А.А. Каверина, стр. 210.
Решение:
1. Посчитаем количество веществ сульфата меди (II) в растворе и железа:
M(CuSO4) = 160 г/моль
M(CuSO4·5H2O) = 250 г/моль.
n(CuSO4·5H2O) = 12,5/250 = 0,05 моль
n(CuSO4) =n(CuSO4·5H2O) = 0,05 моль
m(CuSO4 в исходном растворе) = 0,05·160 = 8 г.
n(Fe) = 5,6/56 = 0,1 моль.
2. Запишем уравнение реакции сульфата меди (II) с железом:
| CuSO4 | + | Fe |   → | FeSO4 | + | Cu |
|---|---|---|---|---|---|---|
| Было: | 0,05 моль | 0,1 моль | — | — | ||
| Стало: | — | 0,05 моль | 0,05 моль | 0,05 моль |
3. Рассчитаем исходное количество сульфида натрия:
n(Na2S) = 117·0,1/78 = 0,15 моль
| FeSO4 | + | Na2S |   → | FeS | + | Na 2 SO4 |
|---|---|---|---|---|---|---|
| Было: | 0,05 моль | 0,15 моль | — | — | ||
| Стало: | — | 0,15-0,05 = 0,1 моль | 0,05 моль | 0,05 моль |
Так как сульфат железа (II) в недостатке, в растворе останется 0,1 моль сульфида натрия.
m(Na2S) = 0,1·78 = 7,8 г.
4. Рассчитаем массу итогового раствор:
m(итогового р-ра) = m(исх. р-ра CuSO4) + m(железа, которое перешло в раствор) + m(р-ра Na2S) — m(Cu) — m(FeS)
m(исх. р-ра CuSO4) = 8/0,2 = 40 г.
m(железа, которое перешло в раствор) = 0,05 ·56 = 2,8 г.
m(ра-ра Na2S) = 117 г (по условию)
m(Cu) = 0,05 ·64 = 3,2 г.
m(FeS) = 0,05 ·88 = 4,4 г.
m(итогового р-ра) = 40 + 2,8 + 117 — 3,2 — 4,4 = 152,2 г.
Медный купорос ГОСТ 19347-99
| Медный купорос | |
|---|---|
| Систематическое наименование | медный купорос |
| Традиционные названия | пентагидрат: сульфат меди (II), медь сернокислая техническая |
| Хим. формула | CuSO 4 |
| Состояние | кристаллическое |
| Молярная масса | 159,609 (сульфат) 249.685 (пентагидрат) г/моль |
| Плотность | 3,64 г/см³ |
| Твёрдость | 2,5 |
| Т. разл. | выше 650 °C |
| pKa | 5⋅10 −3 |
| Координационная геометрия | Октаэдрическая |
| Кристаллическая структура | безв. — ромбическая пентагидрат — триклинная пинакоидальная тригидрат — моноклинная |
| ГОСТ | ГОСТ 19347-99 |
| Рег. номер CAS | 7758-98-7 |
| PubChem | 24462 |
| Рег. номер EINECS | 231-847-6 |
| SMILES | |
| Кодекс Алиментариус | E519 |
| RTECS | GL8800000 |
| ChEBI | 23414 |
| ChemSpider | 22870 |
| ПДК | в воздухе: мр 0,009, сс 0,004; в воде: 0,001 |
| ЛД50 | крысы, орально: 612,9 мг/кг мыши, орально: 87 мг/кг |
| Токсичность | |
| NFPA 704 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Медный купорос (медь сернокислая, сульфат меди (II) ) — неорганическое соединение, медная соль серной кислоты с формулой CuSO 4. Нелетучее вещество, не имеет запаха. В безводном виде — белый порошок, очень гигроскопичное. В виде кристаллогидратов — прозрачные негигроскопичные кристаллы различных оттенков синего с горьковато-металлическим вяжущим вкусом, на воздухе постепенно выветриваются (теряют кристаллизационную воду).
Сульфат меди(II) хорошо растворим в воде. Из водных растворов кристаллизуется голубой пентагидрат CuSO4·5H2O — медный купорос. Токсичность медного купороса для теплокровных животных относительно невысока, в то же время, он высокотоксичен для рыб.
Обладает дезинфицирующими, антисептическими, вяжущими свойствами. Применяется в медицине, в растениеводстве как антисептик, фунгицид или медно-серное удобрение.
Реакция гидратации безводного сульфата меди (II) экзотермическая и проходит со значительным выделением тепла.
Содержание
- 1 Нахождение в природе
- 2 Получение
- 2.1 В промышленности
- 2.2 В лабораторных условиях
- 2.3 Очистка
- 2.3.1 Глубокая очистка
- 3 Физические свойства
- 3.1 Строение кристаллогидрата
- 3.2 Термическое воздействие
- 3.3 Растворимость
- 4 Химические свойства
- 4.1 Электролитическая диссоциация
- 4.2 Реакция замещения
- 4.3 Реакция с растворимыми основаниями (щелочами)
- 4.4 Сокращённое ионное уравнение (Правило Бертолле)
- 4.5 Реакция обмена с другими солями
- 4.6 Прочее
- 5 Производство и применение
- 6 Токсикология
Нахождение в природе
В природе встречается в виде минералов халькантита (CuSO4·5H2O), халькокианита (CuSO4), бонаттита (CuSO4·3H2O), бутита (CuSO4·7H2O) и в составе некоторых других минералов.
Получение
В промышленности
В промышленности загрязненный сульфат меди(II) получают растворением меди и медных отходов в разбавленной серной кислоте H2SO4 при продувании воздуха:
растворением оксида меди(II) CuO в H2SO4:
сульфатизирующим обжигом сульфидов меди и как побочный продукт электролитического рафинирования меди.
В лабораторных условиях
В лаборатории CuSO4 можно получить действием концентрированной серной кислоты на медь при нагревании:
температура не должна превышать 60 °С, при большей температуре в значительных количествах образуется побочный продукт — сульфид меди(I):
Также в лабораторных условиях сульфат меди (II) может быть получен реакцией нейтрализации гидроксида меди(II) серной кислотой, для получения сульфата меди высокой чистоты используют соответственно чистые реактивы:
Чистый сульфат меди может быть получен следующим образом. В фарфоровую чашку наливают 120 мл дистиллированной воды, прибавляют 46 мл химически чистой серной кислоты плотностью 1,8 г/см 3 и помещают в смесь 40 г чистой меди (например, электролитической). Затем нагревают до 70—80 °С и при этой температуре в течение часа постепенно, порциями по 1 мл, прибавляют 11 мл конц. азотной кислоты. Если медь покроется кристаллами, прибавить 10—20 мл воды. Когда реакция закончится (прекратится выделение пузырьков газа), остатки меди вынимают, а раствор упаривают до появления на поверхности пленки кристаллов и дают остыть. Выпавшие кристаллы следует 2—3 перекристаллизовать из дистиллированной воды и высушить.
Очистка
Очистить загрязненный или технический сульфат меди можно перекристаллизацией — вещество растворяется в кипящей дистиллированной воде до насыщения раствора, после чего охлаждается до приблизительно +5 °С. Полученный осадок кристаллов отфильтровывается. Однако даже многократная перекристаллизация не позволяет избавиться от примеси соединений железа, которые являются наиболее распространенной примесью в сульфате меди.
Для полной очистки медный купорос кипятят с диоксидом свинца PbO2 или пероксидом бария BaO2, пока отфильтрованная проба раствора не покажет отсутствия железа. Затем раствор фильтруют и упаривают до появления на поверхности пленки кристаллов, после чего охлаждают для кристаллизации.
По Н. Шоорлю очистить сульфат меди можно так: к горячему раствору CuSO4 прибавить небольшие количества пероксида водорода H2O2 и гидроксида натрия NaOH, прокипятить и отфильтровать осадок. Выпавшие из фильтрата кристаллы дважды подвергаются перекристаллизации. Полученное вещество имеет чистоту не ниже квалификации «ХЧ».
Глубокая очистка
Существует более сложный способ очистки, позволяющий получить сульфат меди особой чистоты, с содержанием примесей около 2·10 -4 %.
Для этого готовится водный, насыщенный при 20°С раствор сульфата меди (вода используются только бидистиллированная). В него добавляют перекись водорода в количестве 2-3 мл 30 % раствора на 1 литр, перемешивают, вносят свежеосаждённый основной карбонат меди в количестве 3-5 грамм, нагревают и кипятят 10 минут для разложения H2O2.
Затем раствор охлаждают до 30—35 °С, фильтруют и приливают 15 мл 3%-ного раствора диэтилдитиокарбамата натрия и выдерживают в мешалке три-четыре часа не понижая температуры. Далее раствор быстро процеживают от крупных хлопьев комплексов и вносят активированный уголь БАУ-А на полчаса при перемешивании. Затем раствор следует отфильтровать вакуумным методом.
Дальше в раствор CuSO4 приливают на 1 л около 200 мл насыщенного раствора NaCl квалификации «Ч» и вносят чистый алюминий в проволоке или обрезках до полного прохождения реакции, выделения меди и просветления раствора (при этом выделяется водород). Выделенную медь отделяют от алюминия взбалтыванием, осадок промывают декантацией сперва водой затем заливают горячим 5—10 % раствором соляной кислоты ХЧ при взбалтывании в течение часа и постоянным подогревом до 70—80 °С, затем промывают водой и заливают 10—15%-ной серной кислотой (ОСЧ 20-4) на час с подогревом при том же интервале температур. От степени и тщательности промывания кислотами, а также квалификации применяемых далее реактивов зависит чистота дальнейших продуктов.
После промывки кислотами медь снова моют водой и растворяют в 15—20%-ной серной кислоте (ОСЧ 20-4) без её большого избытка с добавлением перекиси водорода (ОСЧ 15-3). После прохождения реакции полученный кислый раствор сульфата меди кипятят для разложения избытка перекиси и нейтрализуют до полного растворения вначале выпавшего осадка перегнанным 25%-ным раствором аммиака (ОСЧ 25-5) или приливают раствор карбоната аммония, очищенного комплексно-адсорбционным методом до особо чистого.
После выстаивания в течение суток раствор медленно фильтруют. В фильтрат добавляют серную кислоту (ОСЧ) до полного выпадения голубовато-зелёного осадка и выдерживают до укрупнения и перехода в зелёный основной сульфат меди. Зелёный осадок выстаивают до компактности и тщательно промывают водой до полного удаления растворимых примесей. Затем осадок растворяют в серной кислоте, фильтруют, устанавливают рН=2,5—3,0 и перекристаллизовывают два раза при быстром охлаждении, причем при охлаждении раствор каждый раз перемешивают для получения более мелких кристаллов сульфата меди. Выпавшие кристаллы переносят на воронку Бюхнера и удаляют остатки маточного раствора с помощью водоструйного насоса. Третья кристаллизация проводится без подкисления раствора с получением чуть более крупных и оформленных кристаллов.
Физические свойства
Пентагидрат сульфата меди (II) (медный купорос) — синие прозрачные кристаллы триклинной сингонии. Плотность 2,284 г/см 3 . При температуре 110 °С отщепляется 4 молекулы воды, при 150 °С происходит полное обезвоживание.
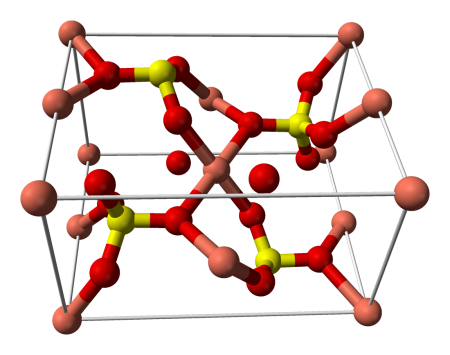
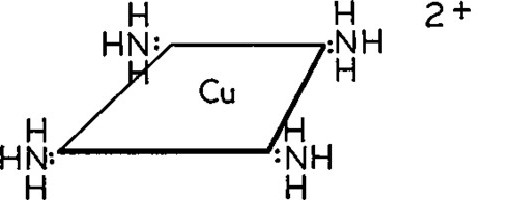
Строение кристаллогидрата
Структура медного купороса приведена на рисунке. Как видно, вокруг иона меди координированы два аниона SO4 2− по осям и четыре молекулы воды (в плоскости), а пятая молекула воды играет роль мостиков, которые при помощи водородных связей объединяют молекулы воды из плоскости и сульфатную группу.
Термическое воздействие
При нагревании пентагидрат последовательно отщепляет две молекулы воды, переходя в тригидрат CuSO4·3H2O (этот процесс, выветривание, медленно идёт и при более низких температурах [в том числе при 20—25 °С]), затем в моногидрат (при 110 °С) CuSO4·H2O, и выше 258 °C образуется безводная соль.
Выше 650 °C становится интенсивным пиролиз безводного сульфата по реакции:
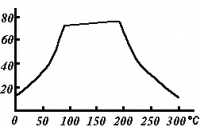
Растворимость
Растворимость сульфата меди (II) по мере роста температуры проходит через плоский максимум, в течение которого растворимость соли почти не меняется (в интервале 80—200 °C). (см. рис.)
Как и все соли, образованные ионами слабого основания и сильной кислоты, сульфат меди (II) гидролизуется, (степень гидролиза в 0,01 М растворе при 15 °C составляет 0,05 %) и даёт кислую среду (pH указанного раствора 4,2). Константа диссоциации составляет 5⋅10 −3 .
Химические свойства
Электролитическая диссоциация
CuSO4 — хорошо растворимая в воде соль и сильный электролит, в растворах сульфат меди(II) так же, как и все растворимые соли, диссоциирует в одну стадию:
Реакция замещения
Реакция замещения возможна в водных растворах сульфата меди с использованием металлов активнее меди, стоящих левее меди в электрохимическом ряду напряжения металлов:
Реакция с растворимыми основаниями (щелочами)
Сульфат меди(II) реагирует с щелочами с образованием осадка гидроксида меди(II) голубого цвета:
Сокращённое ионное уравнение (Правило Бертолле)
Реакция обмена с другими солями
Сульфат меди вступает также в обменные реакции по ионам Cu 2+ и SO4 2-
Прочее
С сульфатами щелочных металлов и аммония образует комплексные соли, например, Na2[Cu(SO4)2]·6H2O.
Растворимость меди в воде и кислотах
В основе химических свойств большинства элементов лежит их способность к растворению в водной среде и кислотах. Изучение характеристики меди связано с малоактивным действием в обычных условиях. Особенностью её химических процессов является образование соединений с аммиаком, ртутью, азотной и серной кислотами. Низкая растворимость меди в воде не способна вызвать коррозионные процессы. Ей присущи особые химические свойства, позволяющие использовать соединение в разных отраслях промышленности.
Описание элемента
Медь считается старейшим из металлов, который научились добывать люди ещё до нашей эры. Это вещество получают из природных источников в виде руды. Медью называют элемент химической таблицы с латинским наименованием cuprum, порядковый номер которого равен 29. В периодической системе он расположен в четвёртом периоде и относится к первой группе.
Природное вещество является розово-красным тяжёлым металлом с мягкой и ковкой структурой. Температура его кипения и плавления – более 1000 °С. Считается хорошим проводником.
Химическое строение и свойства
Если изучить электронную формулу медного атома, то можно обнаружить, что у него имеется 4 уровня. На валентной 4s-орбитали находится всего один электрон. Во время химических реакций от атома может отщепляться от 1 до 3 отрицательно заряжённых частиц, тогда получаются соединения меди со степенью окисления +3, +2, +1. Наибольшей устойчивостью обладают её двухвалентные производные.
В химических реакциях она выступает в качестве малоактивного металла. В обычных условиях растворимость меди в воде отсутствует. В сухом воздухе не наблюдается коррозия, зато при нагревании поверхность металла покрывается чёрным налётом из оксида двухвалентного. Химическая устойчивость меди проявляется при действии безводных газов, углерода, ряда органических соединений, фенольных смол и спиртов. Для неё характерны реакции комплексообразования с выделением окрашенных соединений. Медь обладает небольшим сходством с металлами щелочной группы, связанным с формированием производных одновалентного ряда.
Что такое растворимость?
Это процесс образования однородных систем в виде растворов при взаимодействии одного соединения с другими веществами. Их составляющими являются отдельные молекулы, атомы, ионы и другие частицы. Степень растворимости определяется по концентрации вещества, которое растворили при получении насыщенного раствора.
Единицей измерения чаще всего являются проценты, объёмные или весовые доли. Растворимость меди в воде, как и других соединений твёрдого вида, подчиняется лишь изменениям температурных условий. Эту зависимость выражают с помощью кривых. Если показатель очень маленький, то вещество считается нерастворимым.
Растворимость меди в водной среде
Металл проявляет коррозионную стойкость под действием морской воды. Это доказывает его инертность в обычных условиях. Растворимость меди в воде (пресной) практически не наблюдается. Зато во влажной среде и под действием углекислого газа на металлической поверхности происходит образование плёнки зелёного цвета, которая является основным карбонатом:
Если рассматривать её одновалентные соединения в виде соли, то наблюдается их незначительное растворение. Такие вещества подвержены быстрому окислению. В результате получаются соединения меди двухвалентные. Эти соли обладают хорошей растворимостью в водной среде. Происходит их полная диссоциация на ионы.
Растворимость в кислотах
Обычные условия протекания реакций меди со слабыми или разбавленными кислотами не способствуют их взаимодействию. Не наблюдается химический процесс металла со щелочами. Растворимость меди в кислотах возможна, если они являются сильными окислителями. Только в этом случае протекает взаимодействие.
Растворимость меди в азотной кислоте
Такая реакция возможна ввиду того, что происходит процесс окисления металла сильным реагентом. Кислота азотная в разбавленном и концентрированном виде проявляет окислительные свойства с растворением меди.
В первом варианте во время реакции получается меди нитрат и азота двухвалентный оксид в соотношении 75 % к 25 %. Процесс с разбавленной кислотой азотной можно описать следующим уравнением:
Во втором случае получается меди нитрат и азота оксиды двухвалентные и четырёхвалентные, соотношение которых 1 к 1. В этом процессе участвует 1 моль металла и 3 моля кислоты азотной концентрированной. При растворении меди происходит сильный разогрев раствора, в результате чего наблюдается термическое разложение окислителя и выделение дополнительного объёма азотных оксидов:
Реакцию используют в малотоннажном производстве, связанном с переработкой лома или удалением покрытия с отходов. Однако такой способ растворения меди имеет ряд недостатков, связанных с выделением большого количества азотных оксидов. Для их улавливания или нейтрализации необходимо специальное оборудование. Процессы эти весьма затратные.
Растворение меди считается завершённым, когда происходит полное прекращение выработки летучих азотистых оксидов. Температура реакции колеблется от 60 до 70 °C. Следующим этапом является спуск раствора из химического реактора. На его дне остаются небольшие куски металла, который не прореагировал. К полученной жидкости добавляют воду и проводят фильтрацию.
Растворимость в кислоте серной
В обычном состоянии такая реакция не протекает. Фактором, определяющим растворение меди в серной кислоте, является её сильная концентрация. Разбавленная среда не может окислить металл. Растворение меди в серной кислоте концентрированной протекает с выделением сульфата.
Процесс выражается следующим уравнением:
Свойства сульфата меди
Соль двухосновную ещё называют сернокислой, обозначают её так: CuSO4. Она представляет собой вещество без характерного запаха, не проявляющее летучесть. В безводной форме соль не имеет цвета, она непрозрачная, обладающая высокой гигроскопичностью. У меди (сульфат) растворимость хорошая. Молекулы воды, присоединяясь к соли, могут образовывать кристаллогидратные соединения. Примером служит купорос медный, который является пентагидратом голубого цвета. Его формула: CuSO4·5H2O.
Кристаллогидратам присуща прозрачная структура синеватого оттенка, они проявляют горьковатый, металлический привкус. Молекулы их способны со временем терять связанную воду. В природе встречаются в виде минералов, к которым относят халькантит и бутит.
Подвержен воздействию меди сульфат. Растворимость является реакцией экзотермической. В процессе гидратации соли выделяется значительное количество тепла.
Растворимость меди в железе
В результате этого процесса образуются псевдосплавы из Fe и Cu. Для металлического железа и меди возможна ограниченная взаимная растворимость. Максимальные её значения наблюдаются при температурном показателе 1099,85 °C. Степень растворимости меди в твёрдой форме железа равняется 8,5 %. Это небольшие показатели. Растворение металлического железа в твёрдой форме меди составляет около 4,2 %.
Снижение температуры до комнатных значений делает взаимные процессы незначительными. При расплавлении металлической меди, она способна хорошо смачивать железо в твёрдой форме. При получении псевдосплавов Fe и Cu используют особые заготовки. Их создают путём прессования или печения железного порошка, находящегося в чистой или легированной форме. Такие заготовки пропитывают жидкой медью, образуя псевдосплавы.
Растворение в аммиаке
Процесс часто протекает при пропускании NH3 в газообразной форме над раскалённым металлом. Результатом является растворение меди в аммиаке, выделение Cu3N. Это соединение называют нитридом одновалентным.
Соли её подвергаются воздействию раствора аммиачного. Прибавление такого реактива к медному хлориду приводит к выпадению осадка в виде гидроксида:
Аммиачный избыток способствует формированию соединения комплексного типа, имеющего окраску тёмно-синюю:
Этот процесс используют для определения ионов двухвалентной меди.
Растворимость в чугуне
В структуре ковкого перлитного чугуна помимо основных компонентов присутствует дополнительный элемент в виде обычной меди. Именно она повышает графитизацию углеродных атомов, способствует увеличению жидкотекучести, прочности и твёрдости сплавов. Металл положительно влияет на уровень перлита в конечном продукте. Растворимость меди в чугуне используют для проведения легирования исходного состава. Основной целью такого процесса является получение ковкого сплава. У него будут повышенные механические и коррозионные свойства, но уменьшено охрупчивание.
Если содержание меди в чугуне составляет около 1 %, то показатель прочности при проведении растяжения приравнивается к 40 %, а текучести увеличивается до 50 %. Это существенно изменяет характеристики сплава. Повышение количества металла, легирующего до 2 %, приводит к изменению прочности до значения 65 %, а показатель текучести становится равен 70 %. При большем содержании меди в составе чугуна труднее образуется шаровидный графит. Введение в структуру легирующего элемента не изменяет технологию формирования вязкого и мягкого сплава. Время, которое отводится для отжига, совпадает с продолжительностью такой реакции при производстве чугуна без примеси меди. Оно составляет около 10 часов.
Использование меди для изготовления чугуна с высокой концентрацией кремния не способно полностью устранить так называемое ожелезнение смеси во время отжига. В результате получают продукт с низкой упругостью.
Растворимость в ртути
При смешивании ртути с металлами других элементов получаются амальгамы. Этот процесс может проходить при комнатной температуре, ведь в таких условиях Pb представляет собой жидкость. Растворимость меди в ртути проходит только во время нагревания. Металл необходимо предварительно измельчить. При смачивании жидкой ртутью твёрдой меди происходит взаимное проникновение одного вещества в другое или процесс диффундирования. Значение растворимости выражается в процентах и составляет 7,4*10 -3 . В процессе реакции получается твёрдая простая амальгама, похожая на цемент. Если её немного нагреть, то она размягчается. В результате такую смесь используют для починки изделий из фарфора. Существуют ещё и сложные амальгамы с оптимальным содержанием в ней металлов. Например, в стоматологическом сплаве присутствуют элементы серебра, олова, меди и цинка. Их количество в процентах относится как 65: 27: 6:2. Амальгам с таким составом называется серебряным. Каждый компонент сплава выполняет определённую функцию, которая позволяет получить пломбу высокого качества.
Другим примером служит сплав амальгамный, в котором наблюдается высокое содержание меди. Его ещё называют медным сплавом. В составе амальгама присутствует от 10 до 30 % Cu. Высокое содержание меди препятствует взаимодействию олова со ртутью, что не позволяет образовываться очень слабой и коррозирующей фазе сплава. Кроме того, уменьшение количества в пломбе серебра приводит к удешевлению. Для приготовления амальгамы желательно использовать инертную атмосферу или защитную жидкость, которая образует плёнку. Металлы, входящие в состав сплава способны быстро окисляться воздухом. Процесс нагревания амальгамы купрума в присутствие водорода приводит к отгонке ртути, что позволяет отделить элементарную медь. Как видите, эта тема несложна для изучения. Теперь вы знаете, как медь взаимодействует не только с водой, но и с кислотами и другими элементами.
http://chem.ru/mednyj-kuporos.html
http://fb.ru/article/238897/rastvorimost-medi-v-vode-i-kislotah