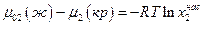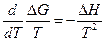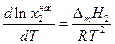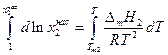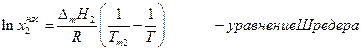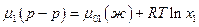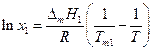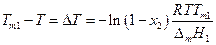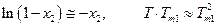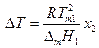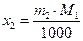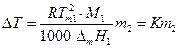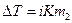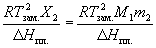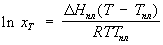Глава 11. Коллигативные свойства растворов.
11.1. Растворимость твердого вещества в идеальном растворе.
Растворимость твердого вещества в данном растворе измеряется концентрацией его насыщенного раствора при данной температуре и давлении. Насыщенный раствор – это раствор, находящийся в равновесии с кристаллами твердого вещества, следовательно в насыщенном растворе химические потенциалы растворенного вещества в жидкой и твердой фазах одинаковы:
Если при растворении твердого вещества образуется идеальный раствор, то химический потенциал этого вещества в насыщенном растворе будет:
где μ02 (ж) – химический потенциал чистого растворенного вещества в жидком состоянии. Тогда, очевидно,
Но 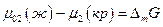
где Δ G иΔ Н относятся к одному и тому же процессу, поэтому получаем при постоянном давлении
В полученном уравнении отсутствуют величины, характеризующие индивидуальные свойства растворителя. Следовательно, идеальная растворимость твердых тел не зависит от природы растворителя. А поскольку 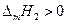
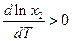
Разделим переменные и возьмем интеграл от 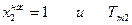

Теплоемкости жидкого и твердого вещества сравнительно мало отличаются друг от друга, поэтому можно предположить, что в интервале от Т до Тт2 ΔтН2 =const и после взятия интегралов имеем:
Поскольку Тт2 > T, то 1/Tm2 , V2(кр), поэтому с увеличением давления при постоянной температуре идеальная растворимость уменьшается.
11.2. Понижение температуры замерзания растворов. Криоскопия.
Будем понимать под температурой кристаллизации раствора ту температуру, при которой кристаллы растворителя находятся в равновесии с раствором, т.е. раствор при этой температуре становится насыщенным относительно растворителя. Из условий равновесия имеем :
Если раствор достаточно разбавлен, то давление пара растворителя подчиняется закону Рауля р1 =р01 ·х1, поэтому
и, повторив выкладки предыдущего параграфа, получим
где Тт1 –температура кристаллизации чистого растворителя, Т – температура кристаллизации раствора, имеющего концентрацию растворителя х1 . Так как
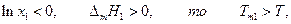
Преобразуем полученное уравнение:
Если х2 мало (раствор разбавлен), то
и
Поскольку в разбавленном растворе моляльность т2 и мольная доля х2 связаны соотношением
где М1 — мольная масса растворителя, то
Величина К называется криоскопической константой растворителя.
С помощью измерений ΔТ для данного растворителя с известной К можно определить мольную массу растворенного вещества :
где g1 и g2 навески растворителя и растворенного вещества в граммах.
Криоскопия – один из способов определения мольных масс или чистоты вещества. Надежные результаты получаются в растворителях с высокими значениями криоскопических постоянных при условии, что при растворении не происходит диссоциации или ассоциации молекул растворенного вещества. Диссоциация Растворенного вещества приводит к увеличению его числа частиц ( ионов ). Поэтому для растворов электролитов :
где i – изотонический коэфициент Вант-Гоффе, показывающий во сколько раз увеличилось число частиц в растворе вследствие диссоциации :
где α –степень диссоциации, п –число ионов, на которые распадается молекула.
| Растворитель | К |
| Вода | 1,86 |
| Бензол | 5,12 |
| Циклогексан | 20,0 |
| Сероуглерод | 3,8 |
| Камфора |
Если α = 1, то i = n. Однако i практически всегда меньше n, так как ионы в растворах не свободны, а связаны силами электростатического взаимодействия. Измерив ΔТ раствора известной моляльности можно определить изотонический коэффициент, а следовательно, степень диссоциации, что особенно пригодно для слабых электролитов. Приведем еще таблицу замерзания водноэтанольных растворов
| m | |||||||
| t 0 C | -3,6 | -7,92 | -12,3 | -22 | -30 | -36 | -42 |
11.3. Температура кипения растворов нелетучих веществ. Эбулиоскопия.
Раствор, как и любая жидкость, кипит, когда давление насыщенного пара станет равным внешнему давлению. Если растворенное вещество нелетуче, то пар будет содержать только растворитель и по закону Рауля давление пара растворителя над раствором всегда меньше, чем над чистым растворителем при той же температуре, поэтому раствор должен кипеть при более высокой температуре.
Если раствор достаточно разбавлен и соблюдается закон Рауля, то в точке кипения раствора
Растворимость твердых веществ в идеальном растворе уравнение шредера
Свойства разбавленных растворов, зависящие только от количества нелетучего растворенного вещества, называются коллигативными свойствами. К ним относятся понижение давление пара растворителя над раствором, повышение температуры кипения и понижение температуры замерзания раствора, а также осмотическое давление.
Понижение температуры замерзания и повышение температуры кипения раствора по сравнению с чистым растворителем:
Tзам. = = KК . m2,
Tкип. = 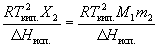
где m2 – моляльность раствора, KК и KЭ – криоскопическая и эбулиоскопическая постоянные растворителя, X2 – мольная доля растворенного вещества, Hпл. и Hисп. – энтальпии плавления и испарения растворителя, Tпл. и Tкип. – температуры плавления и кипения растворителя, M1 – молярная масса растворителя.
Осмотическое давление в разбавленных растворах можно рассчитать по уравнению
=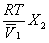
где X2 – мольная доля растворенного вещества, 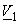
= CRT,
где C – молярность раствора.
Уравнения, описывающие коллигативные свойства неэлектролитов, можно применить и для описания свойств растворов электролитов, введя поправочный коэффициент Вант-Гоффа i, например:
= iCRT или Tзам. = iKК . m2.
Изотонический коэффициент связан со степенью диссоциации электролита:
i = 1 + ( – 1),
где – количество ионов, образующихся при диссоциации одной молекулы.
Растворимость твердого вещества в идеальном растворе при температуре T описывается уравнением Шредера:
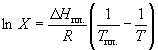
где X – мольная доля растворенного вещества в растворе, Tпл. – температура плавления и Hпл. – энтальпия плавления растворенного вещества.
ПРИМЕРЫ
Пример 8-1. Рассчитать растворимость висмута в кадмии при 150 и 200 o C. Энтальпия плавления висмута при температуре плавления (273 o C) равна 10.5 кДж . моль –1 . Считать, что образуется идеальный раствор и энтальпия плавления не зависит от температуры.
Решение. Воспользуемся формулой 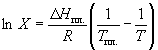
При 150 o C 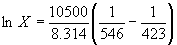
При 200 o C 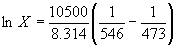
Растворимость увеличивается с температурой, что характерно для эндотермического процесса.
Пример 8-2. Раствор 20 г гемоглобина в 1 л воды имеет осмотическое давление 7.52 10 –3 атм при 25 o C. Определить молярную массу гемоглобина.
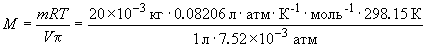
ЗАДАЧИ
- Рассчитать минимальную осмотическую работу, совершаемую почками для выделения мочевины при 36.6 o C, если концентрация мочевины в плазме 0.005 моль . л –1 , а в моче 0.333 моль . л –1 .
- 10 г полистирола растворено в 1 л бензола. Высота столбика раствора (плотностью 0.88 г . см –3 ) в осмометре при 25 o C равна 11.6 см. Рассчитать молярную массу полистирола.
- Белок сывороточный альбумин человека имеет молярную массу 69 кг . моль –1 . Рассчитать осмотическое давление раствора 2 г белка в 100 см 3 воды при 25 o C в Па и в мм столбика раствора. Считать плотность раствора равной 1.0 г . см –3 .
- При 30 o C давление пара водного раствора сахарозы равно 31.207 мм рт. ст. Давление пара чистой воды при 30 o C равно 31.824 мм рт. ст. Плотность раствора равна 0.99564 г . см –3 . Чему равно осмотическое давление этого раствора?
- Плазма человеческой крови замерзает при –0.56 o C. Каково ее осмотическое давление при 37 o C, измеренное с помощью мембраны, проницаемой только для воды?
- *Молярную массу фермента определяли, растворяя его в воде и измеряя высоту столбика раствора в осмометре при 20 o C, а затем экстраполируя данные к нулевой концентрации. Получены следующие данные:
| C, мг . см –3 |
| h, см |
Рассчитать молярную массу фермента.


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Шредера уравнение
Шр е дера уравн е ние, математическое соотношение, выражающее связь между растворимостью кристаллического тела xt при температуре Т (в К), его теплотой плавления D Нпл (в кал/моль) и температурой плавления Тпл:
где R — газовая постоянная; D Нпл принимается постоянной в интервале Тпл — Т. Строгое применение Шредера уравнения ограничено идеальными растворами. Построив по Шредера уравнению кривые температурной зависимости растворимости для твёрдой фазы каждого из компонентов двойной системы, можно найти эвтектическую точку (см. Эвтектика) и получить растворимости диаграмму.
Шредера уравнение выведено в 1890 И. Ф. Шредером. Оно известно также под названием «логарифмики Шредера» и уравнения Шредера — Ле Шателье (А. Ле Шателье ранее получил зависимость растворимости от температуры в дифференциальной форме, на основании которой в 1894 вывел уравнение, аналогичное Шредера уравнению).
Лит.: Кипнис А. Я., Развитие химической термодинамики в России, М.—Л., 1964. См. также лит. при ст. Растворы.
http://www.chem.msu.su/rus/teaching/eremin1/2-8.html
http://xumuk.ru/bse/3194.html