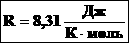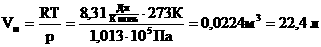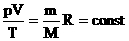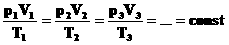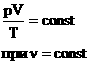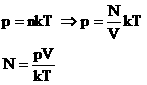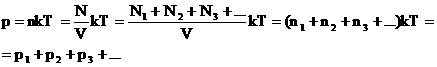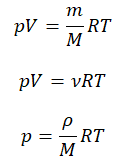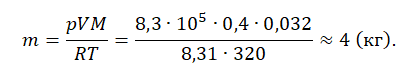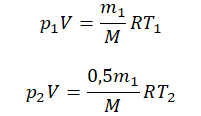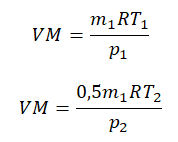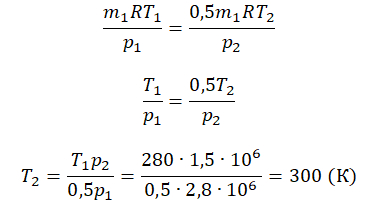Уравнение состояния идеального газа. Газовые законы.
Уравнение состояния идеального газа
(уравнение Менделеева – Клапейрона).
Уравнением состояния называется уравнение, связывающее параметры физической системы и однозначно определяющее ее состояние.
В 1834 г. французский физик Б. Клапейрон, работавший дли тельное время в Петербурге, вывел уравнение состояния идеального газа для постоянной массы газа. В 1874 г. Д. И. Менделеев вывел уравнение для произвольного числа молекул.
В МКТ и термодинамике идеального газа макроскопическими параметрами являются: p, V, T, m.
Мы знаем, что 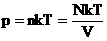
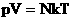
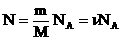
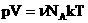
Произведение постоянных величин есть величина постоянная, следовательно: 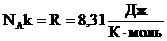
Таким образом, имеем:
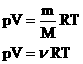
Другие формы записи уравнения состояния идеального газа.
1.Уравнение для 1 моля вещества.
Если n=1 моль, то, обозначив объем одного моля Vм, получим: 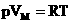
Для нормальных условий получим:
2. Запись уравнения через плотность: 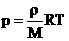
3. Уравнение Клапейрона.
Часто необходимо исследовать ситуацию, когда меняется состояние газа при его неизменном количестве (m=const) и в отсутствие химических реакций (M=const). Это означает, что количество вещества n=const. Тогда:
Эта запись означает, что для данной массы данного газа справедливо равенство:
Для постоянной массы идеального газа отношение произведения давления на объем к абсолютной температуре в данном состоянии есть величина постоянная: 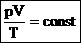
Газовые законы.
1. Закон Авогадро.
В равных объемах различных газов при одинаковых внешних условиях находится одинаковое число молекул (атомов).
Доказательство:
Следовательно, при одинаковых условиях (давление, объем, температура) число молекул не зависит от природы газа и одинаково.
2. Закон Дальтона.
Давление смеси газов равно сумме парциальных (частных) давлений каждого газа.
Доказательство:
3. Закон Паскаля.
Давление, производимое на жидкость или газ, передается во все стороны без изменения.
Уравнение состояния идеального газа
теория по физике 🧲 молекулярная физика, МКТ, газовые законы
Уравнение состояния идеального газа было открыто экспериментально. Оно носит название уравнения Клапейрона — Менделеева. Это уравнение устанавливает математическую зависимость между параметрами идеального газа, находящегося в одном состоянии. Математически его можно записать следующими способами:
Уравнение состояния идеального газа
Внимание! При решении задач важно все единицы измерения переводить в СИ.
Пример №1. Кислород находится в сосуде вместимостью 0,4 м 3 под давлением 8,3∙10 5 Па и при температуре 320 К. Чему равна масса кислорода? Молярная масса кислорода равна 0,032 кг/моль.
Из основного уравнения состояния идеального газа выразим массу:
Уравнение состояния идеального газа следует использовать, если газ переходит из одного состояния в другое и при этом изменяется его масса (количество вещества, число молекул) или молярная масса. В этом случае необходимо составить уравнение Клапейрона — Менделеева отдельно для каждого состояния. Решая систему уравнений, легко найти недостающий параметр.
Подсказки к задачам
| Давление возросло на 15% | p2 = 1,15p1 |
| Объем увеличился на 2% | V2 = 1,02V1 |
| Масса увеличилась в 3 раза | m2 = 3m1 |
| Газ нагрелся до 25 о С | T2 = 25 + 273 = 298 (К) |
| Температура уменьшилась на 15 К (15 о С) | T2 = T1 – 15 |
| Температура уменьшилась в 2 раза | 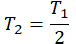 |
| Масса уменьшилась на 20% | m2 = 0,8m1 |
| Выпущено 0,7 начальной массы | |
| Какую массу следует удалить из баллона? | Нужно найти разность начальной и конечной массы: |
| Газ потерял половину молекул | 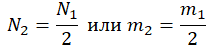 |
| Молекулы двухатомного газа (например, водорода), диссоциируют на атомы | 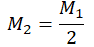 |
| Озон (трехатомный кислород) при нагревании превращается в кислород (двухатомный газ) | M (O3) = 3Ar (O)∙10 –3 кг/моль M (O2) = 2Ar (O)∙10 –3 кг/моль |
| Открытый сосуд | Объем V и атмосферное давление pатм остаются постоянными |
| Закрытый сосуд | Масса m, молярная масса M, количество вещества ν, объем V, число N и концентрация n частиц, плотность ρ— постоянные величины |
| Нормальные условия | Температура T0 = 273 К Давление p0 = 10 5 Па |
| Единицы измерения давления | 1 атм = 10 5 Па |
Пример №2. В баллоне содержится газ под давлением 2,8 МПа при температуре 280 К. Удалив половину молекул, баллон перенесли в помещение с другой температурой. Определите конечную температуру газа, если давление уменьшилось до 1,5 МПа.
2,8 МПа = 2,8∙10 6 Па
1,5 МПа = 1,5∙10 6 Па
Так как половина молекул была выпущена, m2 = 0,5m1. Объем остается постоянным, как и молярная масса. Учитывая это, запишем уравнение состояния идеального газа для начального и конечного случая:
Преобразим уравнения и получим:
Приравняем правые части и выразим искомую величину:

Алгоритм решения
Решение
График построен в координатах (V;Ek). Процесс 1–2 представляет собой прямую линию, исходящую из начала координат. Это значит, что при увеличении объема растет средняя кинетическая энергия молекул. Но из основного уравнения МКТ идеального газа следует, что мерой кинетической энергии молекул является температура:
Следовательно, когда кинетическая энергия молекул растет, температура тоже растет.
Запишем уравнение Менделеева — Клапейрона:
Так как количество вещества одинаковое для обоих состояния 1 и 2, запишем:
ν R = p 1 V 1 T 1 . . = p 2 V 2 T 2 . .
Мы уже выяснили, что объем и температура увеличиваются пропорционально. Следовательно, давление в состояниях 1 и 2 равны. Поэтому процесс 1–2 является изобарным, давление во время него не меняется.
Процесс 2–3 имеет график в виде прямой линии, перпендикулярной кинетической энергии. Так как температуры прямо пропорциональна кинетической энергии, она остается постоянной вместе с этой энергией. Следовательно, процесс 2–3 является изотермическим, температура во время него не меняется. Мы видим, что объем при этом процессе уменьшается. Но так как объем и давление — обратно пропорциональные величины, то давление на участке 2–3 увеличивается.
pазбирался: Алиса Никитина | обсудить разбор | оценить
На высоте 200 км давление воздуха составляет примерно 10 –9 от нормального атмосферного давления, а температура воздуха Т – примерно 1200 К. Оцените плотность воздуха на этой высоте.
Уравнение состояния идеального газа
Вы будете перенаправлены на Автор24
Что такое идеальный газ
Прежде чем знакомиться, с уравнением определим, что такое идеальный газ, состояние которого оно описывает. Идеальный газ самая простая модель системы многих частиц. Он состоит из упругих шаров, обладающих массой и такими размерами, что их можно считать материальными точками. Важное свойство, которое выполняется для движения молекул идеального газа — это то, что точечные частицы испытывают только лобовые соударения, которые подчиняются законам упругого удара. Наиболее близко свойствам идеального газа соответствуют газы, находящиеся под низким давлением. Модель идеального газа позволяет довольно просто математически описать процессы и явления, которые происходят в действительности, если использовать некоторые ограничения. Мы будем постоянно обращаться к этой модели в ходе рассмотрения молекулярно — кинетической теории и термодинамики.
Состояние идеального газа
Состояние идеального газа определяют совокупностью нескольких параметров, важнейшими из них являются давление (p), объем (V), температура по шкале Кельвина (T), масса (m). Параметры состояния связаны друг с другом. Уравнение, которое устанавливает эту связь, называется уравнением состояния идеального газа. Это уравнение можно записать в нескольких видах.
В параметрах p(T):
где $k=1,38 \cdot 10<-23>Дж/К$ — постоянная Больцмана,
n — число молекул в единице объема газа.
В виде, так называемого уравнения Менделеева — Клайперона:
где R= k $N_A=$8,3 Дж/(моль$\cdot $К) — молярная (универсальная) газовая постоянная, $\mu $ — молярная масса газа, $\nu $- количество молей газа, $N_A=6,02\cdot <10>^<23>\frac<1><моль>\ $- постоянная Авогадро.
Если ввести понятие молярного объема:
уравнение состояния (2) можно записать еще в одном виде:
Иногда вместо массы газа рассматривают число его молекул (N) в заданном объеме, тогда удобнее уравнение (2) использовать в виде:
Готовые работы на аналогичную тему
Таким образом, уравнения (1), (2), (3), (4), (5) — различные формы записи одного и того же уравнения состояния идеального газа.
Задание: В баллоне объемом V при температуре T находится смесь идеальных газов, которая содержит три компоненты с количествами молей: $<\nu >_1,\ <\nu >_2,<\nu >_3$. Считая газы идеальными, найдите:
- давление смеси;
- среднюю молярную массу смеси, если известны молярные массы каждой компоненты смеси $(<\mu >_1,\ <\mu >_2,<\mu >_3)$.
В качестве основания для решения используем уравнение состояния идеального газа в виде уравнения Менделеева — Клайперона:
\[pV=\nu RT\ \left(1.1\right).\]
Зная количество молей каждой компоненты газа, легко найти количество молей смеси:
Выразим из (1.1) давление, подставив (1.2), получим:
Для нахождения средней молярной массы смеси запишем уравнение Менделеева — Клайперона в немного другом виде:
где m — масса смеси, которую найдем как:
В (1.4) подставим (1.3) и (1.5), получим:
Ответ: а) Давление смеси при заданных условиях равно $p=\frac<\left(<\nu >_1+<\nu >_2+<\nu >_3\right)RT>
Задание: Найдите максимально возможную температуру 1 моля идеального газа в процессе $p=p_0
Сначала переведем заданное уравнение процесса в параметры T(V). Для этого из уравнения состояния:
\[pV=\nu RT\ \left(2.1\right).\]
Подставим давление в уравнение процесса, получим уравнение процесса в параметрах Т(V):
Для того, чтобы найти максимум функции $T(V)$, как положено в математике, найдем ее производную $\frac
В произведении (2.4) нулю может быть равен нулю только множитель:
Производная $\frac
Переведем в СИ объем $V_0=68,1\ л=6,81•10^<-2>м^3$.
Ответ: Максимальная температура в заданном процессе равна $3,3\cdot 10^<-3>\ К$
Получи деньги за свои студенческие работы
Курсовые, рефераты или другие работы
Автор этой статьи Дата последнего обновления статьи: 18 12 2021
http://spadilo.ru/uravnenie-sostoyaniya-idealnogo-gaza/
http://spravochnick.ru/fizika/molekulyarnaya_fizika/uravnenie_sostoyaniya_idealnogo_gaza/