Хромат калия
| Хромат калия | |
|---|---|
 | |
| Систематическое наименование | Хромат калия |
| Традиционные названия | Хромовокислый калий |
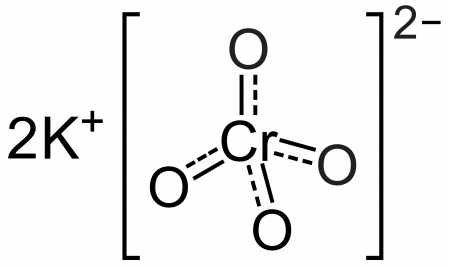
| Хим. формула | K2CrO4 |
| Состояние | жёлтые кристаллы |
| Молярная масса | 194,19 г/моль |
| Плотность | 2,732 г/см³ |
| Температура | |
| • плавления | 968,3; 973 °C |
| • кипения | 1000 °C [1] |
| Растворимость | |
| • в воде | 63,0 20 ; 75,1 80 ; 79,2 100 г/100 мл |
| Показатель преломления | 1,74 |
| Рег. номер CAS | 7789-00-6 |
| PubChem | 24597 |
| Рег. номер EINECS | 232-140-5 |
| SMILES | |
| RTECS | GB2940000 |
| ChEBI | 75249 |
| ChemSpider | 22999 |
| Токсичность | яд и канцероген |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Хромат калия — неорганическое соединение, соль металла калия и хромовой кислоты с формулой K2CrO4, жёлтые кристаллы, растворимые в воде, окрашивает раствор, как и многие другие хроматы, в желтый цвет.
Содержание
- 1 Получение
- 2 Физические свойства
- 3 Химические свойства
- 4 Применение
- 5 Токсичность
Получение
- В природе встречается редкий минерал тарапакаит — хромат калия с примесями.
- Окисление оксида хрома III хлоратом калия:
Cr2O3 + KClO3 + 2K2CO3 → 500−700oC 2K2CrO4 + KCl + 2CO2
- Растворение оксида хрома VI в едком кали:
CrO3 + 2KOH → K2CrO4 + H2O
- Разложение бихромата калия при нагревании:
4K2Cr2O7 → 500−600oC 4 K2CrO4 + 2Cr2O3 + 3O2
- Действие концентрированного раствора едкого кали на дихромат калия:
K2Cr2O7 + 2KOH → 2 K2CrO4 + H2O
Калий хромат и дихромат калия.
Физические свойства
Хромат калия образует жёлтые кристаллы ромбической сингонии, пространственная группа P nam, параметры ячейки a = 0,761 нм, b = 1,040 нм, c = 0,592 нм, Z = 4.
При 668°С переходит в гексагональную красную фазу.
Хорошо растворяется в воде с гидролизом по аниону. Плохо растворим в этаноле.
Химические свойства
- В разбавленных кислотах переходит в дихромат калия:
2K2CrO4 + 2HCl → K2Cr2O7 + 2KCl + H2O
- С концентрированными кислотами реакция идёт иначе:
K2CrO4 + 2HCl → K[Cr(Cl)O3] + KCl + H2O
- С концентрированными горячими кислотами проявляются окислительные свойства:
2 K2CrO4 + 16HCl → 90oC 2CrCl3 + 3Cl2↑ + 4KCl + 8H2O
- Вступает в обменные реакции:
K2CrO4 + 2AgNO3 → Ag2CrO4↓ + 2KNO3 K2CrO4 + Hg2(NO3)2 → Hg2CrO4↓ + 2KNO3
Применение
- В качестве поглотителя УФ излучения лампы накачки в твердотельных лазерах для предотвращения деградации активной среды.
- Как протрава при крашении тканей.
- Окрашивание стекла в жёлтый цвет.
- Дубитель в кожевенной промышленности.
- Отбеливатель для масла и воска.
- Окислитель в органическом синтезе.
- Хромат калия используется как химический стандарт для калибровки калориметров по температуре и теплоемкости.
Токсичность
Хромат калия очень ядовит и канцерогенен, как и многие другие соединения шестивалентного хрома.
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Хромат калия. Получение, химические и физические свойства. ПрименениеХромат калия или хромовокислый калий (международные названия: Kalium chromicum, Kaliumchromat, Potassium chromate) — это неорганическое соединение, кристаллы желтого цвета ромбической системы, растворимые в воде. Относится к солям хромовой кислоты H2CrO4, которая в свободном состоянии не существует. У вещества хромат калия формула следующая: CrK2O4 Как получают хромат калия?Хромовокислый калий получают несколькими способами:
Химические свойства хромата калия:
Физические свойства хромата калия:
Оптические свойства хромата калияПоказатель преломления составляет 1,74. Где применяется калий хромат?
Калий дихромат (техническое название — хромпик)Представляет собой кристаллы красно-оранжевого цвета. Не образует кристаллогидратов, обладает плотностью 2,684 грамм на кубический сантиметр, плавится при температуре 397 градусов. При дальнейшем нагревании разлагается. Растворимость в воде при 20 градусах равна 12,48 грамм соли на 100 грамм воды. Дихромат калия получил широкое применение как окислитель в пиротехнике, спичечной промышленности и в хромаметрии как реагент. источники: http://acetyl.ru/o/nk12cr1o41.php http://fb.ru/article/46787/hromat-kaliya-poluchenie-himicheskie-i-fizicheskie-svoystva-primenenie |


