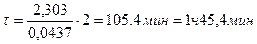Реакция термического разложения оксида золота (III)
Реакция термического разложения оксида золота (III)
Уравнение реакции термического разложения оксида золота (III):
Реакция термического разложения оксида золота (III).
В результате реакции образуются золото и кислород.
Реакция протекает при условии: при температуре 160-290 °C.
Формула поиска по сайту: 2Au2O3 → 4Au + 3O2.
Реакция взаимодействия оксида калия и воды
Реакция взаимодействия гидроксида натрия и оксида углерода (IV)
Реакция взаимодействия манганата калия и пероксида водорода
Выбрать язык
Популярные записи
Предупреждение.
Все химические реакции и вся информация на сайте предназначены для использования исключительно в учебных целях — только для решения письменных, учебных задач. Мы не несем ответственность за проведение вами химических реакций.
Химические реакции и информация на сайте
не предназначены для проведения химических и лабораторных опытов и работ.
Зависимость скорости реакции от температуры
Скорость большинства химических реакций с повышением температуры возрастает. Это зависимость приближённо описывается эмпирическим правилом Вант-Гоффа: при повышении на каждые 10 градусов скорость химической реакции увеличивается в 2-4 раза.
Математически правило Вант-Гоффа можно выразить следующей математической зависимостью:
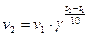
где v1 – cкорость реакции при температуре t1; v2 – скорость реакции при температуре t2; γ – температурный коэффициент скорости, равный 2-4 для разных реакций.
Более точно зависимость константы скорости от температуры описывается уравнением Аррениуса:
k = P·Z·e 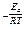
где k – константа скорости реакции; Z – частота столкновений (число столкновений в единице объёма за единицу времени), измеряется в единицах константы скорости; R – газовая постоянная, кДж/моль∙К; Т – абсолютная температура, К; Еа – энергия активации, кДж/моль.
Под энергией активации понимают минимальный избыток энергии (по сравнению с величиной средней энергии молекул), которым должны обладать молекулы для того, чтобы реакция между ними стала возможной. Такие молекулы называются активными.
Множитель e 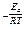
В уравнение Аррениуса введён также поправочный множитель Р (стерический фактор), учитывающий ориентацию сложных молекул в пространстве в момент столкновения по отношению друг к другу. Чем сложнее участвующие в реакции молекулы, тем меньше Р, а значит, и скорость реакции.
Уравнение Аррениуса можно представить также в виде:
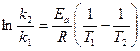
где k1, k2 – константы скорости соответственно при температурах Т1 и Т2.
Уравнение (98) используют для вычисления константы скорости реакции при заданной температуре, если известна величина её для другой (близкой) температуры и величина Еа. Интервал температур Т1 и Т2 необходимо брать близким, так как в широком диапазоне Еа заметно изменяется. Можно также по двум константам скоростей, измеренным при двух близких температурах, вычислить энергию активации данной реакции.
Пример 14. Реакция между веществами А и В выражается уравнением
Начальная концентрация вещества А равна 3,2 моль/л, а вещества В – 1,6 моль/л. Константа скорости реакции 0,75. какова скорость реакции в начальный момент и по истечении некоторого времени, когда концентрация вещества А уменьшилась на 0,5 моль/л?
Решение. Используем уравнение (86) для вычисления скорости реакции в начальный момент
v0 = k ·(с 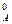
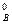
По истечении некоторого времени, когда концентрация вещества А уменьшится на 0,5 моль/л, концентрация вещества В (в соответствии с уравнением химической реакции) должна уменьшится на 0,25 моль, т.е.
сВ = 1,6 – 0,25 = 1,35 моль/л.
Следовательно, скорость реакции станет равной
v1 = k ·(с 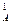
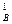
Пример 15. Реакция разложения пероксида водорода в водном растворе протекает как реакция первого порядка. Период полураспада при данном условии равен 15,86 мин. Определить, какое время потребуется для разложения (при заданных условиях) 99% пероксида водорода.
Решение. По периоду полураспада, используя выражение (91), вычислим константу скорости разложения перикиси водорода:
k = 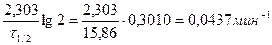
Зная константу, определяем время, за которое разложится 99% перекиси водорода:
k = 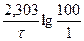
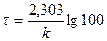
Пример 16. Вычислить по правилу Вант-Гоффа, при какой температуре реакция закончится за 25 мин, если при 20ºС на это требуется 2ч. Температурный коэффициент скорости реакции равен 3.
Решение. Между константами скоростей и временем завершения реакции существует обратно пропорциональная зависимость
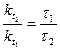
где τ1 и τ2 – время завершения реакции при температурах t1 и t2.
Тогда уравнение (96) можно записать
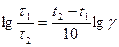
t2 – t1 = 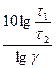
а t2 = 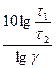
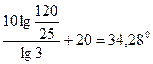
Пример 17. Для одной из реакций опытным путём были определены две константы скорости при 443ºС – 0,0067, а при 508ºС – 0,1059. Определить энергию активации данной реакции.
Решение. Используя формулу (98), откуда получаем
Еа = 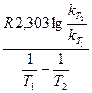
Еа = 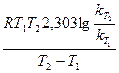
Т1 = 443 + 273 = 716 К; Т2 = 508 + 273 = 781 К; R = 8,314 Дж/(моль·К);
Еа = 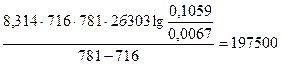
Вариант 1.
10. Рассчитайте среднюю скорость некоторой реакции, если за 10 мин концентрация реагента уменьшилась от 0,05 моль/дм 3 до 0,01 моль/дм 3 .
11. При какой температуре период полупревращения равен 1 час, если энергия активации реакции равна 100 кДж/моль, а предэкспоненциальный множитель константы скорости равен 10 13 с -1 ?
Вариант 2.
10. Для некоторой реакции при повышении температуры константа скорости изменяется следующим образом (табл.):
| Т, К | |||
| k, моль -1 ∙дм 3 ∙с -1 | 5,41·10 -3 | 0,11 | 0,82 |
Найдите графическим и аналитическим методами энергию активации этой реакции.
11. Некоторая реакция при t=25ºC завершается за 2 часа. через какое время закончится эта реакция при t=75ºC, если её температурный коэффициент равен 2?
Вариант 3.
10. Реакция взаимодействия триэтиламина с метилиодидом в растворе четырёххлористого углерода
является реакцией второго порядка. При Т=293 К константа скорости реакции равна 2,48·10 -2 дм 3 /(моль·мин). Начальные концентрации обоих реагентов равны 0,224моль/дм 3 . Определить концентрацию триэтиламина через 5 часов после начала реакции.
11. Реакция разложения SO2Cl2:
является реакцией первого порядка. При 552 К константа скорости реакции равна 0,609·10 -4 мин -1 ; а при 593 К – 13,20·10 -4 мин -1 . Рассчитайте период полупревращения этой реакции при 688 К.
Вариант 4.
10. Реакция взаимодействия триэтиламина с метилиодидом в растворе четырёххлористого углерода
является реакцией второго порядка. При Т=293 К константа скорости реакции равна 2,48·10 -2 дм 3 /(моль·мин). Начальные концентрации обоих реагентов равны 0,224моль/дм 3 . Определить время, в течение которого концентрация (C2H5)3N уменьшится в 1,5 раза.
11. Для реакции первого порядка:
протекающей при температуре 1085 К, энергия активации равна 256,75 кДж/моль, предэкспоненциальный множитель константы скорости реакции равен 1,33·10 9 с -1 . Определите время, в течение которого концентрация N2O изменится от 0,21 моль/дм 3 до 0,07 моль/дм 3 .
Вариант 5.
10. Для некоторой реакции первого порядка период полупревращения составляет 2 года. Сколько потребуется времени, чтобы концентрация исходного вещества уменьшилась в 10 раз?
11. Для реакции, протекающей по уравнению:
при 288 К константа скорости равна 0,31·10 -3 дм 3 /(моль·мин). Энергия активации равна 97,06 кДж/моль. Чему будет равна константа скорости этой реакции при температуре 313 К?
Вариант 6.
10. Как изменятся скорости прямой и обратной реакции
при увеличении давления в два раза и постоянной температуре?
11. При одинаковой концентрации реагирующих веществ скорость некоторой реакции, протекающей при 35ºC, в два раза выше, чем при 25ºC. Вычислить энергию активации данной реакции.
Вариант 7.
10. Во сколько раз увеличится скорость прямой реакции
протекающей в закрытом сосуде, если увеличить давление в пять раз без изменения температуры?
11. Для реакции первого порядка А → С период полупревращения при 450 К равен 40 мин. Предэкспоненциальный множитель константы скорости реакции равен 5,4·10 11 с -1 . Определить, чему равна величина энергии активации данной реакции.
Вариант 8.
10. В закрытом сосуде находится смесь газов, состоящая из 1 моль азота и 3 моль водорода, которая реагирует по уравнению
Во сколько раз уменьшится скорость прямой реакции после того, как прореагирует 0,65 моль азота?
11. Энергия активации реакции второго порядка, протекающей при температуре 627 К,
равна 111,2 кДж/моль. Предэкспоненциальный множитель константы скорости реакции равен 3,36·10 9 дм 3 /(моль·с). Начальная концентрация NO2 равна 0,09 моль/дм 3 . Определите период полупревращения для этой реакции.
Вариант 9.
10. разложение закиси азота на поверхности золота при высоких температурах протекает по уравнению
Константа скорости данной реакции 0,0005 при 900ºС. начальная концентрация закиси азота 3,2 моль/л. определить скорость реакции при указанной температуре в начальный момент и когда произойдёт разложение 78% закиси азота.
11. Константа скорости омыления уксусноэтилового эфира гидроксидом натрия при 282,6 К равна 2,37 дм 3 /(моль·мин), а при 287,6 К – 3,20 дм 3 /(моль·мин). При какой температуре константа скорости будет равна 4,00 дм 3 /(моль·мин)?
Вариант 10.
10. Реакция между веществами А и В протекает по уравнению
Концентрация вещества А равна 1,5 моль/л, а В – 3 моль/л. Константа скорости реакции 0,4. Вычислить скорость химической реакции в начальный момент времени и по истечении некоторого времени, когда прореагирует 75% А.
11. Вычислить по правилу Вант-Гоффа, при какой температуре реакция закончится в течение 20 мин, если при 20ºC на это требуется 3 ч. Температурный коэффициент скорости принять равным 2.
Читать учебное пособие по всему другому: «Методические указания и контрольные задания для учащихся заочников по специальности 2 48 01 35 «Переработка нефти и газа» Новополоцк» Страница 34
321. Разложение оксида азота (I) на поверхности золота при высоких температурах протекает по уравнению N2О N2 + О. Константа скорости данной реакции при 900 ºС 5х10-4. Начальная концентрация N2О 3,2 моль/л. Определите скорость реакции при указанной температуре в начальный момент и когда произойдет разложение 78 % начального количества оксида.
322. Константа распада Rа А равна 3,79х10-3 с-1. Определите период половины превращения 1/2 и время, за которое Rа А распадается на 90 %.
323. В сосуде имеется 0,025 г радона. Период половины превращения 1/2 радона 3,82 дня. Какое количество радона (в масс.долях, %) останется в сосуде через 14 дней?
324. Период половины превращения тория С равен 60,5 мин. Через какое время активность тория С будет составлять 20 % от первоначальной?
325. Реакция НСОН + Н2О2 = НСООН + Н2О является двумолекулярной. При смешении равных объемов 1 М растворов Н2О2 и муравьиного альдегида через 2 ч при 60 ºС концентрация муравьиной кислоты становится 0,215 моль/л. Вычислите константу скорости реакции и определите, за какое время (1/2) прореагирует половины исходных веществ.
326. Константа скорости двумолекулярной реакции омыления этилового эфира уксусной кислоты едким натром при 10 ºС равна 2,38 (концентрация выражена в моль/л, время – в мин). Какое время потребуется на омыление 80 % эфира, если смешать при 10 ºС 1 л 0,04 н. Раствора уксусноэтилового эфира с 1 л 0,04 н. NаОН? Как изменится время реакции, если исходные растворы будут разбавлены в 10 раз?
327. Термическое разложение окиси этилена является реакцией первого порядка. При 378,5 ºС период половины превращения окиси этилена равен 363 мин. Определите константу скорости реакции при 450 ºС. Энергия активации данной реакции 217 кДж/моль.
328. Константа скорости реакции разложения органической кислоты в водном растворе при 20 ºС 4,75х10-4, а при 40 ºС – 5,76х10-3 (время выражено в минутах). Определите период половины превращения кислоты при 30 ºС, если разложение ее протекает по закону реакции первого порядка.
329. Соль диазония в водном растворе разлагается по уравнению СН3С6Н4N2Сl + Н2О = СН3С6С4ОН + N2 + НСl Процесс разложения при большом избытке воды является реакцией первого порядка. Константы скорости реакции при 24,7 и 30 ºС соответственно равны 9х10-3 и 1,3х10-2 мин-1. Вычислить константу скорости этой реакции при 35 ºС и время, в течение которого при этой температуре распадается 99,9 % соли диазония.
330. При 25 и 40 ºС константы скорости реакции разложения гипохлорита натрия в растворе равны соотвественно 0,0093 и 0,0342. Вычислите по уравнению Аррениуса, использовав приближенное правило Вант-Гоффа, константу скорости этой реакции при 50 ºС.
331. Золь йодида серебра получен при постепенном добавлении к 20 см3 0,01 н. Раствора КI 15 см3 0,2 %-ного раствора нитрата серебра. Напишите формулу мицеллы образовавшегося золя и определите направление движения частиц его в электрическом поле. Плотность раствора нитрата серебра принять равной единице.
332. Какой объем 0,005 н. AgNО3 надо прибавить к 20 см3 0,015 н. КI, чтобы получить положительный золь йодида серебра? Напишите формулу мицеллы.
333. Золь гидроксида железа (III) получен при добавлении к 85 см3 кипящей дистиллированной воды 15 см3 2%-ного раствора хлорида железа (III). При этом соль частично подвергается гидролизу: FеСl3 + 3Н2О Fе(ОН)3 + 3НСl Напишите возможные
http://helpiks.org/1-41157.html
http://referat.co/ref/716393/read?p=34