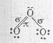Реакция разложения озона
2O3  3O2
3O2
Реакция разложения озона с образованием кислорода. Реакция протекает при температуре около 250°C. Катализатором может выступать оксид марганца(IV).
В растворе реакция медленно протекает при комнатной температуре.
- 2O3 = 3O2, ΔH 0 = -285 кДж.
Разложение озона на кислород согласно уравнению
Содержание:
Озон (от др.-греч. ὄζω — пахну) — состоящая из трёхатомных молекул O3 аллотропная модификация кислорода. При нормальных условиях — голубой ядовитый газ. Запах — резкий специфический. При сжижении превращается в жидкость цвета индиго.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Кислород в природе встречается в виде двух простых веществ: кислорода 

Явление образования нескольких простых веществ одним элементом
называется аллотропией (рис. 37). Разные простые вещества, образованные одним и тем же химическим элементом, называются аллотропными видоизменениями (модификациями).
Формула озона 
температура плавления – 193°C, в жидком состоянии цвет темно-синий, а в твердом –
от синего до темно-фиолетового. Этот газ был впервые обнаружен голландским химиком Мартином фон Меррумом (1785).
Химические свойства озона
Озон химически более активен, чем кислород, и может окислять благородные металлы: золото, серебро, платину:
Активность озона обусловлена его разложением на молекулярный и атомарный кислород:
Этим же объясняется свежесть воздуха после грозы в сосновом бору. Атомарный кислород – более сильный окислитель, чем молекулярный. Данное свойство применяется при обеззараживании питьевой воды и при отбеливании ткани, бумаги, соломы и т. д. Применение озона при обеззараживании вместо хлора экологически более выгодно. Озон, окисляя примеси сточных вод, превращается в кислород.
В верхних слоях атмосферы на высоте 25 км над землей (в стратосфере) образуется тонкий слой озона , который защищает Землю от чрезмерной дозы ультрафиолетовых лучей (УФО) Солнца (рис. 38). Этот слой разрушается под воздействием различных факторов («озоновые дыры»). Например, при запуске ракетоносителя космического корабля, а также двигатели самолетов выбрасывают в верхние слои атмосферы определенную массу оксидов азота (II).
Оксид азота (II) вступает в реакцию с озоном:
Это приводит к всевозможным природным катаклизмам (глобальное потепление, таяние ледников и айсбергов, цунами, тайфуны, сели, торнадо и т. д.).
Практическая работа №3
Получение кислорода и изучение его свойств
Цель: учащиеся самостоятельно проводят работу, изучают свойства кислорода. Знать свойства кислорода как окислителя.
Ход работы
1. Соберите прибор по рис. 30 (с. 88).
2. В колбу наберите немного раствора пероксида водорода с помощью капельной воронки.
3. Всыпьте в колбу заранее приготовленный диоксид марганца. Затем колбу закройте пробкой с газоотводной трубкой. Что наблюдаете?
4. Соберите выделившийся кислород в большие пробирки.
5. В железную ложку положите небольшой кусочек серы, зажгите его в пламени спиртовки и внесите в сосуд с кислородом, постепенно опуская ложечку.
6. После сжигания серы влейте в сосуд немного воды, закройте сосуд и хорошо взболтайте, затем подействуйте индикатором – метилоранжем.
Услуги по химии:
Лекции по химии:
Лекции по неорганической химии:
Лекции по органической химии:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
Строение и химические свойства озона. Применение озона
Задача 837.
Описать электронное строение молекулы O3, сравнить химическую активность озона и молекулярного кислорода O2. Как получить озон из молекулярного кислорода?
Решение:
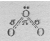
Электронное строение трёхатомной молекулы озона можно представить схемой:
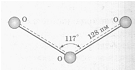
Установлено, что все связи центрального атома кислорода с двумя другими атомами кислорода одинаковы (равноценны) как по длине, так и по энергии. Значит σ- связь, образованная негибридизированными р-орбиталями, является трёхцентровой ковалентной, т.е. электронная — пара делокализована и принадлежит в равной степени всем трём атомам кислорода. Молекула О3 построена в форме равнобедренного треугольника, угол при вершине треугольника 117 0 , что указывает на то, что, центральный атом кислорода находится в состоянии sp 2 – гибридизации. Гибридная sp 2 – орбиталь, содержащая один электрон в центральном атоме, перекрывается с негибридной рх – орбиталью одного из крайних атомов кислорода, образуя σ — связь. Не участвующая в гибридизации рz – орбиталь центрального атома перекрывается с рz – орбиталью другого атома кислорода, образуя σ — связь. Наконец, выступая в качестве донора электронной пары центральный атом кислорода, образует с другим атомом кислорода σ — связь по донорно-акцепторному механизму. Структуру молекулы О3 можно представить схемой:
Рис.3. Структура молекулы О3
Озон как и кислород является сильнейшим окислителем. Он окисляет все металлы, кроме золота и платины. Озон переводит низшие оксиды в высшие, а сульфаты металлов – в их сульфиты. В ходе этих реакций молекула озона теряет один атом кислорода, переходит в молекулу кислорода.
Из раствора иодида калия озон выделяет йод (качественная реакция на О3):
Таким образом, озон более сильный окислитель, чем кислород.
Озон можно получить из молекулярного кислорода действием на последний тихих электрических разрядов:
В природе озон образуется под действием электрических разрядов.
Задача 838.
Может ли при комнатной температуре протекать реакция взаимодействия кислорода: а) с водородом; б) с азотом? Ответ мотивировать, используя табличные данные стандартных значений энергии Гиббса образования веществ, участвующих в процессах.
Решение:
Уравнение реакции взаимодействия водорода с кислородом имеет вид:
Реакция протекает с большим выделением теплоты. Энергия Гиббса образования Н2О имеет отрицательное значение (-228,8 кДж/моль),
ΔG 0 0 С реакция протекает со скоростью в несколько дней, а при 500 0 С кислород и водород полностью прореагируют за несколько часов, при 700 0 С происходит быстрый подъём температуры и реакция заканчивается взрывом. Поэтому, чтобы вызвать взрыв смеси водорода с кислородом, нужно подогреть её хотя бы в одном месте до 700 0 С.
б) При обычных условиях кислород и азот не реагируют друг с другом. Объяснить это можно тем, что энергия Гиббса всех оксидов азота имеет положительное значение, ΔG 0 > 0. Из табличных данных следует, что энтальпия образования всех оксидов азота тоже положительна, т. е. данные реакции являются эндотермическими. Малая скорость взаимодействия кислорода с азотом объясняется высокой энергией активации этих процессов. Молекулы кислорода и азота очень прочны, поэтому чтобы сделать кинетическую энергию сталкивающихся молекул большой необходимо очень сильно повысить температуру системы. И только при достаточно высокой температуре некоторые соударения молекул кислорода и азота становятся эффективными и приводят к образованию активных центров. Так кислород и азот взаимодействуют при температуре электрической дуги (3000 – 4000 0 С):
N2 + O2 
Это эндотермическая реакция, поэтому наблюдается тенденция к уменьшению внутренней энергии, что способствует протеканию данного процесса в обратном направлении, а тенденция к увеличению вероятности состояния вызывает её частичное протекание в прямом направлении. Поэтому, чтобы система N2 + O2 = 2NO достигла наиболее вероятного состояния, необходима высокая температура. Поэтому все оксиды азота получают косвенным путём.
Задача 839.
После озонирования при постоянной температуре некоторого объема кислорода установлено, что объем газа, приведенный к исходному давлению, уменьшился на 500 мл. Какой объем озона образовался? Какое количество теплоты поглотилось при его образовании, если для озона ΔН 0 298о = 144,2 кДж/моль?
Решение:
Уравнение реакции:
Из уравнения реакции следует, что из 3 моль кислорода образуется 2 моль озона, т.е. объём системы уменьшается на 1 моль. Можно записать соотношение, показывающее зависимость от образовавшегося объёма озона и уменьшением объёма системы, получим:
2 : 1 = х : 0,5; х = (2 . 0,5)/1 = 1л.
Находим ΔН 0 реакции:
ΔН 0 х.р. = 2 ΔН 0 (O3) — 3 ΔН 0 (O2) = (2 . 144,2) – 3 . 0 = 288,4 кДж.
Количество теплоты рассчитаем из пропорции:
2 : 22,4 : 288,4 = 1 : х; х = (288,4 . 1)/ (2 . 22,4) = 6,44 кДж.
Ответ: 1л О3; 6,44 кДж.
http://natalibrilenova.ru/ozon/
http://buzani.ru/zadachi/khimiya-glinka/1275-kharakteristika-ozona-zadachi-837-839
 3O2
3O2