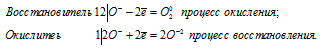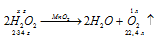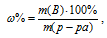Получение, строение и свойства пероксида водорода
Задача 797.
Указать способы получения пероксида водорода, привести уравнения реакций.
Решение:
В промышленности пероксид водорода получают электрохимическим методами, например, анодным окислением растворов H2SO4 или (NH4)HSO4 с последующим гидролизом образующейся при этом пероксодвусерной ислоты H2S2O8.
При электролизе H2SO4 (50% раствор) на катоде разряжаются ионы водорода Н + , а на аноде — HSО4 — . Последние, теряя свои заряды, соединяясь попарно, образуют перокусодвусерную кислоту:
На катоде: 2Н + + 2 
На аноде: 2HSО4 — — 2 
или 2H2SO4 = H2S2O8 + 2H + + 2
При электролизе (NH4)HSO4 на катоде разряжается молекулы воды, а на аноде — HSО4 — . Последние, теряя свои заряды, соединяясь попарно, образуют перокусодвусерную кислоту:
На катоде: 2Н2О + 2 
На аноде: 2HSО4 — — 2 
Далее перокидвусерная кислота подвергается гидролизу, сопровождающемуся образованием серной кислоты и пероксида водорода:
Фактически электролиз протекает до тех пор пока в рабочем растворе не закончится или H2SO4, или (NH4)HSO4.
Задача 798.
Можно ли получить Н2О2. непосредственным взаимодействием водорода и кислорода? Ответ обосновать.
Решение:
Пероксид водорода образуется в качестве промежуточного продукта при горении водорода:
Но ввиду высокой температуры водородного пламени тотчас же разлагается на воду и кислород (2Н2О2 ) ⇔ 2Н2О + О2). Однако, если направить водородное пламя на кусок льда, то в образующейся воде можно обнаружить следы пероксида водорода. Пероксид водорода можно получить при действии атомарного водорода на кислород.
Таким образом, непосредственным взаимодействием водорода и кислорода пероксид водорода невыгодно получать ни в лаборатории, ни в промышленности.
Задача 799.
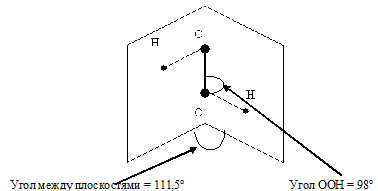
Описать строение молекулы Н2О2. Почему эта молекула полярна?
Решение:
Молекула H2O2 неплоская, имеет строение H−O−O−H с 
Степень окисления кислорода равна −I, валентность атома O равна 2. Группу −O−O− называют пероксогруппой. Энергия связи О—О (210 кДж/моль) почти в 2 раза меньше энергии связи О—Н (468 кДж/моль), длина связи О—О равна 0,145нм. Из-за несимметричного распределения связей Н — О молекула Н2О2 сильно полярна. Между молекулами Н2О2 возникает довольно прочная водородная связь, поэтому в обычных условиях Н2О2 – сиропообразная светло-голубая жидкость с высокой температурой кипения равной 150 °С. Температура плавления 0,41°С. Почти в 1.5 раза тяжелее воды, поверхностное натяжение ( 
Задача 800.
Написать уравнение реакции разложения пероксида водорода. К какому типу окислительно-восстановительных реакций она относится?
Решение:
Уравнение реакции разложения пероксида водорода имеет вид:
Данная реакция относится к окислительно-восстановительным реакциям самоокисления-самовосстановления, потому что пероксид водорода в реакции разложения является и восстановителем, и окислителем одновременно. Степень окисления кислорода изменяется от -1 до -2 (восстановление) и от -1 до 0 (окисление), потому что кислород в пероксиде водорода находится в своей промежуточной степени окисления (-1).
Уравнения электронного баланса:
4О — = О2 0 + 2О 2-
Задача 801.
К 150 г раствора Н2О2 прибавили немного диоксида марганца. Выделившийся кислород при нормальных условиях занял объем 10 -3 м 3 . Вычислить массовую долю Н2О2 в исходном растворе.
Решение:
Уравнение реакции имеет вид:
М(Н2О2) = 34г/моль; m(H2O2) = 34г.
Находим массу разложившегося пероксида водорода из пропорции:
х : 68 = 1 : 22,4;
х = (1,68)/22,4 = 3,04г.
Массовую долю пероксида водорода находим из уравнения:
где w% — массовая доля вещества В; m(B) – масса вещества В; m(р-ра) – масса раствора.
Разложение пероксида водорода
Разложение пероксида водорода это процесс разделения молекулы пероксида водорода на воду и кислород, так как концентрированная перекись непрочное соединение, уже при комнатной температуре на свету разлагается по реакции (формула разложения пероксида водорода):
Реакция ускоряется со прикосновением с катализаторами ( MnO2 , PbO2 и другие ).
Каталитическое разложение пероксида водорода
Пероксид водорода весьма удобный объект для иллюстрации каталитического процесса, влияния различных катализаторов на скорость химической реакции.
Измерение объема кислорода, выделяющегося при разложении пероксида водорода, позволяет проводить этот опыт количественно, притом с достаточной степенью точности.
Активные вещества которые участвуют в интенсивном распаде молекулы пероксида водорода являются металлы переменной валентности (Fe, Сu, Мn, Со, Сr) и их соли.
Разложение пероксида водорода катализаторами сводится к увеличению электролитической диссоциации пероксида водорода, что содействует образованию свободного гидроксид – иона и ускорению распада пероксида водорода.
Разложение пероксида водорода обратимая или нет.
Экспериментально доказано, что добавление к перекиси катализатора приводит к полному разложения молекулы пероксида водорода на воду и кислород. Процесс разложения на прямую зависит от температуры вещества.
А также какой катализатор добавлен, также установлено, что на каталитический процесс разложения влияет добавление некоторых кислот и зависимость концентрации перекиси.
Лабораторное разложение перекиси водорода

То, что было осуществлено в науке химии как нечто новое, может быть повторено на внеурочных и факультативных занятиях как интересные ученические исследования.
Pис. 2 Установка для количественного опыта разложения пероксида водорода:
1-колба для перегонки, 2 — пробирка с катализатором. 3 — чаша кристаллизационная, 4 — эвдиометр.
Во время проведения демонстрационных экспериментов следует знать о пероксиде водорода (обычно 3%-ном) как о веществе, которое подвергается бурному разложению под действием различных катализаторов.
С этой целью в демонстрационные пробирки приливают по 30 мл раствора пероксида водорода и в каждый вносят одно из следующих веществ: оксид марганца (IV), оксид железа (III), активированный уголь, раствор перманганата калия, раствор хлорида железа (III), раствор дихромата калия, кусочек сырого мяса, содержащий фермент каталазу, находящуюся обычно в крови млекопитающих и человека.
Наблюдают за выделением пузырьков газа. Выделение кислорода подтверждают тлеющей лучинкой. Демонстрационные пробирки размещают в штативе с подсветом.
Количественный опыт каталитического разложения пероксида водорода может быть осуществлен в установке, показанной на рисунке 2.
Для собирания газа можно использовать промышленный эвдиометр, имеющий градуировку. Различную скорость образования кислорода можно наблюдать в приборе, описание которого дано В. С. Полосиным, с использованием двух медицинских шприцев, а также с помощью установки для проецирования опытов на экран.
Активность катализатора

Рис. 3. Определение активности различных катализаторов:
1 — пробирка с пероксидом водорода, 2 — колба с катализатором, 3 — стеклянная трубка с пробкой, 4 — Г образная газоотводная трубка, 5 — колба с водой, 6 — сифон, 7 — стакан с водой, 8 — зажимы.
Опыт разложение пероксида водорода
Рекомендуется проводить опыты в следующей последовательности:
- Проверяют герметичность прибора (рис. 3), для чего закрывают пробки и открывают зажимы 8: вода не должна вытекать в стакан.
- В пробирку 1 наливают 5 мл пероксида водорода (30%-ного) и перекрывают резиновую трубку зажимом 8.
- В колбу 2 вносят катализатор и вставляют в нее трубку 3, соединенную с пробиркой 1.
- Выравнивают давление внутри прибора с атмосферным давлением. С этой целью открывают зажим 8 сифона 6 и поднимают стакан 7 с водой так, чтобы вода в нем и в колбе находилась на одинаковом уровне, и затем снова закрывают зажим.
- Воду выливают из стакана и наливают в него точный ее объем — 100 мл, предварительно отмерив его мензуркой.
- Опускают кончик сифона 6 в стакан 7 с водой.
- Открывают оба зажима 8 на приборе и быстро вливают пероксид водорода в колбу 2 с катализатором.
- Через 3 мин вновь приводят давление внутри прибора к атмосферному давлению.
- Закрывают зажим сифона 6 и измеряют объем воды, вытесненной в стакан кислородом.
- Из измеренного объема воды вычитают 100 мл, т. е. объем воды, ранее добавленной в стакан.
По количеству выделившегося кислорода располагают испытанные катализаторы в порядке возрастания их каталитической активности.
Физические свойства пероксида водорода Н2О2
Сильный окислитель. Мол. массе 34,01; коэф. рефр. 1,4067 при 25 °С; плотн. 1448 кг/м3; т. кил 69,7 °С при 3,72 кПа и 80,2 °С при 6,25 кПа. Смешивается в любых соотношениях с водой.
При воздействии 65% -ного р-ра Н2О2 на бумагу, опилки и другие горючие вещества происходит их воспламенение.
Концентрированный раствор может взрываться. Для раствора пероксида водорода низкой концентрации возможно саморазложение при воздействии тепла.
В присутствии органической пыли или веществ, действующих каталитически (металлы, соли металлов).
Хранить растворы пероксида водорода в темном прохладном месте. В присутствии Н2О2 средства тушения обильные струи воды.
Можно ли получить перекись водорода из водорода и кислорода
Можно ли получить Н2О2 непосредственным взаимодействием водорода и кислорода? В реакции взаимодействия водорода с кислородом образуется пероксид водорода в качестве промежуточного продукта при горении водорода:
Так как температура горения водорода очень высока перекись водорода сразу же разлагается на воду и кислород:
Для определения образования перекиси водорода можно воспользоваться кусочком льда. Для этого нужно направить водородное пламя на кусок льда.
В образующейся воде можно обнаружить следы пероксида водорода. Также пероксид водорода можно получить при действии атомарного водорода на кислород.
Непосредственным взаимодействием водорода и кислорода пероксид водорода невыгодно получать ни в лаборатории, ни в промышленности.
Статья на тему Разложение пероксида водорода
Похожие страницы:
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
УЧЕБНАЯ КНИГА ПО ХИМИИ
ДЛЯ УЧИТЕЛЕЙ СРЕДНИХ ШКОЛ,
СТУДЕНТОВ ПЕДАГОГИЧЕСКИХ ВУЗОВ И ШКОЛЬНИКОВ 9–10 КЛАССОВ,
РЕШИВШИХ ПОСВЯТИТЬ СЕБЯ ХИМИИ И ЕСТЕСТВОЗНАНИЮ
УЧЕБНИК


Продолжение. См. № 4–14, 16–28, 30–34, 37–44, 47, 48/2002;
1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23,
24, 25-26, 27-28, 29, 30, 31, 32, 35, 36, 37, 39, 41, 42, 43, 44, 46, 47/2003;
1, 2, 3, 4, 5, 7, 11, 13, 14, 16, 17, 20, 22/2004
§ 8.1 Окислительно-восстановительные реакции
ЗАДАЧИ И ВОПРОСЫ
1. Воспользовавшись электронно-ионным способом подбора стехиометрических коэффициентов, составьте уравнения окислительно-восстановительных реакций, протекающих по следующим схемам (формула воды не указана):
Обратите внимание, что среди соединений есть органические вещества! Попытайтесь подобрать коэффициенты, пользуясь степенями окисления или валентностями.
2. Выберите любые два уравнения электродных реакций:
Составьте из двух выписанных уравнений электродных процессов одно суммарное уравнение. Назовите окислитель и восстановитель. Рассчитайте ЭДС реакции, ее 
Если вы забыли, как следует поступить, вспомним, что говорилось выше. Вы выписываете из этого списка два любых уравнения. Смотрите на значения их электродных потенциалов и одно из уравнений переписываете в противоположном направлении. Какое, почему и зачем? Вспоминаете, что числа отданных и принятых электронов должны быть равны, умножаете коэффициенты на некоторое число (какое?) и суммируете оба уравнения. Также суммируются и электродные потенциалы, но их вы не умножаете на число участвующих в процессе электронов. Положительное значение ЭДС говорит о возможности прохождения реакции. Для расчета
G и константы равновесия подставьте вычисленное вами значение ЭДС в формулы, которые были выведены ранее.
3. Устойчив ли водный раствор перманганата калия? По-другому вопрос можно сформулировать так: будет ли перманганат-ион реагировать с водой с образованием кислорода, если
4. Окисление кислородом воздуха в водном растворе описывается уравнением:
Определите, можно ли кислородом воздуха окислить вещества, записанные в правой части любого уравнения задания 2. В правой части этих уравнений записаны восстановители. Учитель укажет вам номер уравнения.
Вам может показаться, что это задание трудно выполнить. Это и есть основной недостаток вашего характера – вам кажется, что задача невыполнима, и вы сразу отказываетесь от попытки ее решить, хотя все необходимые знания у вас имеются. В данном случае следует написать уравнение реакции между кислородом и ионами водорода и интересующее вас уравнение. Посмотреть, какая из реакций обладает более высокой способностью отдавать электроны (ее потенциал должен быть более отрицательным или менее положительным), переписать ее уравнение в противоположном направлении, изменив знак электродного потенциала на противоположный, и просуммировать с другим уравнением. Положительное значение ЭДС укажет на возможность прохождения реакции.
5. Напишите уравнение реакции между перманганат-ионом 
А у меня получилось следующее уравнение:
7Н2О2 + 2 
Найдите ошибку, если я ее сделал, или объясните, почему ваши коэффициенты другие. Это задание рассчитано на проверку вашей сообразительности и знание материала других разделов химии.
Реакция перманганат-иона с пероксидом водорода в кислотном растворе (серная кислота) может быть представлена несколькими уравнениями с различными коэффициентами, например:
5Н2О2 + 2
+ 6Н + = 2Mn 2+ + 5О2 + 8Н2О,
7Н2О2 + 2 
9Н2О2 + 2 
Укажите причину этого и напишите хотя бы еще одно уравнение реакции перманганат-иона с пероксидом водорода.
Если вам удалось объяснить причину такого странного явления, объясните причину возможности написания следующих уравнений:
3Н2О2 + 2 
Н2О2 + 2 
Могут ли проходить реакции в соответствии с двумя этими уравнениями?
Ответ. На реакцию перманганат-ионов с пероксидом водорода накладывается параллельная реакция разложения пероксида водорода:
Вы можете основное уравнение реакции просуммировать с бесконечно большим числом этого уравнения и получить множество уравнений с различными стехиометрическими коэффициентами.
6. Это задание может служить темой реферата или доклада.
Обсудите возможность прохождения реакции восстановления ионов Fe 3+ пероксидом водорода в водном растворе:
Рассчитайте ЭДС реакции, ее 
Изучение зависимости скорости реакции от концентрации компонентов показало, что при увеличении концентрации по отдельности Fe 3+ или H2O2 в два раза скорость реакции возрастает в два раза. Каково кинетическое уравнение реакции? Определите, как изменится скорость реакции при увеличении концентрации Fe 3+ или H2O2 в три раза. Предскажите, как изменится скорость реакции при разбавлении раствора водой в два или десять раз.
Предложен следующий механизм реакции:
Н2О2 = Н 
Fe 3+ + H 
Fe 3+ + HO2 = Fe 2+ + H + + O2 (быстрая).
Докажите, что этот механизм не противоречит вышерассмотренной зависимости скорости от концентраций реагирующих веществ. Какая стадия является лимитирующей? Какова ее молекулярность и каков ее порядок? Каков общий порядок реакции? Обратите внимание на существование таких сложных ионов и молекул, как H 
7. Переведите на русский язык.
Аn important reaction type is the electron-transfer reaction, also known as the oxidation-reduction, or redox, reaction. In such a reaction one or more electrons appear to be transferred from one atom to another. Oxidation is a word originally meant combination with oxygen gas, but so many other reactions were seen to resemble reactions with oxygen that the term was eventually broadened to refer to any reaction in which a substance or species loses electrons. Reduction is a gain electrons. The term seems to have its origins in metallurgical terminology: the reduction of an ore to its metal. Reduction is just the opposite of oxidation. An oxidation cannot take place without its having a reduction coupled with it; that is, electrons cannot be lost unless something else gains them.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
Предлагаемые вам задания, как это и было раньше, представляют собой короткие научно-исследовательские работы. Для опытов отобраны реакции, имеющие важное значение не только в химии, но и в экологии. Совсем необязательно выполнить все опыты – выберите те, которые вас заинтересуют. Работать желательно малыми группами (по 2–3 человека). Это уменьшает время эксперимента, позволяет избежать ошибок и, самое главное, позволяет вам участвовать в научном общении, что развивает научную речь.
1. Окислительно-восстановительные свойства пероксида водорода.
Пероксид водорода Н2О2 – важнейший окислитель, который используется в быту, в технологии, при очистке воды от органических загрязнений. Пероксид водорода – экологически чистый окислитель, т.к. продукты его разложения – кислород и вода – не загрязняют окружающую среду. Известна роль пероксида водорода и пероксидных органических соединений в процессах биологического окисления-восстановления.
3–6%-е растворы пероксида водорода для бытовых и учебных целей готовят обычно из 30%-го раствора разбавлением водой. Пероксид водорода при хранении разлагается с выделением кислорода (нельзя хранить в плотно закрытых сосудах!). Чем меньше концентрация пероксида водорода, тем он устойчивее. Для замедления разложения пользуются добавками фосфорной, салициловой кислот и других веществ. Особенно сильно действуют на пероксид водорода соли железа, меди, марганца и фермент каталаза.
3%-й раствор пероксида водорода в медицине используют для промывания рта и полоскания горла при стоматите и ангине.
30%-й раствор пероксида водорода называют пергидролем. Пергидроль не взрывоопасен. Попадая на кожу, пергидроль вызывает ожоги, жжение, зуд и образование пузырей, кожа при этом белеет. Обожженное место следует быстро промыть водой. Пергидроль в медицине используют для лечения гнойных ран и для обработки десен при стоматите. В косметологии его используют для удаления пигментных пятен на коже лица. Пятна на одежде от пероксида водорода удалить невозможно. Пероксид водорода в текстильной отрасли промышленности используют для отбеливания шерсти и шелка, а также мехов.
Производство концентрированных (90–98%-х) растворов пероксида водорода постоянно растет. Хранят такие растворы в алюминиевых сосудах с добавкой пирофосфата натрия Na4P2O7. Концентрированные растворы могут разлагаться со взрывом. Концентрированный раствор пероксида водорода на оксидном катализаторе при 700 °С распадается на пары воды и кислород, который служит окислителем для топлива в реактивных двигателях.
Пероксид водорода может проявлять как окислительные, так и восстановительные свойства.
Роль окислителя для пероксида водорода более характерна:
например, в реакции:
Пероксид водорода как восстановитель:
1) в кислотной среде:
2) в осно’вной (щелочной) среде:
Примеры реакций:
1) в кислотной среде:
2) в осно’вной среде:
Окислительные свойства пероксида водорода более сильно проявляются в кислотной среде, а восстановительные – в щелочной.
1а. Разложение пероксида водорода.
Налейте в пробирку 2–3 мл раствора пероксида водорода и нагрейте раствор на водяной бане. Должно начаться выделение газа. (Какого?) Докажите экспериментально, что это именно тот газ, который вы ожидали получить.
В другую пробирку с раствором пероксида водорода бросьте крупинку диоксида марганца. Докажите, что выделяется тот же газ.
Напишите уравнение разложения пероксида водорода и отдельно уравнения приема и отдачи электронов. К какому типу относится эта окислительно-восстановительная реакция?
Рассчитайте ЭДС реакции, если:
Какая из этих двух реакций обладает большей способностью отдавать электроны и ее следует переписать в противоположном направлении? Из значения ЭДС реакции рассчитайте 
Сравните результаты с
G и константой равновесия, полученными из термодинамических данных:
 Нобр, кДж/моль Нобр, кДж/моль | S, Дж/(К•моль) | |
| Н2О2 (ж.) | –187,8 | 109,5 |
| Н2О (ж.) | –285,8 | 70,1 |
| О2 (г.) | 0 | 205,0 |
Результаты ваших расчетов совпали? Если имеется некоторое расхождение в результатах, попытайтесь найти причины.
1б. Обнаружение пероксида водорода.
К разбавленному и подкисленному серной кислотой раствору (2–3 мл) йодида калия добавьте несколько капель раствора пероксида водорода. Раствор окрасится в желто-бурый цвет. При добавлении в него нескольких капель раствора крахмала цвет смеси мгновенно становится синим. Напишите уравнение реакции (образующиеся вещества вы знаете!).
Рассчитайте ЭДС реакции, чтобы убедиться, что реакция возможна (выберите нужную вам реакцию):
1в. Черный сульфид свинца и пероксид водорода.
Старые мастера писали свои картины красками, приготовленными на основе свинцовых белил, в состав которых входил белый основный карбонат 2PbCO3•Pb(OH)2. С течением времени свинцовые белила чернеют, а краски на их основе изменяют свою окраску из-за действия сероводорода, при этом образуется черный сульфид свинца PbS. Если картину осторожно протереть разбавленным раствором пероксида водорода, сульфид свинца переходит в белый сульфат свинца PbSO4 и картине почти полностью возвращается ее первоначальный вид.
В пробирку налейте 1–2 мл 0,1М раствора нитрата свинца Pb(NO3)2 или ацетата свинца Pb(СН3СОО)2 (продается в аптеке как свинцовая примочка). Прилейте немного раствора сероводорода или сульфида натрия. Слейте раствор с образовавшегося черного осадка и подействуйте на него раствором пероксида водорода. Напишите уравнения реакций.
Все соединения свинца ядовиты!
1г. Приготовление раствора пероксида водорода из гидроперита.
Если вам не удалось достать раствор пероксида водорода, то для лабораторных работ можно пользоваться гидроперитом, таблетки которого можно купить в аптеке.
Гидроперит представляет собой комплексное соединение пероксида водорода с карбамидом (мочевиной) NH2CONH2•H2O2. При растворении в воде получается раствор пероксида водорода и карбамида NH2CONH2. Раствор гидроперита используют вместо раствора пероксида водорода как антисептическое средство и при покраске волос. Для полоскания рта и горла растворяют 1 таблетку в стакане воды (0,25%-й раствор пероксида водорода). Одна таблетка гидроперита весит 1,5 г и соответствует 15 мл
(1 столовой ложке) 3%-го раствора пероксида водорода.
http://znaesh-kak.com/x/h/%D1%80%D0%B0%D0%B7%D0%BB%D0%BE%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-%D0%BF%D0%B5%D1%80%D0%BE%D0%BA%D1%81%D0%B8%D0%B4%D0%B0-%D0%B2%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4%D0%B0
http://him.1sept.ru/article.php?ID=200402405