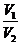Тема № 1 Растворы сильных электролитов. Расчет Рн растворов сильных кислот и оснований
РАСТВОРЫ СИЛЬНЫХ ЭЛЕКТРОЛИТОВ. РАСЧЕТ рн растворов
сильных КИСЛОТ И ОСНОВАНИЙ
1. Общая, равновесная и активная концентрации ионов в растворе
Сильные электролиты (соли, кислоты и основания) в водных растворах полностью диссоциируют на ионы.
Общая (аналитическая) концентрация ионов сильного электролита в растворе определяется составом данного электролита и его молярной концентрацией.
Для сильного электролита состава KtmAnn, диссоциирующего по уравнению
KtmAnn → m Ktn+ + n Anm — ,
общие или аналитические молярные (моль/л) концентрации ионов рассчитываются по формулам:
C(Ktn+) = m C(KtmAnn)
C(Anm-) = n C(KtmAnn). (1)
В отсутствие конкурирующих реакций по аниону и катиону равновесные молярные концентрации ионов равны их общим концентрациям, т. е.
[Ktn+] = C(Ktn+) = mC(KtmAnn)
[Anm-] = C(Anm-) = nC(KtmAnn)
Общая концентрация иона Х в растворе, в условиях протекания конкурирующих по данному иону реакций, равна сумме равновесных концентраций всех частиц, образовавшихся из иона Х.
Например, в водном растворе сульфата железа(III)
С(Fe3+) = [Fe3+] + [FeOH2+] + [Fe(OH)2+] +…+ [Feх(OH)y3x-y].
Активная концентрация или активность ионов в растворе – это величина, при подстановке которой вместо концентрации в уравнения, описывающие коллигативные свойства идеальных растворов, получают соответствующие опыту значения рассчитываемых величин для реальных растворов.
Активность иона – это эффективная его концентрация, соответственно которой ион действует в химической реакции. Активность и равновесная концентрация иона Х связаны соотношением:
где a(Х) – активность иона Х, моль/л;
[X] – молярная концентрация иона Х в растворе, моль/л,
f(Х) – молярный коэффициент активности иона Х в растворе.
Коэффициент активности иона характеризует степень отклонения свойств реальных растворов от идеальных. Для идеальных растворов, в которых отсутствует электростатическое взаимодействие частиц, коэффициенты активности ионов равны единице. Для реальных растворов электролитов, коэффициенты активности ионов, как правило, меньше единицы, хотя при больших концентрациях некоторых электролитов могут быть и больше единицы. Для бесконечно (очень) разбавленных растворов коэффициенты активности ионов стремятся к единице.
Активности чистых жидкостей и твердых веществ в устойчивом в стандартных условиях состоянии принято считать равными единице.
Ионная сила раствора и коэффициенты активностей ионов
Ионная сила раствора (IC) характеризует меру электростатического взаимодействия всех ионов, присутствующих в растворе. Она равна полусумме произведений молярных концентраций ионов на квадрат их заряда:
IC = 
где IC – ионная сила раствора, моль/л;
Ci – молярная концентрация i-го иона, моль/л;
Zi – заряд i-го иона.
Так как заряд иона (Zi) – безразмерная величина, то ионная сила раствора имеет размерность концентрации, однако, она обычно не указывается.
Как видно из приведенной ниже таблицы, ионная сила раствора сильного электролита зависит от его типа (количества образующихся при диссоциации ионов и их заряда) и кратна его молярной концентрации С.
IC = ½(2C·12 + C·22) = 3C
IC = ½(C·22 + C·22) = 4C
Kt 3+An3-, Kt 3+An3-
IC = ½(C·32 + 3C·12) = 6C
При вычислении ионной силы раствора, содержащего одновременно неэлектролиты, слабые и сильные электролиты, учитываются только сильные электролиты. Если в растворе присутствует несколько сильных электролитов, которые не взаимодействуют между собой, то ионная сила такого раствора равна сумме ионных сил, создаваемых каждым из них. Например, ионная сила раствора, содержащего HCl и AlCl3, равна:
IC(рра) = IC(HCl) + IC(AlCl3) = C(HCl) + 6C(AlCl3).
Коэффициент активности индивидуального иона в общем случае зависит от его природы и величины заряда, природы растворителя и ионной силы раствора.
В разбавленных растворах с IC 1,00 коэффициенты активности ионов считаются равными 1,00.
Расчет pH растворов сильных кислот
Сильные кислоты НАn (HCl, HBr, HI, HNO3, HClO4 и т. д.) в водных растворах полностью диссоциируют на ионы:
НАn + Н2О → Н3О+ + Аn–, (7)
Зная молярную концентрацию сильной кислоты НАn в растворе и уравнение её диссоциации (7), легко рассчитать равновесную концентрацию ионов оксония Н3О+ в растворе и ионную силу раствора. Коэффициент активности ионов Н3О+ можно определить, пользуясь данными табл.1 Приложения. Зная равновесную концентрацию ионов оксония и их коэффициент активности, по формуле (2) рассчитывается активность ионов Н3О+ и затем значение pH раствора.
Для кислоты НАn, диссоциирующей по уравнению (7), имеем:
Если в водном растворе сильной кислоты нет других источников ионов Н3О+ кроме кислоты НАn или ими можно пренебречь (ионизация воды, ионизация слабой кислоты, гидролиз соли), а С(HAn) ≥ 10-6 моль/л, то рН такого раствора вычисляется по формуле:
рH = – lg a(H3O+) = – lg [C(HAn)∙f(H3O+)]. (9)
Расчет pH растворов сильных оснований
Сильные основания KtOH (гидроксиды щелочных и щелочноземельных металлов) в водных растворах полностью диссоциируют на ионы
Активность ионов OH– в водном растворе сильного основания KtOH с концентрацией C(KtOH) ≥ 10-6 моль/л вычисляется по формуле:
Значение рОН и затем рН такого раствора вычисляют по следующим формулам:
рН = pKw – рОH == 14,00 – рОH. (13)
Расчет рН растворов, содержащих несколько сильных кислот (сильных оснований), или смесей, не взаимодействующих между собой сильных кислот (оснований) и солей, а также смесей сильных кислот и сильных оснований будет рассмотрен ниже на примерах решения конкретных задач.
5. Примеры решения типовых задач
Пример 1. Рассчитайте рН 3,070% раствора азотной кислоты, плотность которого равна 1,015 г/см3.
Дано: 
d(рра) = 1,015 г/см3
1. Записываем уравнение диссоциации азотной кислоты в водном растворе: НNO3 + Н2О → Н3О+ + NO3–
2. Вычисляем молярную концентрацию азотной кислоты в растворе и равновесную концентрацию ионов оксония в нем:
C(HNO3) = 

[H3O+] = C(HNO3) = 0,4945 моль/л
3. Определяем ионную силу раствора:
IC(рра) = IC(HNO3) = С(HNO3) = 0,4945
4. Вычисляем коэффициент активности ионов оксония, используя метод кусочно-линейной интерполяции и данные табл.2 Приложения. Для этого в табл. 2 выбираем интервал значений ионной силы (ближайшие меньшее и большее значения), в который попадает значение IC = 0,4945. Выписываем соответствующие табличные значения IC и коэффициента активности для однозарядных ионов (Z = ±1) так, как это показано ниже. Вычисляем разности табличных значений ионной силы (ΔIC), коэффициента активности (Δf), а также разность между вычисленным нами IC = 0,4945 и верхним табличным значением IC = 0,400 (Δ). Из полученных значений ΔIC, Δf и Δ, взятых по абсолютной величине, составляем пропорцию для вычисления X, которое является разностью между искомым значением f(H3O+) и верхним табличным значением f(H3O+) = 0,820.

0,4945 → ← f(H3O+) = 0,820 + Х
ΔIC = 0,100 ––––––– 0,020 = Δf
Х = 
5. Рассчитываем активность ионов оксония:
a(H3O+) = [H3O+]·f(H3O+) = 0,4945·0,839 = 0,415 моль/л
6. Вычисляем рН раствора:
рН = – lg a(H3O+) = – lg 0,415 = 0,38
Пример 2. Рассчитайте рН 0,602% раствора гидроксида натрия, плотность которого равна 1,005 г/см3.
Дано: 
d(рра) = 1,005 г/см3
1. Записываем уравнение диссоциации гидроксида натрия в водном растворе: NaOH → Na+ + OH–
2. Вычисляем молярную концентрацию гидроксида натрия в растворе и равновесную концентрацию ионов OH– в нем:
C(NaOH) = 

[OH–] = C(NaOH) = 0,151 моль/л
3. Определяем ионную силу раствора:
IC(рра) = IC(NaOH) = С(NaOH) = 0,151
4. Вычисляем коэффициент активности ионов OH–, используя метод кусочно-линейной интерполяции и данные табл. 2 Приложения:
0,151 → ← f(OH–) = 0,810 – Х
Х = 
5. Рассчитываем активность ионов OH–:
a(OH–) = [OH–]·f(OH–) = 0,151·0,805 = 0,122 моль/л
6. Вычисляем pOH и рН раствора:
рOН = – lg a(OH–) = – lg 0,122 = 0,91
pH = 14,00 – pOH = 14,00 – 0,91 = 13,09
Пример 3. Рассчитайте рН раствора, полученного смешиванием равных объемов 0,0500 моль/л водного раствора серной кислоты и 0,0200 моль/л водного раствора соляной кислоты. Коэффициенты активности однозарядных ионов примите равными 0,855.
Дано: V(H2SO4) = V(HCl); f(H3O+) = 0,820
C(H2SO4) = 0,0500 моль/л; C(HCl) = 0,0200 моль/л
1. Записываем уравнения диссоциации H2SO4 и HCl в водном растворе:
H2SO4 + H2O → H3O+ + HSO4–
HCl + H2O → H3O+ + Cl–
2. Вычисляем молярные концентрации серной и соляной кислот в смеси и равновесную концентрацию ионов оксония в полученном растворе.
Так как при смешивании равных объемов двух веществ концентрации каждого компонента уменьшается в 2 раза, то:
C*(H2SO4) = ½ C(H2SO4) = ½ 0,0500= 0,0250 моль/л
С*(HCl) = ½ С(HCl) = ½ 0,0200 = 0,0100 моль/л
[H3O+] = C*(H2SO4) + C*(HCl) = 0,0250 + 0,0100 = 0,0350 моль/л
3. Так как в условии задачи дано значение f(H3O+) = 0,855, то нет необходимости вычислять ионную силу раствора.
4. Рассчитываем активность ионов оксония:
a(H3O+) = [H3O+]·f(H3O+) = 0,0350∙0,855 = 0,0299 моль/л
5. Вычисляем рН раствора:
рH = – lg a(H3O+) = – lg 0,0299 = 1,52
Пример 4. Рассчитайте рН раствора, полученного смешиванием 100 мл 0,0200 моль/л водного раствора гидроксида бария и 300 мл 0,0200 моль/л водного раствора нитрата бария.
Дано: V(Ba(OH)2) = 100 мл; V(Ba(NO3)2) = 300 мл
C(Ba(OH)2) = C(Ba(NO3)2) = 0,0200 моль/л
1. Записываем уравнения диссоциации Ba(OH)2 и Ba(NO3)2:
Ba(OH)2 → BaOH+ + OH–
Ba(NO3)2 → Ba2+ + 2 NO3–
2. Вычисляем молярные концентрации гидроксида бария и нитрата бария в смеси и равновесную концентрацию ионов OH–:
C*(Ba(OH)2) = 
С*(Ba(NO3)2) = 
[OH–] = C*(Ba(OH)2) = 0,00500 моль/л
3. Определяем ионную силу полученного раствора:
IC(рра) = IC(Ba(OH)2) + IC(Ba(NO3)2) = C*(Ba(OH)2) + 3C*(Ba(NO3)2) = 0,00500 + 3·0,0150 = 0,0500
4. Находим коэффициент активности ионов OH–.
Из табл. 2 Приложения следует, что f(OH–) = 0,840 при IC =0,0500.
5. Вычисляем активность ионов OH– в растворе:
a(OH–) = [OH–]·f(OH–) = 0,00500·0,840 = 0,00420 моль/л
6. Вычисляем pOH и рН раствора:
рOН = – lg a(OH–) = – lg 0,00420= 2,38
pH = 14,00 – pOH = 14,00 – 2,38 = 11,62
Пример 5. Рассчитайте рН раствора, полученного смешиванием равных объемов водных растворов гидроксида натрия и азотной кислоты с концентрациями 0,0300 моль/л и 0,0700 моль/л, соответственно.
C(NaOH) = 0,0300 моль/л; C(HNO3) =0,0700 моль/л
Решение: Так как при смешивании растворов гидроксида натрия и азотной кислоты происходит реакция нейтрализации, то рН полученного раствора будет определяться тем электролитом, который взят в избытке.
1. Определяем молярные концентрации NaOH и HNO3 в смеси:
C*(NaOH) = ½ C(NaOH) = ½ 0,0300 = 0,0150 моль/л
С*(HNO3) = ½ C(HNO3) = ½ 0,0700 = 0,0350 моль/л
2. По уравнению реакции нейтрализации определяем, какое вещество взято в избытке, и рассчитаем концентрации сильных электролитов, присутствующих в растворе по окончании реакции:
NaOH + HNO3 → NaNO3 + H2O
до реакции: 0,0150 0,0350 0
реагируют: 0,0150 0,0150
после реакции: 0 0,0200 0,0150
Таким образом, раствор после завершения реакции содержит непрореагировавшую (избыток) HNO3 и продукт реакции NaNO3:
С(NaNO3) = C*(NaOH) = 0,0150 моль/л
С(HNO3)изб = C*(HNO3) – C*(NaOH) = 0,0350 – 0,0150 = 0,0200 моль/л.
[H3O+] = C(HNO3)изб = 0,0200 моль/л
3. Определим ионную силу полученного раствора:
IC(рра) = IC(NaNO3) + IC(HNO3) = C*(NaNO3) + C(HNO3)изб = 0,0150 + 0,0200 = 0,0350
4. Вычисляем коэффициент активности ионов оксония, используя метод кусочно-линейной интерполяции и данные табл. 2 Приложения:
0,0350 → ← f(H3O+) = 0,870 – Х
Х = 
5. Рассчитываем активность ионов оксония:
a(H3O+) = [H3O+]·f(H3O+) = 0,0200·0,855 = 0,0171 моль/л
6. Вычисляем рН раствора:
рН = – lg a(H3O+) = – lg 0,0171 = 1,77
6. Задачи для самостоятельного решения
1. Рассчитайте рН 2,364% раствора хлороводородной кислоты, плотность которого равна 1,010 г/см3.
2. Рассчитайте рН 6,237% раствора серной кислоты, плотность которого равна 1,040 г/см3. Ответ: 0,23.
3. Рассчитайте рН 0,425% раствора гидроксида натрия, плотность которого равна 1,003 г/см3. Ответ: 12,94.
4. Рассчитайте рН 0,498% раствора гидроксида бария, плотность которого равна 1,005 г/см3. Ответ: 12,40.
5. Рассчитайте рН раствора, полученного смешивание 100 мл 0,300 моль/л раствора хлороводородной кислоты и 300 мл 0,200 моль/л раствора бромоводородной кислоты. Коэффициенты активности однозарядных ионов примите равными 0,802. Ответ: 0,74.
6. Рассчитайте рН раствора, полученного смешивание равных объемов 0,100 моль/л раствора гидроксида натрия и 0,200 моль/л раствора гидроксида калия. Коэффициенты активности однозарядных ионов примите равными 0,805. Ответ: 13,08.
7. Рассчитайте рН раствора, полученного смешиванием равных объемов 0,0500 моль/л раствора гидроксида калия и 0,0500 моль/л раствора сульфата натрия. Ответ: 12,31.
8. Рассчитайте рН раствора, полученного смешиванием 200 мл 0,0350 моль/л раствора азотной кислоты и 300 мл 0,0200 моль/л раствора нитрата бария. Ответ: 1,93.
9. Рассчитайте рН раствора, полученного смешиванием равных объемов азотной кислоты и гидроксида натрия с концентрациями 0,0800 моль/л и 0,0300 моль/л. Ответ: 1,67.
10. Рассчитайте рН раствора, полученного смешиванием равных объемов раствора серной кислоты с C(H2SO4) = 0,0200 моль/л и раствора гидроксида натрия с C(NaOH) = 0,0600 моль/л. Ответ: 11,93.
Водородный показатель кислотности (рН)
Водородный показатель, pH (лат. pondus Hydrogenii — «вес водорода», произносится «пэ аш») — мера активности (в сильно разбавленных растворах эквивалентна концентрации) ионов водорода в растворе, которая количественно выражает его кислотность. Равен по модулю и противоположен по знаку десятичному логарифму активности водородных ионов, которая выражена в молях на один литр:

История водородного показателя pH .
Понятие водородного показателя введено датским химиком Сёренсеном в 1909 году. Показатель называется pH (по первым буквам латинских слов potentia hydrogeni — сила водорода, либо pondus hydrogeni — вес водорода). В химии сочетанием pX обычно обозначают величину, которая равна lg X, а буквой H в этом случае обозначают концентрацию ионов водорода (H + ), либо, вернее, термодинамическую активность гидроксоний-ионов.
Уравнения, связывающие pH и pOH .
Вывод значения pH .
В чистой воде при 25 °C концентрации ионов водорода ([H + ]) и гидроксид-ионов ([OH − ]) оказываются одинаковыми и равняются 10 −7 моль/л, это четко следует из определения ионного произведения воды, равное [H + ] · [OH − ] и равно 10 −14 моль²/л² (при 25 °C).
Если концентрации двух видов ионов в растворе окажутся одинаковыми, в таком случае говорится, что у раствора нейтральная реакция. При добавлении кислоты к воде, концентрация ионов водорода возрастает, а концентрация гидроксид-ионов понижается, при добавлении основания — напротив, увеличивается содержание гидроксид-ионов, а концентрация ионов водорода уменьшается. Когда [H + ] > [OH − ] говорится, что раствор оказывается кислым, а при [OH − ] > [H + ] — щелочным.
Чтоб было удобнее представлять, для избавления от отрицательного показателя степени, вместо концентраций ионов водорода используют их десятичный логарифм, который берется с противоположным знаком, являющийся водородным показателем — pH.

Показатель основности раствора pOH .
Немного меньшую популяризацию имеет обратная pH величина — показатель основности раствора, pOH, которая равняется десятичному логарифму (отрицательному) концентрации в растворе ионов OH − :
как во всяком водном растворе при 25 °C 

Значения pH в растворах различной кислотности.
- Вразрез с распространённым мнением, pH может изменяться кроме интервала 0 — 14, также может и выходить за эти пределы. Например, при концентрации ионов водорода [H + ] = 10 −15 моль/л, pH = 15, при концентрации ионов гидроксида 10 моль /л pOH= −1.
Т.к. при 25 °C (стандартных условиях) [H + ] [OH − ] = 10 −14 , то ясно, что при такой температуре pH + pOH = 14.
Т.к. в кислых растворах [H + ] > 10 −7 , значит, у кислых растворов pH 7, pH нейтральных растворов равняется 7. При более высоких температурах константа электролитической диссоциации воды увеличивается, значит, увеличивается ионное произведение воды, тогда нейтральной будет pH = 7 (что соответствует одновременно возросшим концентрациям как H + , так и OH − ); с понижением температуры, наоборот, нейтральная pH увеличивается.
Методы определения значения pH .
Существует несколько методов определения значения pH растворов. Водородный показатель приблизительно оценивают при помощи индикаторов, точно измерять при помощи pH-метра либо определять аналитическим путём, проводя кислотно-основное титрование.
- Для грубой оценки концентрации водородных ионов часто используют кислотно-основные индикаторы — органические вещества-красители, цвет которых зависит от pH среды. Самые популярные индикаторы: лакмус, фенолфталеин, метиловый оранжевый (метилоранж) и др. Индикаторы могут быть в 2х по-разному окрашенных формах — или в кислотной, или в основной. Изменение цвета всех индикаторов происходит в своём интервале кислотности, зачастую составляющем 1–2 единицы.
- Для увеличения рабочего интервала измерения pH применяют универсальный индикатор, который является смесью из нескольких индикаторов. Универсальный индикатор последовательно изменяет цвет с красного через жёлтый, зелёный, синий до фиолетового при переходе из кислой области в щелочную. Определения pH индикаторным способом затруднено для мутных либо окрашенных растворов.
- Применение специального прибора — pH-метра — дает возможность измерять pH в более широком диапазоне и более точно (до 0,01 единицы pH), чем при помощи индикаторов. Ионометрический метод определения pH основывается на измерении милливольтметром-ионометром ЭДС гальванической цепи, которая включает стеклянный электрод, потенциал которого зависим от концентрации ионов H + в окружающем растворе. Способ обладает высокой точностью и удобством, особенно после калибровки индикаторного электрода в избранном диапазоне рН, что дает измерять pH непрозрачных и цветных растворов и поэтому часто применяется.
- Аналитический объёмный метод — кислотно-основное титрование — тоже даёт точные результаты определения кислотности растворов. Раствор известной концентрации (титрант) каплями добавляют к раствору, который исследуется. При их смешивании происходит химическая реакция. Точка эквивалентности — момент, когда титранта точно хватает, для полного завершения реакции, — фиксируется при помощи индикатора. После этого, если известна концентрация и объём добавленного раствора титранта, определяется кислотность раствора.
- Влияние температуры на значения pH:
0,001 моль/Л HCl при 20 °C имеет pH=3, при 30 °C pH=3,
0,001 моль/Л NaOH при 20 °C имеет pH=11,73, при 30 °C pH=10,83,
Влияние температуры на значения pH объясняют разчной диссоциацией ионов водорода (H + ) и не есть ошибкой эксперимента. Температурный эффект нельзя компенсировать за счет электроники pH-метра.
Роль pH в химии и биологии.
Кислотность среды имеет важное значение для большинства химических процессов, и возможность протекания либо результат той или иной реакции зачастую зависит от pH среды. Для поддержания определённого значения pH в реакционной системе при проведении лабораторных исследований либо на производстве применяют буферные растворы, позволяющие сохранять почти постоянное значение pH при разбавлении либо при добавлении в раствор маленьких количеств кислоты либо щёлочи.
Водородный показатель pH часто применяют для характеристики кислотно-основных свойств разных биологических сред.
Для биохимических реакций сильное значение имеет кислотность реакционной среды, протекающих в живых системах. Концентрация в растворе ионов водорода зачастую оказывает влияние на физико-химические свойства и биологическую активность белков и нуклеиновых кислот, поэтому для нормального функционирования организма поддержание кислотно-основного гомеостаза является задачей исключительной важности. Динамическое поддержание оптимального pH биологических жидкостей достигается под действием буферных систем организма.
В человеческом организме в разных органах водородный показатель оказывается разным.
Некоторые значения pH.
Расчет рН при разбавлении и смешивании растворов
Расчеты рН в растворах сильных электролитов
Для характеристики кислотности среды обычно используют величину отрицательного десятичного логарифма молярной концентрации ионов Н + , которую называют водородным показателем рН:
для нейтральной среды рН = 7,
для кислых растворов рН 7.
Аналогичным образом реакция среды может быть охарактеризована гидроксильным показателем рОН:
С(ОН — ) – молярная концентрация ионов ОН — .
рН и рОН связаны между собой следующим образом:
Пример1:Рассчитать рН в 0,05М растворе серной кислоты.
Для расчета рН необходимо узнать молярную концентрацию ионов (Н + ). В растворах сильных электролитов концентрацию ионов можно узнать, записав уравнение диссоциации.
Это уравнение показывает, что при диссоциации 1 моль H2SO4 образуется 2 моль ионов H + и 1 моль ионов SO4 2- . Таким образом, если известна молярная концентрация самой серной кислоты, то молярная концентрация ионов H + будет в 2 раза больше.
С (H + ) = 2∙ С(H2SO4) = 2 ∙ 0,05 моль/л = 0,1 моль/л
pH = – lg C(H + ) = – lg 0,1 = – lg 10 -1 = 1
Таблица десятичных логарифмов чисел от 0 до 10
| число | ||||||||
| lg | 0,3 | 0,5 | 0,6 | 0,7 | 0,8 | 0,85 | 0,9 | 0,95 |
Пример 2.Рассчитать рН в 0,37% растворе гидроксида кальция (ρ = 1 г/мл).
Записываем уравнение диссоциации электролита:
В случае оснований нужно вначале найти молярную концентрацию ионов OH — , затем рОН, а потом рН.
В условии дана процентная концентрация раствора (ω %), ее необходимо перевести в молярную.
В этом случае нужно взять произвольную массу раствора, для удобства расчетов ее принимают за 100 г. Тогда в этой массе раствора содержится 0,37 г гидроксида кальция, или по формуле:
ω =
m (Ca(OH)2) = 
Молярная концентрация это:
С=
n(Ca(OH)2) =
Vраствора =
С(Ca(OH)2) = 
С(ОН — ) = 2 ∙ С(Ca(OH)2) = 2 ∙ 0,05моль/л = 0,1 моль/л (См. уравнение диссоциации)
Находим рОН, а затем рН.
pOH = – lg C(OH – ) = – lg 0,1 = – lg 10 -1 = 1
рН + рОН = 14, тогда
pH = 14 – pOH = 14 – 1 = 13
Пример 3.Какова молярная концентрация раствора соляной кислоты, рН которого равен 2? Чему равна ω этого раствора, если плотность 1 г/см 3 ?
Записываем уравнение электролитической диссоциации HCl:
Зная рН раствора, можно найти молярную концентрацию ионов водорода по формуле:
С (Н + ) = 10 -2 = 0,01 моль/л,
Из уравнения диссоциации следует, что концентрация HCl будет равна концентрации ионов H + , т.е. С (HCl) 0,01 моль/л (М).
Рассчитаем процентную концентрацию этого раствора.
В этом случае нужно взять произвольный объем раствора. Для удобства расчетов принимают объем равным 1 литру (1000 мл), тогда n = 0,01 моль, что следует из формулы:
С=
Находим массу вещества и массу раствора:
m (в-ва) = n ∙ V = 0,01моль ∙ 36,5 г/моль=0,365 г
m (р-ра) = V∙ρ = 1000 мл∙1 г/мл=1000 г
ω = 
Расчет рН при разбавлении и смешивании растворов
Пример 4.10 мл0,01М раствора соляной кислоты разбавили водой до 500 мл. Рассчитайте рН полученного раствора.
Чтобы узнать рН, нужно рассчитать молярную концентрация полученного раствора, т.е. С2.
Следует учесть, что число моль соляной кислоты в процессе разбавления не меняется. Поэтому сколько моль HCl было до разбавления, т.е. в первом растворе, столько моль этой же кислоты окажется и во втором растворе:
C2 = 
C2 =
2-й вариант расчета C2:



значит в 50 раз уменьшилась концентрация полученного раствора по сравнению с исходной , т.е. С1.
C2 =
Записываем уравнение электролитической диссоциации HCl:
Из уравнения диссоциации следует, что С(H + ) = С (HCl) = 0,0002 моль/л.
pH = – lg C(H +) = – lg 0,0002 = – lg 2∙10 -4 = 4 – lg 2= 4 – 0,3 = 3,7
см. таблицу логарифмов
Для перевода концентраций можно использовать формулу:
C =
ω =
В этом случае нужно брать следующие единицы измерения используемых величин:
ω – в долях от единицы,
0,37% раствор гидроксида кальция (ρ = 1 г/мл).
C =
Пример 3.
С (HCl) 0,01 моль/л, ρ = 1 г/мл.
ω = 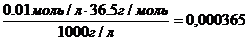
http://www.calc.ru/214.html
http://poisk-ru.ru/s31425t10.html