Растворы электролитов
Электролиты
При растворении в воде некоторые вещества имеют способность проводить электрический ток.
Те соединения, водные растворы которых способны проводить электрический ток называются электролитами.
Электролиты проводят ток за счет так называемой ионной проводимости, которой обладают многие соединения с ионным строением (соли, кислоты, основания).
Вещества, имеющие сильнополярные связи, но в растворе при этом подвергаются неполной ионизации (например, хлорид ртути II) являются слабыми электролитами.
Многие органические соединения (углеводы, спирты), растворенные воде, не распадаются на ионы, а сохраняют свое молекулярное строение. Такие вещества электрический ток не проводят и называются неэлектролитами.
Приведем некоторые закономерности, руководствуясь которыми можно определить относятся вещества к сильным или слабым электролитам:
- Кислоты. К сильным кислотам из наиболее распространенных относятся HCl, HBr, HI, HNO3, H2SO4, HClO4. Все они являются сильными электролитами. Почти все остальные кислоты, в том числе и органические являются слабыми электролитами.
- Основания. Наиболее распространенные сильные основания – гидроксиды щелочных и щелочноземельных металлов (исключая Be) относятся к сильным электролитам. Слабый электролит – NH3.
- Соли. Большинство распространенных солей – ионных соединений — сильные электролиты. Исключения составляют, в основном, соли тяжелых металлов.
Теория электролитической диссоциации
Электролиты, как сильные, так и слабые и даже очень сильно разбавленные не подчиняются закону Рауля и принципу Вант-Гоффа.
Имея способность к электропроводности, значения давления пара растворителя и температуры плавления растворов электролитов будут более низкими, а температуры кипения более высокими по сравнению с аналогичными значениями чистого растворителя. В 1887 г С. Аррениус, изучая эти отклонения, пришел к созданию теории электролитической диссоциации.
Электролитическая диссоциация предполагает, что молекулы электролита в растворе распадаются на положительно и отрицательно заряженные ионы, которые названы соответственно катионами и анионами.
Сущность теории электролитической диссоциации
- В растворах электролиты распадаются на ионы, т.е. диссоциируют. Чем более разбавлен раствор электролита, тем больше его степень диссоциации.
- Диссоциация — явление обратимое и равновесное.
- Молекулы растворителя бесконечно слабо взаимодействуют (т.е. растворы близки к идеальным).
Степень диссоциации электролита зависит от:
- природы самого электролита
- природы растворителя
- концентрации электролита
- температуры.
Степень диссоциации
Степень диссоциации α, показывает какое число молекул n распалось на ионы, по сравнению с общим числом растворенных молекул N:
- Степень диссоциации равна 0 α = 0 означает, что диссоциация отсутствует.
- При полной диссоциации электролита степень диссоциации равна 1 α = 1.
С точки зрения степени диссоциации, по силе электролиты делятся на:
- сильные (α > 0,7),
- средней силы ( 0,3 > α > 0,7),
- слабые (α — + bB +
K = [A — ] a ·[B + ] b /[Aa Bb]
Для слабых электролитов концентрация каждого иона равна произведению степени диссоциации α на общую концентрацию электролита С.
Таким образом, выражение для константы диссоциации можно преобразовать:
K = α 2 C/(1-α)
Для разбавленных растворов (1-α) =1, тогда
K = α 2 C
Отсюда нетрудно найти степень диссоциации
α = (K/C) 1/2
Ионно–молекулярные уравнения
Как составить полное и сокращенное ионные уравнения
Рассмотрим несколько примеров реакций, для которых составим молекулярное, полное и сокращенное ионное уравнения.
1) Пример нейтрализации сильной кислоты сильным основанием
1. Процесс представлен в виде молекулярного уравнения.
HCl + NaOH = NaCl + HOH
2. Представим процесс в виде полного ионного уравнения. Т.е. запишем в ионном виде все соединения — электролиты, которые в растворе полностью ионизированы.
H + + Cl — +Na + + OH — = Na + + Cl — + HOH
3. После «сокращения» одинаковых ионов в левой и правой частях уравнения получаем сокращенное ионное уравнение:
H + + OH — = HOH
Мы видим, что процесс нейтрализации сводится к соединению H + и OH — и образованию воды.
При составлении ионных уравнений следует помнить, что в ионном виде записываются только сильные электролиты. Слабые электролиты, твердые вещества и газы записываются в их молекулярном виде.
2) Пример реакции осаждения
Смешаем водные растворы AgNO3 и HI:
Молекулярное уравнение AgNO3 + HI →AgI↓ + HNO3 Полное ионное уравнение Ag + + NO3 — + H + + I — →AgI↓ + H + + NO3 — Сокращенное ионное уравнение Ag + + I — →AgI↓ Процесс осаждения сводится к взаимодействию только Ag + и I — и образованию нерастворимого в воде AgI.
Чтобы узнать способно ли интересующее нас вещество растворяться в воде, необходимо воспользоваться таблицей растворимости кислот, солей и оснований в воде. В приведенной таблице также указан цвет образуемого осадка, сила кислот и оснований и способность анионов к гидролизу.
Пример образования летучего соединения
Рассмотрим третий тип реакций, в результате которой образуется летучее соединение. Это реакции взаимодействия карбонатов, сульфитов или сульфидов с кислотами. Например,
Молекулярное уравнение Na2SO3 + 2HI → 2NaI + SO2↑ + H2O Полное ионное уравнение 2Na + + SO3 2- + 2H + + 2I — → 2Na + + 2I — + SO2↑ + H2O Сокращенное ионное уравнение SO3 2- + 2H + → SO2↑ + H2O Отсутствие взаимодействия между растворами веществ
При смешении некоторых растворов ионных соединений, взаимодействия между ними может и не происходить, например
Молекулярное уравнение CaCl2 + 2NaI = 2NaCl +CaI2 Полное ионное уравнение Ca 2+ + Cl — + 2Na + + I — = 2Na + + Cl — + Ca 2+ + 2I — Сокращенное ионное уравнение отсутствует Условия протекания реакции (химического превращения)
Итак, подводя итог, отметим, что химические превращения наблюдаются в случаях, если соблюдается одно из следующих условий:
- Образование неэлектролита. В качестве неэлектролита может выступать вода.
- Образование осадка.
- Выделение газа.
- Образование слабого электролита, например уксусной кислоты.
- Перенос одного или нескольких электронов. Это реализуется в окислительно – восстановительных реакциях.
- Образование или разрыв одной или нескольких ковалентных связей.
Реакции обмена в водных растворах электролитов. Ионные реакции и уравнения
Так как молекулы электролитов в растворах распадаются на ионы, то и реакции в растворах электролитов происходят между ионами.
Реакции, протекающие между ионами, называются ионными реакциями.
С участием ионов могут протекать как обменные, так и окислительно-восстановительные реакции. Рассмотрим реакции ионного обмена, например взаимодействие между растворами двух солей:
Это уравнение является молекулярным уравнением, так как формулы всех веществ записаны в виде молекул. Исходные вещества Na2SО4 и ВаCl2 являются сильными электролитами, т. е. в растворе находятся в виде ионов. Сульфат бария — нерастворимая соль, которая выпадает в осадок, следовательно, ионы Ва 2+ и SО4 2- уходят из раствора. Хлорид натрия NaCl — растворимая соль, сильный электролит, в растворе находится в виде ионов (Na + + Сl — ). Таким образом, с учетом диссоциации сильных электролитов уравнение реакции можно записать так:
Такое уравнение называется полным ионным уравнением.
Результат взаимодействия хлорида бария с сульфатом натрия
Ионы Na + и Cl — имеются и в левой, и в правой частях уравнения, т. е. эти ионы в реакции участия не принимают, их можно исключить из уравнения:
Полученное уравнение называется сокращенным ионным уравнением. Оно показывает, что в ходе данной реакции происходит связывание ионов SO4 2- , которые находились в растворе NaSО4, и ионов Ва 2+ , которые находились в растворе ВаCl2, и в результате образовалась нерастворимая соль BaSО4.
Сокращенное ионное уравнение (3) выражает сущность не только реакции (1). Напишем уравнения нескольких реакций:
Как видим, сущность реакций (4) и (5), как и реакции (1), заключается в связывании ионов SO4 2- и Ва 2+ с образованием нерастворимой соли BaSО4.
В ионных уравнениях формулы веществ записывают в виде ионов или в виде молекул.
В виде ионов записывают формулы:
В виде молекул записывают формулы:
— малорастворимых солей(↓) AgCl, BaSO4, СаСО3, FeS и др.;
Большая часть молекул слабых электролитов в растворе не диссоциирует на ионы.
В виде молекул также записывают:
В уравнениях реакций ставят знак ↓, если среди продуктов реакции есть осадок — нерастворимые или малорастворимые вещества. Знак ↑ показывает газообразные и летучие соединения.
Реакции обмена в водных растворах электролитов могут быть:
1) практически необратимыми, т. е. протекать до конца;
2) обратимыми, т. е. протекать одновременно в двух противоположных направлениях.
1) Реакции обмена между сильными электролитами в растворах протекают до конца, или практически необратимы, когда ионы соединяются друг с другом и образуют:
а) малорастворимые вещества;
б) малодиссоциирующие вещества — слабые электролиты;
в) газообразные или летучие вещества.
Рассмотрим эти случаи.
а) Реакции с образованием малорастворимых веществ, выпадающих в осадок (↓).
Составим молекулярное и ионное уравнения реакции между нитратом серебра (I) AgNO3 и хлоридом натрия NaCl:
Эта реакция обмена необратима, потому что один из продуктов уходит из сферы реакции в виде нерастворимого вещества.
б) Реакции, идущие с образованием малодиссоциирующих веществ (слабых электролитов).
Составим молекулярное и ионное уравнения реакции нейтрализации между растворами гидроксида натрия NaOH и серной кислоты H2SO4:
или, сокращая коэффициенты, получим: ОН — + Н + = Н2О.
В результате реакции нейтрализации ионы водорода Н + и гидроксид-ионы ОН — образуют малодиссоциирующие молекулы воды. Процесс нейтрализации идет до конца, т. е. эта реакция необратима.
в) Реакции, протекающие с образованием газообразных веществ.
Составим молекулярное и ионное уравнения реакции между растворами гидроксида кальция и хлорида аммония NH4Cl:
Эта реакция обмена необратима, потому что образуются газ аммиак NH3 и малодиссоциирующее вещество вода.
2) Если среди исходных веществ имеются слабые электролиты или малорастворимые вещества, то такие реакции являются обратимыми, т. е. до конца не протекают. Например:
Если исходными веществами реакций обмена являются сильные электролиты, которые при взаимодействии не образуют малорастворимых или малодиссоциирующих веществ, то такие реакции не протекают. При смешивании их растворов образуется смесь ионов, которые не соединяются друг с другом. Например:
Ионные реакции в растворах электролитов
Ионными реакциями (реакциями обмена) называют реакции в растворах электролитов, не сопровождающиеся изменением степеней окисления атомов элементов, входящих в состав реагирующих веществ.
Для выявления сущности процессов, происходящих при ионных реакциях, кроме молекулярных, составляют ионные уравнения реакций.
· При составлении ионных уравнений в виде ионов записывают только растворимые сильные электролиты. Все остальные вещества (неэлектролиты, слабые или малорастворимые электролиты) записывают в молекулярной форме.
Примеры реакций обмена:
· с образованием малорастворимых соединений:
· с образованием слабых электролитов:
· с образованием газообразных веществ:
Диссоциация воды. Водородный показатель
Вода является слабым электролитом. Уравнение диссоциации воды упрощенно записывают следующим образом: H2O Û H + + OH — . Константа диссоциации воды:
.
· Произведение
называют ионным произведением воды и обозначают
:
.
Ионное произведение воды при постоянной температуре постоянно не только для воды, но и для водных растворов. Зная концентрацию ионов H + , можно рассчитать концентрацию OH — , и наоборот. Понятия кислая, нейтральная и щелочная среда можно оценить количественно по концентрации ионов H + или OH — . Более удобно для характеристики среды пользоваться водородным показателем:
.
Среда рН [H + ], моль/л [OH — ], моль/л Нейтральная = 7 10 — 7 10 — 7 Кислая 10 — 7 — 7 Щелочная > 7 — 7 >10 — 7 Гидролиз солей
· Гидролизом солей называют процесс взаимодействия ионов соли с водой, приводящий к смещению ионного равновесия воды и, как правило, изменению рН среды.
Гидролиз солей происходит в тех случаях, когда ионы, образующиеся в результате диссоциации соли, способны образовать с ионами воды малодиссоциирующие частицы. Гидролиз чаще всего является обратимым процессом, так как продукты реакции взаимодействуют между собой с образованием исходных веществ.
Соли, образованные сильной кислотой и сильным основанием, например NaCl, KNO3, CaCl2 и др., гидролизу не подвергаются, их растворы нейтральны.
· Гидролизу подвергаются соли, образованные:
· слабыми основаниями и сильными кислотами (NH4Cl, AlCl3, ZnSO4 и др.);
· слабыми кислотами и слабыми основаниями (NH4CH3COO, NH4CN и др.).
· Гидролиз солей слабых кислот и сильных оснований.
Гидролиз NaNO2.
Диссоциация соли: NaNO2 = Na + + NO2 —
краткое ионное уравнение:
NO2 — + HOH Û HNO2 + OH — (среда щелочная, рН>7);
Гидролиз K2CO3 (гидролиз солей многоосновных кислот преимущественно происходит по первой ступени).
краткое ионное уравнение:
CO3 2 — + HOH Û HCO3 — + OH — (среда щелочная, рН>7);
По второй ступени гидролиз практически не идет.
· Гидролиз солей слабых оснований и сильных кислот.
Диссоциация соли: NH4Cl = NH4 + + Cl —
краткое ионное уравнение:
NH4 + + HOH Û NH4OH + H + (среда кислая, рН 3+ + 3Cl —
Al 3+ + HOH Û AlOH 2+ + H + (среда кислая, рН — и H + из воды, равновесие сильно смещается вправо, гидролиз усиливается. Значение рН раствора зависит от относительной силы кислоты и основания, образующих соль.
Константы диссоциации уксусной кислоты и гидроксида аммония равны:
и
, поэтому реакция раствора данной соли нейтральная.
Растворимые соли, образованные многоосновными слабыми кислотами и многокислотными слабыми основаниями гидролизованы в растворе практически полностью с образованием кислоты и основания:
Такие соли в водных растворах существовать не могут. В таблице растворимости им соответствует прочерк.
· Совместный гидролиз солей.
Если в растворе одновременно присутствуют две соли, одна из которых содержит катион слабого основания (Al 3+ , Fe 3+ , Cr 3+ , NH4 + ), а другая — анион слабой кислоты (СO3 2— , SO3 2— , S 2— , SiO3 2— ), то гидролиз необратим, идёт с образованием кислоты и основания. Пример реакции совместного гидролиза солей:
источники:http://al-himik.ru/reakcii-obmena-v-vodnyh-rastvorah-jelektrolitov-ionnye-reakcii-i-uravnenija/
http://lektsii.org/15-17779.html

 Результат взаимодействия хлорида бария с сульфатом натрия
Результат взаимодействия хлорида бария с сульфатом натрия






 .
. называют ионным произведением воды и обозначают
называют ионным произведением воды и обозначают  :
: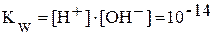 .
. .
. и
и  , поэтому реакция раствора данной соли нейтральная.
, поэтому реакция раствора данной соли нейтральная.