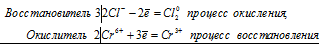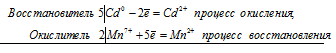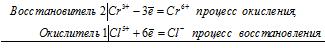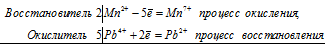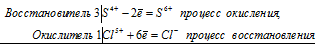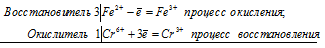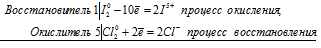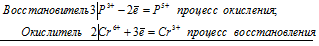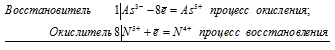Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e0cc9dd3fe23aa7 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Химия NeoChemistry — мы знаем о химии всё
 |  | ||||||||||||||||||||||||||||||||||||
| Задачи по химии (с решениями) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
|
| Химия общая | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
| Химия неорганическая | |||||||||
|---|---|---|---|---|---|---|---|---|---|
|
Реакции выражаются схемами
H2S + Cl2 + H2O → H2SO4 + HCl
K2Cr2O7 + H2S + H2SO4 → S + Cr2(SO4)3 + K2SO4+ H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается.
Решение.
1.Сначала в данной схеме уравнения определим степень окисления атомов в левой и правой части уравнения, затем проанализируем как изменилась степень окисления каждого атома, участвующего в окислительно-восстановительном процессе, составим электронные уравнения и методом баланса электронных уравнений расставим коэффициенты.
-2 0 +6 -1
H2S + Cl2 + H2O → H2SO4 + HCl
Степень окисления серы S в соединении H2S (-2)-низшая,
в соединении H2SO4(+6)-высшая. Сероводород является восстановителем, сам окисляется.
Степень окисления хлора в свободном хлоре –(0)- промежуточная, в хлористом водороде
(-1)-низшая. Хлор является окислителем, сам восстанавливается.
Напишем электронные уравнения:
Восстановитель S¯² -8e = S+6 процесс окисления /8 К=1
Окислитель 2Cl° + 2e = 2Cl¯¹ процесс восстановления /2 К=4
Общее число электронов, отданное восстановителем-8, их отдает одна моль сероводорода. Это же число электронов должен принять окислитель: 1 моль хлора принимает 2 электрона, по закону кратности 8 электронов примут 4 моль хлора. Ставим коэффициент 1 перед молекулой H2S и коэффициент 4 перед молекулой Cl2. Расставляем остальные коэффициенты в соответствии с этими. Уравнение принимает вид:
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
Итак, в представленной реакции:
— Cl2– окислитель, сам восстанавливается; 4 молекулы, содержащие 8 атомов хлора, принимают 8*1=8 электронов.
—H2S –восстановитель, сам окисляется, 1 молекула, содержащая 1 атом серы,
отдает 1*8=8 электронов.
2. Схема уравнения реакции:
K2Cr2O7 + H2S + H2SO4 → S + Cr2(SO4)3 + K2SO4+ H2O
Проставляем степени окисления
+6 -2 +6 0 +3 +6
K2Cr2O7 + H2S + H2SO4 → S + Cr2(SO4)3 + K2SO4+ H2O
Атом хрома меняет степень окисления с +6 на +3, т.е принимает 3 электрона и является окислителем.
Атом серы в молекуле серной кислоты не меняет степень окисления, значит в процессе окислительно-восстановительном не принимает участия. Атом серы, входящий в состав молекулы сероводорода меняет степень окисления с (-2) на (0), т.е. отдает электроны и является восстановителем. Электронные уравнения принимают вид:
Восстановитель S¯² -8e = S+6 процесс окисления /8
Окислитель Cr +6 + 3e = Cr +3 процесс восстановления /3
С учетом того, что в молекулу K2Cr2O7 входит 2 атома Cr, общее число электронов, принятое молекулой K2Cr2O7 равно 6, электронное уравнение принимает вид:
Восстановитель S¯² -8e = S+6 процесс окисления /8
Окислитель 2Cr +6 + 6e =2Cr +3 процесс восстановления /6
Наименьшее кратное для цифр 8 и 6 –это 24.
Коэффициент для атомов молекулы, содержащей S¯² равен 24/8 =3
Коэффициент для атомов молекулы, содержащей Cr +6 равен 24/6 =4
Проставляем эти коэффициенты и подбираем остальные.
Уравнение реакции принимает вид:
4K2Cr2O7 +3H2S + 16H2SO4 →3S + 4Cr2(SO4)3 + 4K2SO4+ 28H2O
Итак, в представленной реакции:
—K2Cr2O7 – окислитель, сам восстанавливается; 4 молекулы, содержащие8 атомов хрома, принимают 8*3=24 электрона.
—H2S – восстановитель, сам окисляется, 3 молекулы, содержащие 3 атома серы,
отдают 3*8=24 электрона.
Правильное составление электронных уравнений реакций
Решение задач на составлении электронных уравнений химических реакций
Задание 236.
Реакции выражаются схемами:
HCl + CrO3 ⇔ Cl2 + CrCl3 + H2O;
Cd + KMnO4 + H2SO4 ⇔ CdSO4 + MnSO4 + K2SO4 + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
а) HCl + CrO 3 ⇔ Cl2 + CrCl 3 + H 2 O
2Cr 6+ + 6Cl — = 2Cr 3+ + 3Cl2 0
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 3, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 6 на 2 получаем коэффициент 3 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: HCl – восстановитель, CrO3 – окислитель; HCl окисляется до Сl2, CrO3 – восстанавливается до CrCl3.
5Сd 0 + 2Mn 7+ = Cd 2+ + 2Mn 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов десять. Разделив это число на 5, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: Cd – восстановитель, KMnO 4 – окислитель; Cd окисляется до CdSO 4, KMnO 4 – восстанавливается до MnSO 4.
Задание 237.
Реакции выражаются схемами:
Cr2O3 + KClO3 + KOH ⇔ K2CrO4 + KCl + H2O;
MnSO4 + PbO2 + HNO3 ⇔ HMnO4 + Pb(NO3)2 + PbSO4 + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
2Cr 3+ + Cl 5+ = 2Cr 6+ + Cl —
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 6, получаем коэффициент 1 для окислителя и продукта его восстановления, а при делении 6 на 3 получаем коэффициент 2 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: Cr2O3 – восстановитель, KClO3 – окислитель; Cr2O3 окисляется до K2CrO4, KClO3 – восстанавливается до KCl.
5Pb 4+ + 2Mn 2+ = 5Pb 2+ + 2Mn 7+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов десять. Разделив это число на 2, получаем коэффициент 5 для окислителя и продукта его восстановления, а при делении 10 на 5 получаем коэффициент 2 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: PbO2 – восстановитель, MnSO4 – окислитель; PbO2 окисляется до Pb(NO3)2, MnSO4 – восстанавливается до HMnO4.
Задание 238.
Реакции выражаются схемами:
H2SO3 + HClO3 ⇔ H2SO4 + HCl;
FeSO4 + K2Cr2O7 + H2SO4 ⇔ Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
3S 4+ + Cl 5+ = 3S 6+ + Cl —
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 6, получаем коэффициент 1 для окислителя и продукта его восстановления, а при делении 6 на 2 получаем коэффициент 3 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: H2SO3 – восстановитель, HClO3 – окислитель; H2SO3 окисляется до H2SO4, HClO3 – восстанавливается до HCl.
3Fe 2+ + Cr 6+ = 3Fe 3+ + Cr 3+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов три. Разделив это число на 3, получаем коэффициент 1 для окислителя и продукта его восстановления, а при делении 3 на 1 получаем коэффициент 3 для восстановителя и продукта его окисления. Учитывая, что в схеме реакции указаны вещества, содержащие железо и хром с двумя атомами в молекулах Fe2(SO4)3 и Cr2(SO4)3], умножим коэффициенты при окислителе и восстановителе на 2, получим молекулярное уравнение реакции:
Задание 239.
Реакции выражаются схемами:
I2 + Cl2 + H2O ⇔ HClO3 + HCl;
K2Cr2O7 + H3PO3 + H2SO4 ⇔ Cr2(SO4)3 + H3PO4 + K2SO4 + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
I 2 0 + 5Cl2 0 ⇔ 2I — + 10Cl —
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов десять. Разделив это число на 2, получаем коэффициент 5 для окислителя и продукта его восстановления, а при делении 10 на 10 получаем коэффициент 1 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: I2 – восстановитель, Cl2 – окислитель; I2 окисляется до HIO3, Cl2 – восстанавливается до HCl.
3P 3+ + 2Cr 6+ = 3P 5+ + 2Cr 3+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 3, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 6 на 2 получаем коэффициент 3 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: H 3PO 3 – восстановитель, K 2Cr 2O 7 – окислитель; H 3PO 3 окисляется до H 3PO 4, K 2Cr 2O 7 – восстанавливается до Cr 2(SO 4) 3.
Задание 240.
Могут ли происходить окислительно-восстановительные реакции между веществами: а) РН3 и НВг; б) K2Cr2O7 и Н3PO3; в) HNO3 и Н2S? Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме:
АsH3 + НNO3 ⇔ Н3AsO4 + NO2 + Н2O
Решение:
а) Степень окисления в РH3 n(Р) = -3 (низшая), в HBr n(Br) = -1 (низшая). Так как и фосфор, и бром находятся в своей низшей степени окисления, то оба вещества проявляют только восстановительные свойства и взаимодействовать друг с другом не могут;
б) в K2Cr2O7 n(Сr) = +6 (высшая); в Н3PO3 n(Р) = +5 (высшая). Так как и хром, и фосфор находятся в своей высшей степени окисления, то оба вещества проявляют только окислительные свойства и взаимодействовать друг с другом не могут;
в) в HNO3 n(N) = +5 (высшая); в H2S n(S) = -2 (низшая). Следовательно, взаимодействие этих веществ возможно, причём HNO3 является окислителем, а H2S – восстановителем.
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
As 3- + 8N 5+ = As 5+ + 8N 4+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов восемь. Разделив это число на 1, получаем коэффициент 8 для окислителя и продукта его восстановления, а при делении 8 на 8 получаем коэффициент 1 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
http://neochemistry.ru/zadachki5/466.php
http://buzani.ru/zadachi/khimiya-shimanovich/937-sostavlenie-elektronnykh-uravnenij-reaktsij-zadaniya