Контрольное тестирование по химии
Контрольное тестирование по химии
Тестовые задания с выбором ответа и на соотнесение
1. Общая формула алканов: А. СnН2n. Б. СnН2n+2. В. СnН2n-2. Г. СnН2n-6.
2. Углеводород с формулой СН3 – СН – СН – СН3 называется и относится к классу:
А. 2,2-диметилбутан, алканов. Б. 2-метилбутен, алкенов. В. 2,3-диметилбутан, алканов.
Д. 2,3-диметилпентан, алканов.
3. Изомером вещества, формула которого CH2 = CH – CH2 – CН3, является:
А. 2-Метилбутен. Б. Бутен-2. В. Бутан. Г. Бутин-1.
4. Последующим гомологом пропина является: А. Гексан. Б. Пропан. В. Бутин. Г. Бутен.
5. Взаимодействие этена с водородом – это реакция:
А. Замещения. Б. Присоединения. Д. Элиминирования.
6. Реакции гидратации соответствует схема:
А. …+ … → С2Н5ОН. Б. … + … → С3Н8 . В. … → С2Н4 + Н2. Г. … → С2Н4 + Н2О.
7. Левой части уравнения С3Н4 + 4О2 → соответствует правая часть:
А. С3Н6 + Н2О. Б. С2Н4 + Н2О. В. 3СО2 + 4Н2О. Г. 3СО2 + 2Н2О.
8. В схеме превращений +Н2 +Н2О
А. С2Н4 и С2Н4Cl2. Б. С2Н6 и С2Н5Cl. В. С2Н4 и С2Н6. Г. С2Н4 и С2Н5ОН.
9. Обесцвечивание бромной воды, является качественной реакцией на вещество:
А. Бутан. Б. Этен (этилен). B. Пропан. Г. Циклобутан.
10. Установите соответствие.
1. СН3 – СН2 – СН2 – СН3 → СН3 – СН – СН3. 3. СН4 + Cl2 → СН3Cl + НСl.
2. CH2 = CH – CН3 + Н2 → СН3 – СН2 – СН3.
Тип реакции: А. Замещения. Б. Изомеризации. В. Присоединения. Г. Элиминирования.
11. Дополните фразу: «Химическая реакция, уравнение которой
n СН2 = СН2 → (– СН2– СН2–)n , является реакцией ____________________».
Задания со свободным ответом
12. Напишите уравнения химических реакций для следующих превращений:
СН4 → С2Н2→ С6Н6→ С6Н5 Cl, укажите условия и назовите продукты реакций.
13. Выведите молекулярную формулу углеводорода, массовая доля углерода в котором составляет 85,7%, массовая доля водорода – 14,3%. Относительная плотность этого вещества по водороду равна 28.
Контрольное тестирование по химии
Тестовые задания с выбором ответа и на соотнесение
Общая формула алкенов: А. СnН2n. Б. СnН2n+2. В. СnН2n-2. Г. СnН2n-6. Углеводород с формулой СН≡ С – СН – СН3 называется и относится к классу:
А. 3-метилбутан, алканов. Б. 3-метилбутен-1, алкенов. В. 3-метилбутин-1, алкинов. Д. 2-метилбутин-1, алканов.
Изомером вещества, формула которого СН3 – СН – СН2 – СН3, является:
А. 2-Метилбутен. Б. 2-Метилпентан. В. Пентан. Г. Бутан.
Последующим гомологом вещества 2-метилпропан является:
А. 2-метилбутан. Б. Пентан. В. 2-метилпентан. Г. Бутан.
Взаимодействие этана с хлором на свету – это реакция:
А. Замещения. Б. Присоединения. Д. Разложения.
Реакции гидрирования соответствует схема:
А. …+ Н2О → С2Н5ОН. Б. … + Н2 → С3Н6 . В. … → С2Н4 + Н2. Г. … → С2Н4 + Н2О.
Левой части уравнения С3Н7ОН → соответствует правая часть:
А. С3Н6 + Н2О. Б. С2Н4 + Н2О. В. 3СО2 + 2Н2О. Г. СО2 + 2Н2О.
А. С2Н4 и С2Н5ОН. Б. С2Н6 и С2Н5Cl. В. С2Н4 и С2Н6. Г. С2Н4 и С2Н5Cl.
9. Обесцвечивание бромной воды, является качественной реакцией на вещество:
А. Бутан. Б. Бензол. B. Ацетилен (этин). Г. Циклопентан.
1. С2Н4 + Н2 → С2Н6 3. С2Н6 + Cl2 → С2Н5 Cl + НCl.
2. nCH2 = CH2 → ( – СН2 – CH2 – ) n.
Тип реакции: А. Замещения. Б. Изомеризации. В. Присоединения. Г. Элиминирования.
Дополните фразу: «Химическая реакция, уравнение которой,
СН3 – СН2 – СН2 – СН3 → СН3 – СН – СН3 , является реакцией _______________».
Задания со свободным ответом
СаС2 → С2Н2→ С6Н6→ С6Н5 NO2, укажите условия и назовите продукты реакций.
Выведите молекулярную формулу углеводорода, массовая доля углерода в котором составляет 82,76%, массовая доля водорода – 17,24%. Относительная плотность этого вещества по воздуху равна 2.
Механизмы химических реакций в органической химии
Разделы: Химия
Цели урока: формирование знаний способах разрыва ковалентной связи в органических соединениях, типах реакционных частиц, механизмах реакций в органической химии; развитие умения применять ранее полученные знания, анализировать и делать выводы.
Оборудование: презентация, проектор, компьютер, раздаточный материал с самостоятельной работой.
Методы: беседа, индивидуальная работа, лекция.
1. Оргмомент
2. Актуализация знаний
– На прошлом уроке мы ознакомились с типами химических реакций в органической химии. Какие типы реакций вам известны? (Замещения, присоединения, элиминирования, изомеризации)
3. Чтобы выяснить, уровень усвоения материала проводится небольшая самостоятельная работа по вариантам (10 мин.)
1. Алкены не могут вступать в реакции:
А. Замещения.
Б. Горения.
В. Полимеризации.
Г. Присоединения.
2. Взаимодействие метана с хлором – это реакция:
А. Галогенирования.
Б. Гидрирования.
В. Гидратации.
Г. Дегидрирования.
3. Продуктом реакции гидрирования этена (этилена) является:
4. Реакция дегидратации характерна для вещества, формула которого:
5. Продуктом реакции пропена с бромоводородом является:
А. 1-Бромпропан.
Б. 2-Бромпропан.
В.1,2-Дибромпропан.
Г. 1,2,3-Трибромпропан.
6. Формула соединения, в котором атом водорода гидроксогруппы –ОН наиболее подвижен:
7. Реакции гидрирования соответствует схема:
8. Левой части уравнения С3Н7ОН ––> соответствует правая часть:
+2 H2 + Cl2
9. В схеме превращений C2H2 ––> X ––> Y формулы веществ Х и Y соответственно:
10. Пропан вступает в реакцию с веществом, формула которого:
11. Установите соответствие.
А. Замещения.
Б. Изомеризация.
В. Присоединения.
Г. Элиминирования.
1. Алкины не могут вступать в реакции:
А. Галогенирования.
Б. Гидрирования.
В. Гидрогалогенирования.
Г. Дегидратации.
2. Взаимодействие этена с водородом является реакцией:
А. Замещения.
Б. Изомеризации.
В. Присоединения.
Г. Элиминирования.
3. Продуктом реакции хлорирования пропена является:
А. 1,2-Дихлорпропан.
Б. 1,2-Дихлорпропен.
В. 2,2-Дихлорпропан.
Г. 2-Хлорпропан.
4. Реакция полимеризации характерна для вещества, формула которого:
5. Продуктом реакции бутена-1 с хлороводородом является:
А. 2,2-Дихлорбутан.
Б. 1-Хлорбутан.
В. 2-Хлорбутан.
Г. 2-Хлорбутен-1.
6. Формула соединения, в котором атом водорода гидроксогруппы –ОН наиболее подвижен:
7. Реакции гидратации соответствует схема:
8. Левой части уравнения С3Н4 + 5О2 ––> соответствует правая часть:
10. Бутан вступает в реакцию с веществом, формула которого:
11. Установите соответствие.
А. Замещения.
Б. Изомеризация.
В. Присоединения.
Г. Элиминирования.
4. Изучение нового материала
1. Обменный механизм образования ковалентной связи реализуется в том случае, если общая электронная пара образуется из неспаренных электронам, принадлежащих разным атомам. (Приложение 1, слайд 2)
Н• + •Н ––> Н : Н или Н–Н
2. Ковалентная связь может образоваться и по донорно-акцепторному механизму. Одна из орбиталей атома (или аниона), на которой находится неподеленная электронная пара, перекрывается со свободной орбиталью другого атома (или катиона), при этом образуется ковалентная связь: (Приложение 1, слайд 3)
Н + + :NH3 ––> NH4 +
акцептор донор
3. Разрыв химических связей может протекать по разным механизмам.
При разрыве связи к каждому атому отходит по одному электрону в результате образуются две незаряженные частицы – свободные радикалы. (Приложение 1, слайд 4)
R : X ––> R· + X·
Такой механизм разрыва связи называется гомолизом.
Реакции, протекающие под действием и при участии свободных радикалов, называются свободнорадикальными реакциями. (Приложение 1, слайд 5)
Реакции такого типа отличаются высокой скоростью и выделением большого количества теплоты.
Гетеролитический способ разрыва связи – разрыв связи приводит к образованию положительно и отрицательно заряженных частиц. (Приложение 1, слайд 6)
R : X ––> R + + X –
Виды частиц, полученные в результате гетеролиза. (Приложение 1, слайды 7, 8)
Частицы, с неподеленными электронными парами называют нуклеофилами: Cl – , OH – , CH3O – , CH3COO – .
Электрофилы – катионы и молекулы, имеющие незаполненную атомную орбиталь.
4. Основные механизмы протекания реакций: свободнорадикальные, электрофильные, нуклеофильные.
Реакции электрофильного замещения. (Приложение 1, слайд 10)
С2Н5СI + NaOH ––> C2H5OH + NaCI
водный раствор
Реакция нуклеофильного присоединения. (Приложение 1, слайд 12)
O OH
II I
CH3 – C + N = C — H ––> CH3 – C– CN
I I
H H
Реакция электрофильного присоединения. (Приложение 1, слайд 13)
CH3 – C + H = C–H2 + HBr ––> Br – + CH3 – C + H – CH3 ––> CH3 – CH – CH3
карбокатион |
Br
Реакции отщепления, которые идут под воздействием нуклеофильных частиц – оснований.
CH3 – CHBr– CH3 + NaOH ––> CH3 – CH = CH2 + NaBr + H2O
5. Закрепление нового материала: стр. 57 упр. 1,2
6. Подведение итогов
7. Домашнее задание: § 9, профильный уровень. (Приложение 1, слайд 14)
Алкины
Алкины — непредельные (ненасыщенные) углеводороды, имеющие в молекуле одну тройную связь С≡С. Каждая такая связь содержит одну сигма-связь (σ-связь) и две пи-связи (π-связи).
Алкины также называют ацетиленовыми углеводородами. Первый член гомологического ряда — этин — CH≡CH (ацетилен). Общая формула их гомологического ряда — CnH2n-2.
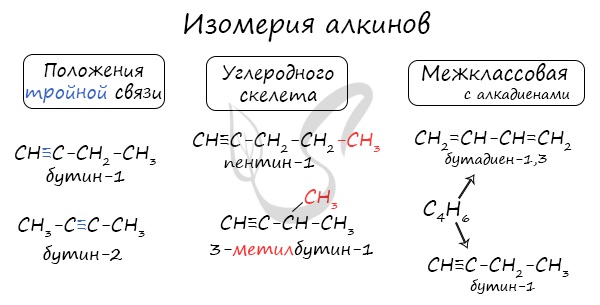
Номенклатура и изомерия алкинов
Названия алкинов формируются путем добавления суффикса «ин» к названию алкана с соответствующим числом: этин, пропин, бутин и т.д.
При составлении названия алкина важно учесть, что главная цепь атомов углерода должна обязательно содержать тройную связь. Нумерация атомов углерода в ней начинается с того края, к которому ближе тройная связь. В конце названия указывают атом углерода у которых начинается тройная связь.
Для алкинов характерна изомерия углеродного скелета, положения тройной связи, межклассовая изомерия с алкадиенами.
Пространственная геометрическая изомерия для них невозможна, ввиду того, что каждый атом углерода, прилежащий к тройной связи, соединен только с одним единственным заместителем.
Некоторые данные, касающиеся алкинов, надо выучить:
- В молекулах алкинов присутствуют тройные связи, длина которых составляет 0,121 нм
- Тип гибридизации атомов углерода — sp
- Валентный угол (между химическими связями) составляет 180°
Получение алкинов
Ацетилен получают несколькими способами:
- Пиролиз метана
При нагревании метана до 1200-1500 °C происходит димеризация молекул метана, в ходе чего отщепляется водород.
Осуществляется напрямую, из простых веществ. Протекает на вольтовой (электрической) дуге, в атмосфере водорода.
2C + H2 → (t, вольтова дуга) CH≡CH
Разложение карбида кальция
В результате разложения карбида кальция образуется ацетилен и гидроксид кальция II.
Получение гомологов ацетилена возможно в реакциях дегидрогалогенирования дигалогеналканов, в которых атомы галогена расположены у одного атома углерода или у двух соседних атомов.
Химические свойства алкинов
Алкины — ненасыщенные углеводороды, легко вступающие в реакции присоединения. Реакции замещения для них не характерны.
Водород присоединяется к атомам углерода, образующим тройную связь. Пи-связи (π-связи) рвутся, остается единичная сигма-связь (σ-связь).
CH≡C-CH3 + H2 → (t, Ni) CH2=CH-CH3 (в реакции участвует 1 моль водорода)
CH≡CH + 2H2 → (t, Ni) CH3-CH3 (в реакции участвует 2 моль водорода)
Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная вода обесцвечивается, что указывает на присоединение его по кратным связям к органическому веществу.
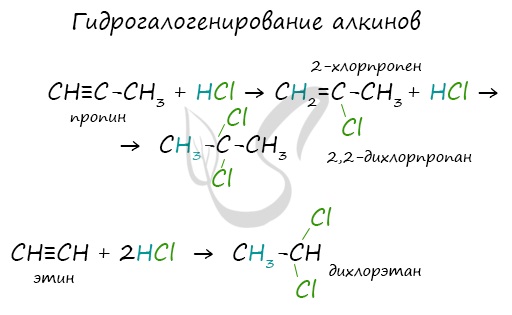
Алкины вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
Гидрогалогенирование протекает по правилу Марковникова, в соответствии с которым атом водорода присоединяется к наиболее гидрированному, а атом галогена — к наименее гидрированному атому углерода.
Реакцией Кучерова называют гидратацию ацетиленовых соединений с образованием карбонильных соединений. Открыта русским химиком М.Г. Кучеровым в 1881 году. Катализатор — соли ртути Hg 2+ .
Только в реакции с ацетиленом образуется уксусный альдегид. Во всех остальных реакциях (с гомологами ацетилена) образуются кетоны.
При горении алкины, как и все органические соединения, сгорают с образование углекислого газа и воды — полное окисление.
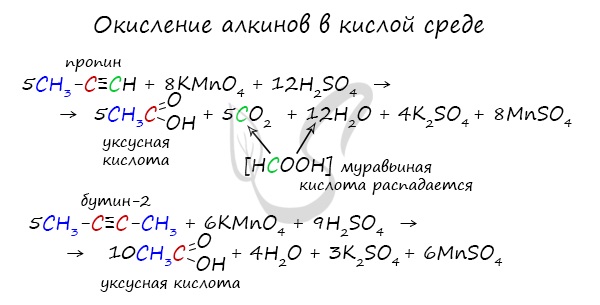
Сильные окислители (особенно в подкисленной среде) способны разрывать молекулы алкинов в самом слабом месте — в месте тройной связи.
Так, при окислении пропина, образуется уксусная кислота и муравьиная кислота, окисляющаяся до угольной кислоты, которая распадается на углекислый газ и воду.
Данная реакция протекает при пропускании ацетилена над активированным углем при t = 400°C. В результате образуется ароматический углеводород — бензол.
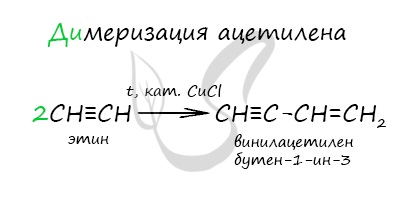
Димеризация ацетилена происходит при наличии катализатора — солей меди I. В результате реакции две молекулы ацетилена соединяются, образуя винилацетилен.
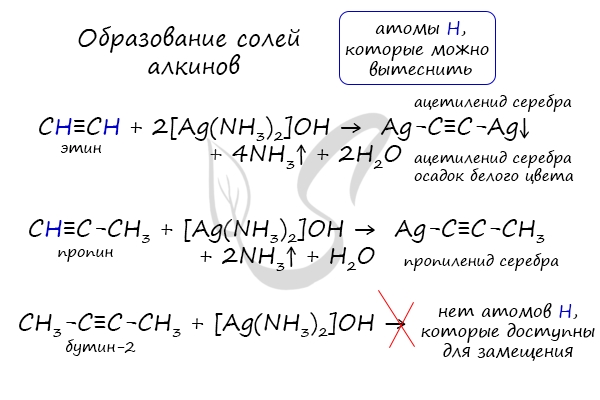
В случае если тройная связь прилежит к краевому атому углерода, то имеющийся у данного атома водород может быть замещен атомом металла. Если тройная связь спрятана внутри молекулы, то образование солей невозможно.
Реакция аммиачного раствора серебра и ацетилена — качественная реакция, в ходе которой выпадает осадок ацетиленида серебра.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
http://urok.1sept.ru/articles/642819
http://studarium.ru/article/185