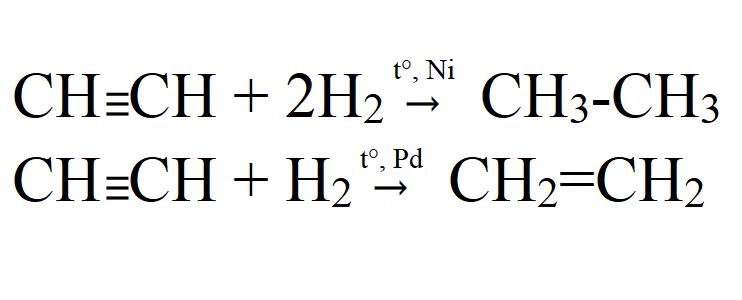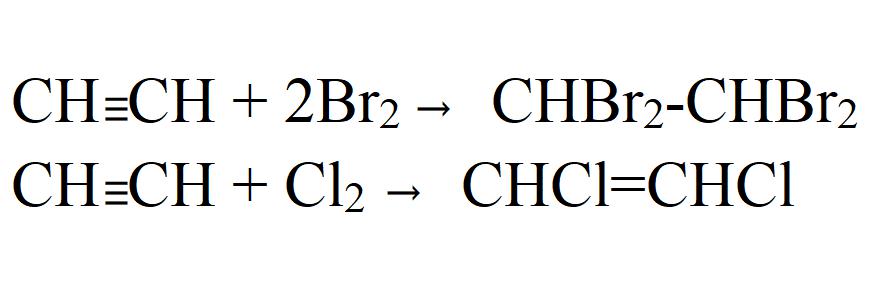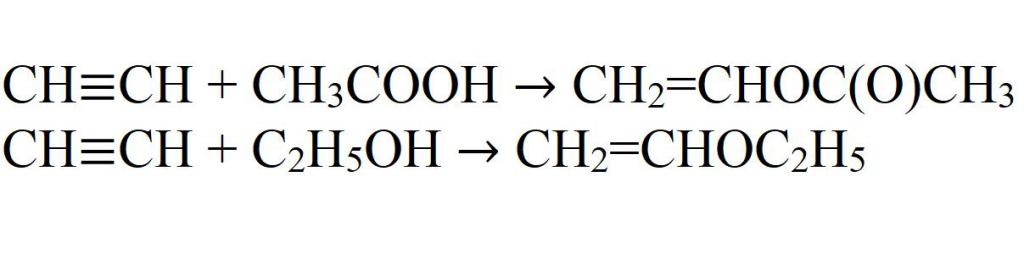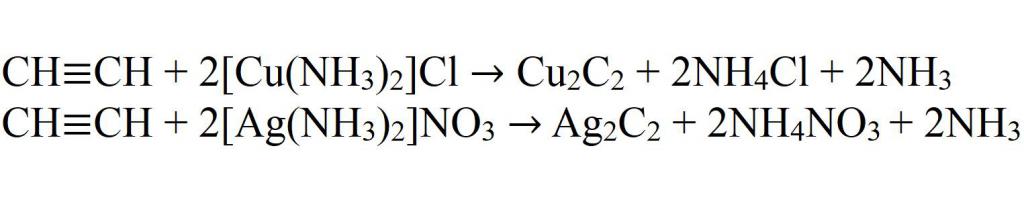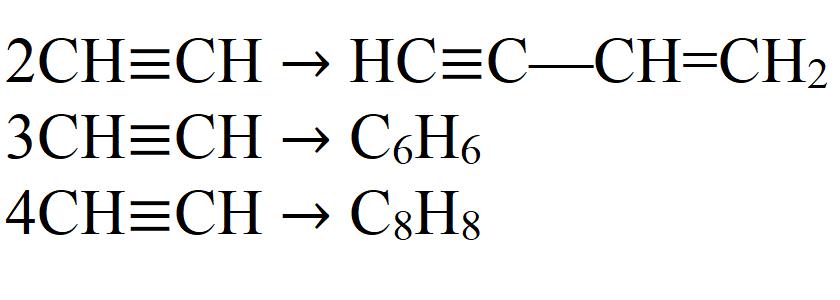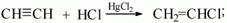Химические свойства алкинов
Алкины – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна тройная связь между атомами углерода С≡С.
Остановимся на свойствах, способах получения и особенностях строения алкинов.
Химические свойства алкинов
Алкины – непредельные углеводороды, в молекулах которых есть одна тройная связь. Строение и свойства тройной связи определяют характерные химические свойства алкинов. Химические свойства алкинов схожи с химическими свойствами алкенов из-за наличия кратной связи в молекуле.
Для алкинов характерны реакции окисления. Окисление алкенов протекает преимущественно по тройной связи, хотя возможно и жесткое окисление (горение).
1. Реакции присоединения
Тройная связь состоит из σ-связи и двух π-связей. Сравним характеристики одинарной связи С–С, тройной связи С ≡ С и связи С–Н:
| Энергия связи, кДж/моль | Длина связи, нм | |
| С – С | 348 | 0,154 |
| С ≡ С | 814 | 0,120 |
| С – Н | 435 | 0,107 |
Таким образом, тройная связь С≡С короче, чем одинарная связь С–С , поэтому π-электроны тройной связи прочнее удерживаются ядрами атомов углерода и обладают меньшей поляризуемостью и подвижностью. Реакции присоединения по тройной связи к алкинам протекают сложнее, чем реакции присоединения по двойной связи к алкенам.
Для алкинов характерны реакции присоединения по тройной связи С ≡ С с разрывом π-связей.
1.1. Гидрирование
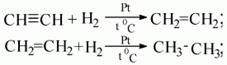
Гидрирование алкинов протекает в присутствии катализаторов (Ni, Pt) с образованием алкенов, а затем сразу алканов.
| Например, при гидрировании бутина-2 в присутствии никеля образуется сначала бутен-2, а затем бутан. |
При использовании менее активного катализатора (Pd, СaCO3, Pb(CH3COO)2) гидрирование останавливается на этапе образования алкенов.
| Например, при гидрировании бутина-1 в присутствии палладия преимущественно образуется бутен-1. |
1.2. Галогенирование алкинов
Присоединение галогенов к алкинам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
| При взаимодействии с алкинами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на тройную связь. |
| Например, при бромировании пропина сначала образуется 1,2-дибромпропен, а затем — 1,1,2,2-тетрабромпропан. |
Аналогично алкины реагируют с хлором, но обесцвечивания хлорной воды при этом не происходит, потому что хлорная вода и так бесцветная)
Реакции протекают в присутствии полярных растворителей по ионному (электрофильному) механизму.
1.3. Гидрогалогенирование алкинов
Алкины присоединяют галогеноводороды. Реакция протекает по механизму электрофильного присоединения с образованием галогенопроизводного алкена или дигалогеналкана.
| Например, при взаимодействии ацетилена с хлороводородом образуется хлорэтен, а затем 1,1-дихлорэтан. |
При присоединении галогеноводородов и других полярных молекул к симметричным алкинам образуется, как правило, один продукт реакции, где оба галогена находятся у одного атома С.
При присоединении полярных молекул к несимметричным алкинам образуется смесь изомеров. При этом выполняется правило Марковникова.
| Правило Марковникова: при присоединении полярных молекул типа НХ к несимметричным алкинам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи. |
| Например, при присоединении хлороводорода HCl к пропину преимущественно образуется 2-хлорпропен. |
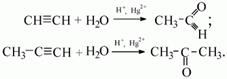
1.4. Гидратация алкинов
Гидратация (присоединение воды) алкинов протекает в присутствии кислоты и катализатора (соли ртути II).
Сначала образуется неустойчивый алкеновый спирт, который затем изомеризуется в альдегид или кетон.
| Например, при взаимодействии ацетилена с водой в присутствии сульфата ртути образуется уксусный альдегид. |
Гидратация алкинов протекает по ионному (электрофильному) механизму.
Для несимметричных алкенов присоединение воды преимущественно по правилу Марковникова.
| Например, при гидратации пропина образуется пропанон (ацентон). |
1.5. Димеризация, тримеризация и полимеризация
Присоединение одной молекулы ацетилена к другой (димеризация) протекает под действием аммиачного раствора хлорида меди (I). При этом образуется винилацетилен:
Тримеризация ацетилена (присоединение трех молекул друг к другу) протекает под действием температуры, давления и в присутствии активированного угля с образованием бензола (реакция Зелинского):
Алкины также вступают в реакции полимеризации — процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
| Например, при полимеризации ацетилена образуется полимер линейного или циклического строения. |
… –CH=CH–CH=CH–CH=CH–…
2. Окисление алкинов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
2.1. Горение алкинов
Алкины, как и прочие углеводороды, горят с образованием углекислого газа и воды.
Уравнение сгорания алкинов в общем виде:
| Например, уравнение сгорания пропина: |
2.2. Окисление алкинов сильными окислителями
Алкины реагируют с сильными окислителями (перманганаты или соединения хрома (VI)). При этом происходит окисление тройной связи С≡С и связей С-Н у атомов углерода при тройной связи. При этом образуются связи с кислородом.
При окислении трех связей у атома углерода в кислой среде образуется карбоксильная группа СООН, четырех — углекислый газ СО2. В нейтральной среде — соль карбоновой кислоты и карбонат (гидрокарбонат) соответственно.
Таблица соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| R-C ≡ | R-COOH | -COOMe |
| CH ≡ | CO2 | Me2CO3 (MeHCO3) |
При окислении бутина-2 перманганатом калия в среде серной кислоты окислению подвергаются два фрагмента СН3–C ≡ , поэтому образуется уксусная кислота:
При окислении 3-метилпентина-1 перманганатом калия в серной кислоте окислению подвергаются фрагменты R–C и H–C , поэтому образуются карбоновая кислота и углекислый газ:
При окислении алкинов сильными окислителями в нейтральной среде углеродсодержащие продукты реакции жесткого окисления (кислота, углекислый газ) могут реагировать с образующейся в растворе щелочью в соотношении, которое определяется электронным балансом с образованием соответствующих солей.
| Например, при окислении бутина-2 перманганатом калия в воде при нагревании окислению подвергаются два фрагмента R–C ≡ , поэтому образуется соль уксусной кислоты – ацетат калия |
Аналогичные органические продукты образуются при взаимодействии алкинов с хроматами или дихроматами.
Окисление ацетилена протекает немного иначе, σ-связь С–С не разрывается, поэтому в кислой среде образуется щавелевая кислота:
В нейтральной среде образуется соль щавелевой кислоты – оксалат калия:
Обесцвечивание раствора перманганата калия — качественная реакция на тройную связь.
3. Кислотные свойства алкинов
Связь атома углерода при тройной связи (атома углерода в sp-гибридизованном состоянии) с водородом значительно более полярная. чем связь С–Н атома углерода при двойной или одинарной связи (в sp 2 и sp 3 -гибридном состоянии соответственно). Это обусловлено большим вкладом s-орбитали в гибридизованное состояние.
| Гибридизация: | sp | sp 2 | sp 3 |
| Число s-орбиталей | 1 | 1 | 1 |
| Число p-орбиталей | 1 | 2 | 3 |
| Доля s-орбитали | 50% | 33% | 25% |
Повышенная полярность связи С–Н у атомов углерода при тройной связи в алкинах приводит к возможности отщепления протона Н + , т.е. приводит к появлению у алкинов с тройной связью на конце молекулы (алкинов-1) кислотных свойств.
| Ацетилен и его гомологи с тройной связью на конце молекулы R–C ≡ C–H проявляют слабые кислотные свойства, атомы водорода на конце молекулы могут легко замещаться на атомы металлов. |
Алкины с тройной связью на конце молекулы взаимодействуют с активными металлами, гидридами, амидами металлов и т.д.
| Например, ацетилен взаимодействует с натрием с образованием ацетиленида натрия. |
| Например, пропин взаимодействует с амидом натрия с образованием пропинида натрия. |
Алкины с тройной связью на конце молекулы взаимодействуют с аммиачным раствором оксида серебра (I) или аммиачным раствором хлорида меди (I).
При этом образуются нерастворимые в воде ацетилениды серебра или меди (I):
| Алкины с тройной связью на конце молекулы взаимодействуют с аммиачным раствором оксида серебра или аммиачным раствором хлорида меди (I) с образованием белого или красно-коричневого осадка соответственно. Это качественная реакция на алкины с тройной связью на конце молекулы. |
Соответственно, алкины, в которых тройная связь расположена не на конце молекулы, не реагируют с аммиачными растворами оксида серебра или хлорида меди (I).
Взаимодействие ацетилена с водородом
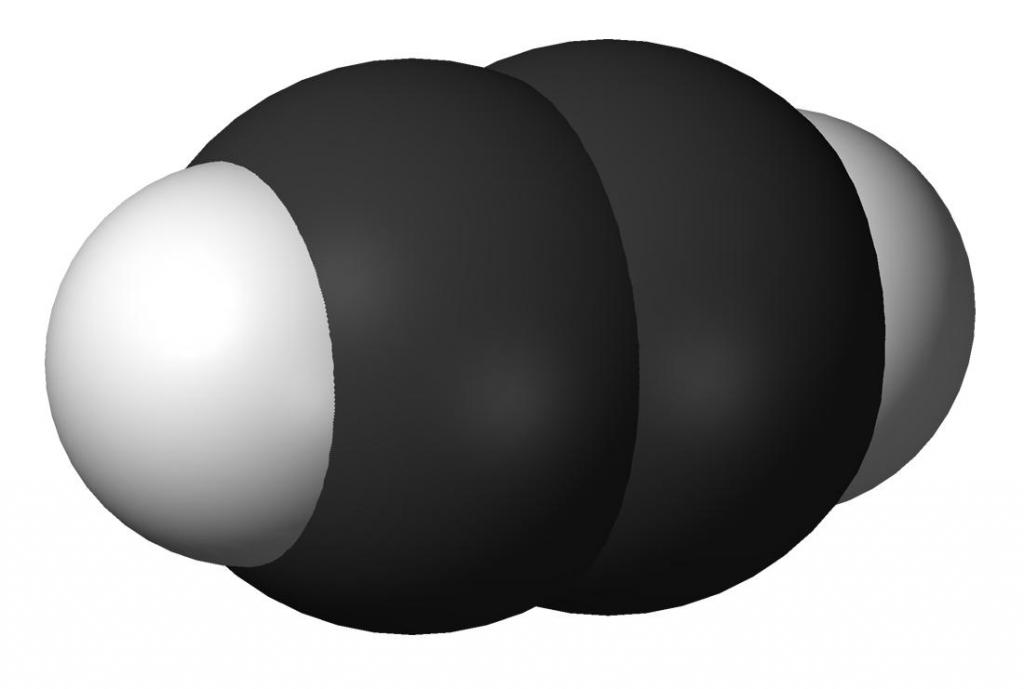
Ацетилен (или по международной номенклатуре – этин) – это непредельный углеводород, принадлежащий к классу алкинов. Химическая формула ацетилена – C2H2. Атомы углерода в молекуле соединены тройной связью. Он является первым в своем гомологическом ряду. Представляет собой бесцветный газ. Очень огнеопасен.
Получение
Все методы промышленного получения ацетилена сходятся к двум типам: гидролиз карбида кальция и пиролиз различных углеводородов. Последний требует меньших энергозатрат, но чистота продукта довольно низкая. У карбидного метода – наоборот.
Суть пиролиза заключается в том, что метан, этан или другой легкий углеводород при нагреве до высоких температур (от 1000 °C) превращается в ацетилен с выделением водорода. Нагрев может осуществятся электрическим разрядом, плазмой или сжиганием части сырья. Но проблема состоит в том, что в результате реакции пиролиза может образовываться не только ацетилен, но и еще множество разных продуктов, от которых необходимо впоследствии избавляться.
Карбидный метод основан на реакции взаимодействия карбида кальция с водой. Карбид кальция получают из его оксида, сплавляя с коксом в электропечах. Отсюда и такой высокий расход энергии. Зато чистота ацетилена, получаемого таким способом, крайне высока (99,9 %).
В лаборатории ацетилен также можно получить дегидрогалогенированием дигалогенпроизводных алканов с помощью спиртового раствора щелочи.
Физические свойства ацетилена
Ацетилен – это газ без цвета и запаха. Хотя примеси могут давать ему чесночный запах. Практически не растворим в воде, немного растворим в ацетоне. При температуре -83,8 °C сжижается.
Химические свойства ацетилена
Исходя из тройной связи ацетилена, для него будут характерны реакции присоединения и реакции полимеризации. Атомы водорода в молекуле ацетилена могут замещаться другими атомами или группами. Поэтому можно сказать, что ацетилен проявляет кислотные свойства. Разберем химические свойства ацетилена на конкретных реакциях.
- Гидрирование. Осуществляется при высокой температуре и в присутствии катализатора (Ni, Pt, Pd). На палладиевом катализаторе возможно неполное гидрирование.
- Галогенирование. Может быть как частичным, так и полным. Идет легко даже без катализаторов или нагревания. На свету хлорирование идет с взрывом. При этом ацетилен полностью распадается до углерода.
- Присоединение к уксусной кислоте и этиловому спирту. Реакции идут только в присутствии катализаторов.
- Присоединение синильной кислоты.
- Взаимодействие ацетилена с металл-органическими соединениями.
- Взаимодействие с металлическим натрием. Необходима температура 150 °C или предварительное растворение натрия в аммиаке.
2CH≡CH + 2Na → 2CH≡CNa + H2
- Взаимодействие с комплексными солями меди и серебра.
- Взаимодействие с амидом натрия.
- Димеризация. При этой реакции две молекулы ацетилена объединяются в одну. Необходим катализатор – соль одновалентной меди.
- Тримеризация. В этой реакции три молекулы ацетилена образуют бензол. Необходим нагрев до 70 °C, давление и катализатор.
- Тетрамеризация. В результате реакции получается восьмичленный цикл – циклооктатетраен. Для этой реакции также требуется небольшой нагрев, давление и соответствующий катализатор. Обычно это комплексные соединения двухвалентного никеля.
Это далеко не все химические свойства ацетилена.
Применение
Структурная формула ацетилена указывает нам на довольно прочную связь между атомами углерода. При ее разрыве, например при горении, выделяется очень много энергии. По этой причине ацетиленовое пламя обладает рекордно высокой температурой – около 4000 °C. Его используют в горелках для сварки и резки металла, а также в ракетных двигателях.
Пламя горения ацетилена имеет также очень высокую яркость, поэтому его часто используют в осветительных приборах. Используется он и во взрывотехнике. Правда, там применяется не сам ацетилен, а его соли.
Как видно из разнообразных химический свойств, ацетилен может применяться как сырье для синтеза других важных веществ: растворителей, лаков, полимеров, синтетических волокон, пластмасс, органического стекла, взрывчатых веществ и уксусной кислоты.
Безопасность
Как уже говорилось, ацетилен – огнеопасное вещество. С кислородом или воздухом он способен образовывать крайне легковоспламеняющиеся смеси. Чтобы вызвать взрыв, достаточно одной искры от статического электричества, нагрева до 500 °C или небольшого давления. При температуре 335 °C чистый ацетилен самовоспламеняется.
Из-за этого ацетилен хранят в баллонах под давлением, которые наполнены пористым веществом (пемза, активированный уголь, асбест). Таким образом, ацетилен распределяется по порам, уменьшая риск взрыва. Часто эти поры пропитывают ацетоном, из-за чего образуется раствор ацетилена. Иногда ацетилен разбавляют другими, более инертными газами (азот, метан, пропан).
Этот газ обладает и токсичным действием. При его вдыхании начнется интоксикация организма. Признаками отравления являются тошнота, рвота, шум в ушах, головокружение. Большие концентрации могут приводить даже к потере сознания.
1) ацетилен данного ряда углеводородов имеет большое практическое значение;
2) в отличие от метана и этилена, ацетилен горит ярким пламенем.
Примеры горения ацетилена: сварочные работы на стройках, в мастерских, на заводах.
Во всех этих случаях не видно образования копоти.
В данном случае: а) частички углерода сильно раскаляются в средней части пламени; б) придают ему яркость; в) в конечном итоге сгорают полностью.
При сварочных работах вместо воздуха используется кислород. При этом достигается полное сгорание ацетилена, возрастает температура пламени до 3000 °C. Смеси ацетилена с воздухом и кислородом взрывоопасны;
3) π-связь уступает по прочности основной δ-связи;
4) по месту π-связей могут проходить реакции присоединения и окисления.
Если в цилиндр, заполненный ацетиленом, налить раствор перманганата калия,раствор быстро обесцветится;
5) ацетилен, как и этилен, легко окисляется;
6) из реакций присоединения для ацетилена характерно взаимодействие с бромом.
Две стадии реакции присоединения при взаимодействии ацетилена с бромом:
1) сначала бром присоединяется по месту одной π-связи и образуется 1,2-дибромэтен: СН = СН + Вr2 → ВrСН=СНВr;
2) затем присоединяется вторая молекула брома по второй π-связи, продуктом реакции является 1,1,2,2-тетрабромэтан: ВrСН=СНВr + Вг2 → Вr2СН– СНВr2;
3) в присутствии катализатора (платины, никеля) к ацетилену может присоединяться водород.
При этом ацетилен сперва превращается в этилен, а затем в этан:
4) при присоединении хлороводорода по одной из π-связей образуется газообразное вещество хлорэтен (хлорвинил). Катализатором данной реакции является хлорид ртути:
5) присоединение воды (гидратация) происходит в присутствии катализатора Hg 2+ в кислой среде (реакция М.Г. Кучерова). При этом ацетилен образует ацетальдегид, а его гомологи – соответствующие кетоны:
Дата добавления: 2015-09-29 ; просмотров: 927 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Определение алкинов, формула, основные химические свойства
Алкины (углеводороды ряда ацетилена) представляют собой химические вещества из группы углеводородов алифатического ряда, которые содержат одну тройную связь -С≡С-.
Общая формула алкинов СnH2n-2.
Самым простым представителем алкинового ряда является ацетилен (этин) С2Н2.
Согласно заместительной номенклатуре IUPAC названия ацетилен углеводородов образуются по названию соответствующих алкана, при этом следует заменить суффикс -ан на -ин (-ин) с обозначением положения тройной связи в цепи углеродных атомов.
Нумерацию атомов карбона начинают с того конца, к которому ближе всего находится тройная связь, например, СН3СН (СН 3) С≡ССН3 – 4-метилпентин-2.
По рациональной номенклатуре углеводороды ацетиленового ряда или алкины называют производными ацетилена, в эмпирической формуле которого атомы водорода замещаютя на радикалы: НС≡С-СН 2 СН 3 – этилацетилен.
Изомерия ацетилен углеводородов связана с положением тройной связи и разветвлением углеродной цепи. Алкины С2-С4 – это газы, С5-С16 – жидкости, а начиная с С17 – твердые субстанции.
Химические свойства алкинов
Химические свойства ацетилен углеводородов обусловленные наличием в структуре их субстанции тройной связи. Ацетиленовая (алкинная) группа -С≡С-Н или -С≡С-R имеет линейное строение, атомы углерода sp-гибридизованные. Они связаны одной σ- и двумя π-связями, при этом максимальные их плотности расположены в двух взаимоперпендикулярных участках, образуя цилиндрическое облако π-электронной плотности. Расстояние -С≡С- равно 1,1205 нм, энергия тройной связи – 836 кДж / моль. Вследствие особенностей строения тройной связи для алкинов характерны реакции окисления, присоединения, полимеризации, изомеризации и замещения. Ацетилен углеводороды присоединяют по связи -С≡С- непосредственно галогены, галогеноводороды – при наличии катализаторов (например, HgCl2, CuCl), образуя дигалогениды и тетрагалогениды.
Указанные реакции используют в производстве трихлорэтилена, тетрахлорэтилена, винилхлорида и других хлоропроизводных соединений. Гидрогенизация алкинов натрием в жидком NH3 приводит к транс-алкенов, водородом над Pd / C – до цис-алкенов. Вода присоединяется в присутствии солей Hg2 + с образованием ацетальдегида для ацетилена и кетонов для всех остальных алкинов (Реакция Кучерова). Прямая гидратация ацетилена возможна при пропускании его в смеси с парами воды при T=300-400° С над фосфатами тяжелых металлов. Реакцию гидратации ацетилена используют в промышленности для получения ацетальдегида и продуктов дальнейших его преобразований – ацетона, уксусной кислоты, спирта и т.д. Спирты взаимодействуют с ацетилен углеводородами в присутствии ROH, BF3 или HgO, алкоксиды щелочных металлов, солей меди при температуре 150-200° С.
Продукты реакции – виниловые эфиры, которые используются в производстве полимеров, эмульгаторов, смазочных материалов и т.д. Аналогично ацетилен углеводородам присоединяются также карбоновые кислоты (при этом в качестве катализатора применяют HgSO4, ацетаты Cd или Zn на активированном угле), амиды кислот, амины, тиолы и другие с образованием виниловых соединений, например:
Винилацетат широко применяют для получения полимера поливинилацетата (ПВА). Путем присоединения к ацетилену цианидной кислоты или при взаимодействии с СО и спиртами, NH3, а также аминами в присутствии в качестве катализатора Ni (CO) 4 под давлением получают нитрил, амиды или эфиры акриловой кислоты, которые используются в синтезе полимеров:
Ацетилен углеводороды в присутствии щелочных катализаторов присоединяют кетоны и альдегиды (реакция Фаворского):
Большую практическую роль играет реакция взаимодействия в присутствии ацетиленидов Cu ацетилена с формальдегидом (реакция Реппе):
Пропаргиловий спирт (I) – выходное соединение при производстве 1,4-бутиленгликоля. Алкины вступают в реакции циклоприсоединения и Дильса – Альдера. Термическая или каталитическая полимеризация приводит к образованию олигомеров и полимеров. Например, под воздействием солей Cu (I) в водном растворе HCl ацетилен димеризуется в винилацетилен, из которого впоследствии получают хлоропрен. Над активным углем ацетилен тримеризуется в бензол в присутствии в качестве катализатора N и (CN)2; в тетрагидрофуране – в циклооктатетраен (реакция Реппе), в присутствии водорода над Ni – в изобутилен. Из метилацетилена можно получить мезитилен и др. В присутствии окислителя и солей меди (I) ацетилен полимеризуется с образованием полиацетилена – карбина, который считается наряду с алмазом и графитом третьей аллотропная видоизменением углерода с кумулированным строением макромолекул:
При действии щелочных металлов тройная связь у алкинов перемещается через стадию образования промежуточных но не на конец молекулы. А в присутствии спиртовых растворов щелочи, наоборот, тройная связь перемещается к середине молекулы:
Алкины с конечными тройными связями (R-C≡CH) обладают высокой для углеводородов кислотностью (для ацетилена рКа≈25) и образуют при действии щелочных, щелочно-земельных металлов, амидов металлов, металлических производных, так называемые ацетилениды МС≡СR, энергично реагирующие с водой, регенерирующим ацетилен углеводороды.
Из магнийорганических соединений легко образуются магнийгалогенопроизводные ацетилен углеводородов (Реактивы Иоцича). Ацетилениды Na, Mg, Li применяют в органическом синтезе для введения в молекулу ацетиленовой группы, например:
Дизамещенные ацетилениды Cu2C2 и Ag2C2 синтезируются при воздействии на ацетилен аммиачных растворов солей Cu (I) и Ag, соответственно. Образование Cu2C2 красно-бурого цвета применяют для идентификации ацетилена и его гомологов с конечной тройной связью. Ацетилениды тяжелых металлов в сухом виде – это неустойчивые соединения, которые взрываются от сотрясения. В процессе сгорании ацетилена при доступе чистого кислорода выделяется значительное количество тепла (при этом температура пламени достигает 3000 градусов С), что дает возможность применять ацетилен с целью автогенной резки и сварки металлов. Окислители KMnO4 (в нейтральном или щелочной среде), K2Cr2O7, RuO4, SeO2, CrO3 в кислой среде, озон приводят к расщеплению тройной связи с синтезом карбоновых кислот. В некоторых случаях возможно окисление до α-дикетонов. С конечным тройной связью алкины в указанных условиях образуют карбоновую кислоту и СО2.
Методы извлечения ацетилена в промышленности:
- разложение карбида кальция в воде:
- электрокрекинг метана (природного газа с примесями) в электродуговых печах:
Температура 1600 ° С, нормальное давление, смесь газов при этом резко охлаждают водой; - частичное окисление (термоокислительный крекинг) природного газа благодаря теплу, которое выделяется при частичном сгорании метана:
- процесс пиролиза природного газа.
Получают ацетиленовые углеводороды в лабораторных условиях в результате действия спиртового раствора щелочи (КОН – спиртовой раствор) на 1,1- или 1,2-дигалогенопроизводные углеводородов:
- алкилированием ацетиленидов натрия, электролизом двухосновных ненасыщенных кислот.
Алкины, в частности полиацетилен, обнаруженные в природе во многих растениях, грибах (Bas >
Алкины (ацетиленовые углеводороды) наркотического действия, усиливается с увеличением молекулярной массы субстанции.
Длительная работа специалистов с ацетиленом в промышленных условиях могут привести к функциональным нарушениям нервной системы. Высокие концентрации ацетилена при незначительном содержании кислорода приводят к отеку легких и потере сознания.
Применение алкинов (ацетиленовых углеводородов) в медицине
Ацетилен – один из базовых сырьевых источников промышленности органического синтеза. При конденсации ацетилена с пирролидоном получают N-винилпирролидона, который легко полимеризуется с синтезом поливинилпирролидона (ПВП):
Полимерные соединения на основе винилпирролидона нашли широкое применение в медицинской практике как вещества при производстве лекарственных препаратов, а многие из них сами являются лекарственными. Например низкомолекулярный поливинилпирролидон (12000-13000 молекулярная масса) образует коллоидные растворы в воде и используется в процессе приготовления гемодеза (кровезаменителя), среднемолекулярные поливинилпирролидон (с молекулярной массой 35000-40000) применяется в фармации как связующее вещество для изготовления таблеток.
При сополимеризации винилпирролидона, акриламида и этилкрилата получают биорастворимый полимер, который обеспечивает удлиненное действие лекарственных препаратов (пролонгируя эффект), например, лекарственных пленок для глаз.
Полезно знать
© VetConsult+, 2015. Все права защищены. Использование любых материалов, размещённых на сайте, разрешается при условии ссылки на ресурс. При копировании либо частичном использовании материалов со страниц сайта обязательно размещать прямую открытую для поисковых систем гиперссылку, расположенную в подзаголовке или в первом абзаце статьи.
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. источники: http://morflot.su/vzaimodejstvie-acetilena-s-vodorodom/ http://acetyl.ru/o/a21d2d.php |