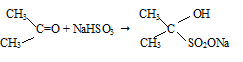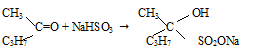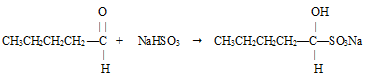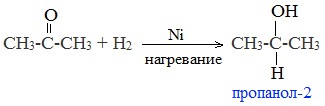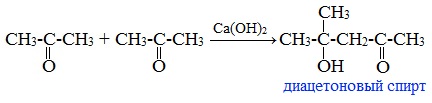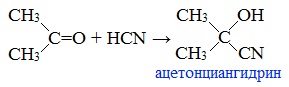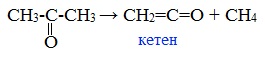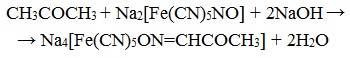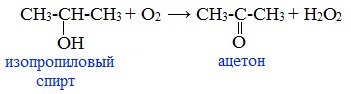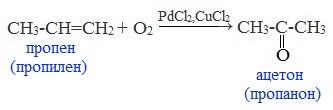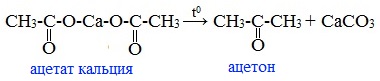Характерные реакции присоединения для альдегидов и кетонов
Задание 338.
Написать уравнения реакций присоединения водорода и гидросульфита натрия к следующим соединениям: а) ацетону; б) метилпропилкетону; в) пентаналю.
Решение:
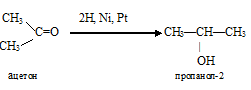
а)
1) присоединение водорода к ацетону:
При этом из кетона получается вторичный спирт.
2) присоединение гидросульфита натрия к ацетону:
Ацетон присоединяет гидросульфит натрия с образованием бисульфитного соединения.
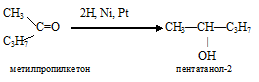
1) присоединение водорода к метилпропилкетону:
При этом из метилпропилкетона получается вторичный спирт.
2) присоединение гидросульфита натрия к метилпропилкетоу:
Метилпропилкетон присоединяет гидросульфит натрия с образованием бисульфитного соединения.
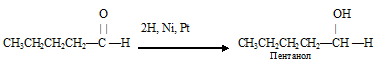
1) присоединение водорода к пентаналю:
При этом образуется первичный спирт.
2) присоединение гидросульфита натрия к пентаналю:
При этом образуется гидросульфитное производное пентаналя.
Реакция ацетона с гидросульфитом натрия уравнение реакции
Ацетон — простейший представитель насыщенных кетонов.
Физические свойства
Ацетон (пропанон-2, диметилкетон) СН3-СО-СН3 — летучая бесцветная жидкость с характерным запахом и температурой кипения 56 0 С.

Он хорошо растворяет многие органические вещества (жиры, смолы, ацетилцеллюлозу, воск, резину и др.), поэтому является незаменимым растворителем в быту и в лакокрасочной промышленности.
Ацетон встречается в организме человека. Он является промежуточным продуктом обмена веществ. Незначительное количество ацетона, образующееся в организме человека в результате метаболических реакций, выводится вместе с мочой. У больных диабетом следы ацетона можно обнаружить в выдыхаемом воздухе.
Один из простейших и в то же время важнейших из кетонов — ацетон — впервые выявлен в 1595 году немецким химиком Андреасом Либавием в процессе сухой перегонки ацетата свинца. Однако точно определить его природу и химический состав удалось только в 1832 году Жану-Батисту Дюма и Юстусу фон Либиху. До 1914 года ацетон получали практически исключительно коксованием древесины.
Токсичность ацетона
Ацетон обладает возбуждающим и наркотическим действием, поражает центральную нервную систему. Ацетон способен накапливаться в организме, т.к. медленно выводится из организма. Он может поступать в организм с вдыхаемым воздухом, а также через пищевой канал и кожу.
После поступления ацетона в кровь часть его переходит в головной мозг, селезенку, печень, поджелудочную железу, почки, легкие и сердце. Содержание ацетона в указанных органах несколько меньшее, чем в крови.
При вдыхании паров ацетона происходит кислородное голодание мозга. Поэтому, в помещениях, в которых происходит испарение ацетона, создается опасность отравления при вдыхании его паров.
Химические свойства
Ацетон является одним из наиболее реакционноспособных кетонов.
Ацетон, как и все кетоны, не дает реакции «серебряного зеркала», не полимеризуется. В этом его отличие от альдегидов.
1. Гидрирование (восстановление)
При тех же условиях, что и формальдегид, ацетон присоединят водород:
Водород присоединяется вследствие разрыва двойной связи карбонильной группы.
2. Взаимодействие с гидросульфитом натрия
Ацетон один из немногих кетонов образует бисульфитное соединение:
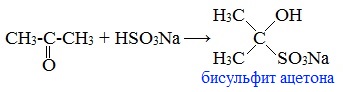
Под действием щелочей ацетон вступает в альдольную самоконденсацию, с образованием «ацетонового» (диацетонового) спирта:
4. Взаимодействие с синильной кислотой
Одной из наиболее важных реакций ацетона является присоединение к нему синильной кислоты с образованием ацетонциангидрина:
5. Пиролиз ацетона
При нагревании выше 500 0 C ацетон распадается на кетен и метан:
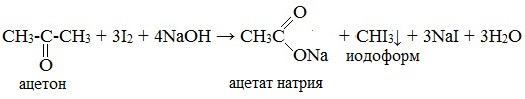
6. Галоформная реакция (иодоформная реакция, или проба Люголя)
Качественная реакция на ацетон!
При взаимодействии ацетона с избытком йода в щелочной среде образуется йодоформ – желтое вещество с характерным запахом:
Аналогичные реакции идут с хлором и бромом, но только реакция с йодом приводит к нерастворимому йодоформу.
7. Взаимодействие с нитропруссидом натрия
Качественная реакция на ацетон!
Ацетон с нитропруссидом натрия в щелочной среде дает интенсивно-красную окраску . При подкислении уксусной кислотой CH3COOH окраска переходит в красно-фиолетовую :
Йодоформная реакция и реакция с нитропруссидом натрия используются для обнаружения ацетона в моче при сахарном диабете.
Получение
Ацетон получают в больших количествах различными методами: при сухой перегонке дерева, разложением ацетата кальция, окислением пропена, «кумольным» способом, окислением изопропилового спирта, гидратацией ацетилена водяным паром.
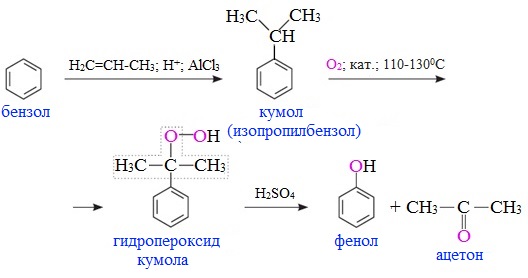
1.Кумольный способ
Данный способ получения фенола основан на окислении кумола (изопропилбензола). В качестве исходных продуктов используют бензол и пропилен.
Процесс протекает в три стадии. На первой стадии бензол алкилируется пропеном с получением кумола, на второй и третьей (реакция Удриса-Сергеева) полученный кумол окисляется кислородом воздуха до гидропероксида, который при действии серной кислоты разлагается на фенол и ацетон:
Окисление кумола — экономически выгодный метод, так как позволяет получить наряду с фенолом другой важный продукт — ацетон (на 1 кг фенола приходится 0,6 кг ацетона). В настоящее время этот метод наиболее широко используется в промышленности и позволяет производить более 80% синтетического фенола.
2. Окисление изопропилового спирта
Ацетон получают в больших количествах при окислении изопропилового спирта:
В качестве катализатора применяется медь, серебро, никель, платина и др. Воздух, насыщенный парами изопропилового спирта, пропускают над тонким слоем катализатора при температуре 400-650 0 С.
Если процесс окисления протекает в жидкой фазе, то, как побочный продукт образуется пероксид водорода:
3. Каталитическое окисление пропена кислородом воздуха
В промышленности ацетон получают прямым окислением пропена в жидкой фазе в присутствии катализатора — смеси PdCl2 и CuCl2 при температуре 100 0 C:
4. Брожение крахмала
Незначительное значение имеет метод брожения крахмала под действием бактерий с образованием ацетона и бутанола. Метод характеризуется малыми выходами.
5. Пиролиз ацетата кальция
Ацетон можно получить пиролизом ацетата кальция:
6. Гидратация ацетилена водяным паром
Реакция протекает при 400-460 0 С над катализатором, содержащим оксиды железа и марганца:
Применение
В качестве растворителя ацетон используется в производстве красок, лаков и олифы, резины, пластмасс, красителей, взрывчатых веществ, а также в фотографии.
Ацетон применяется в производство искусственного шелка и синтетической кожи, в производстве смазочных масел, бездымного пороха, кинопленки.
В химической промышленности ацетон является промежуточным химическим соединением при производстве многих химикатов, таких как кетен, уксусный ангидрид, бисфенол А, метилметакрилат, хлороформ, изофорон, йодоформ, витамин С.
Метилметакрилат применяется, главным образом, в виде листов пластика, порошков для литья и формовки, поверхностных покрытий, эмульсионных полимеров, волокон, чернил и пленок.
Метилметакрилат также применяется в производстве материалов, известных под названием плексигласа или люцита. Они используются в зубных протезах, твердых контактных линзах, и клеях.
Метилметакрилат – мономер для синтеза полиметилметакрилата («органическое сырье»).
Присоединение гидросульфита натрия
Вы будете перенаправлены на Автор24
К карбонильной группе в качестве нуклеофильной частицы могут такжк присоединятся гидросульфит-ионы в результате чего образуются $\alpha$-оксипроизводные сульфокислот:
Атом серы имеет большую нуклеофильность, чем атом кислорода, и карбонильный электрофильный центр атакуется серой сульфит-иона $
Реакция присоединения гидросульфита общая как для альдегидов, так и для метилкетонов. Однако кетоны с более длинными радикалами, чем метильный, не могут присоединять гидросульфит-ионы из-за пространственного препятствия для нуклеофильных атак этим нуклеофилом. Присоединение гидросульфита по месту карбонильной группы, подобно многим реакциям, обратимый процесс, и для выхода целевого продукта присоединения следует использовать большой избыток 40%-го водного раствора гидросульфита:
В кислых или наоборот щелочных средах происходит обратная реакция, которая позволяет выделять карбонильные соединения при их идентификации:
Готовые работы на аналогичную тему
Применение гидросульфитных производных карбонильных соединений
Так как гидросульфитные производные карбонильных соединений представляют собой кристаллические вещества, то реакцию присоединения гидросульфита к ним часто используют для выделения этих карбонильных соединений из реакционной смеси. Исходные вещества могут быть легко получены при обработке гидросульфитных производных кислотами или основаниями, или например, карбонатом натрия. Из-за этого гидросульфитные производные карбонильных соединений часто используют для так называемой «консервации» карбоксильной группы, чтобы предохранить её от окисления или альдольной конденсации. Гидросульфитные производные также применяют и для получения цианогидринов при взаимодействии их с цианидом калия:
Присоединение гидрид-аниона
При применении соединений типа тетрагидроалюмината лития $LiAlH_4$ или тетрагидробората лития $LiBH_4$ ($N$-нуклеофилы) реакция присоединения происходит с перемещением гидридного аниона. В ней могут участвовать все четыре атома водорода аниона $[AlH_4]^-$:
К реакциям такого типа относят реакцию Меервейна-Понндорфа-Верлея (1926-1929 гг.) — cелективное восстановление карбонильных соединений с помощью триизопропилата алюминия в качестве донора гидрид-анионов:
В процессе восстановления образуется промежуточный комплекс между молекулами реагирующих компонентов, в котором происходит перемещение гидрид-иона от фрагмента изопропилового спирта к карбокатиону карбонильного соединения, который восстанавливается, с последующим расщеплением связи $O-A1$ и образованием молекулы спирта:
В процессе реакции одна изопропокси-группа триизопропилата алюминия окисляется до ацетона.
Присоединение галогенид-ионов
Прямого взаимодействия карбонильной группы с галогеном не происходит, но при воздействии сильных электрофилов вроде $PCl_5$ или $SF_4$, реакция проходит с начальной активацией карбонильной группы и последующей ее взаимодействием с галогенид-ионом:
Аналогично кетоны образуют геминальные галогенопроизводные:
Получи деньги за свои студенческие работы
Курсовые, рефераты или другие работы
Автор этой статьи Дата последнего обновления статьи: 24 02 2022
http://himija-online.ru/organicheskaya-ximiya/aldegidy-i-ketony/aceton-predstavitel-ketonov.html
http://spravochnick.ru/himiya/aldegidy_i_ketony/prisoedinenie_gidrosulfita_natriya/