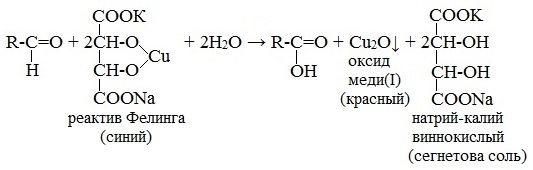
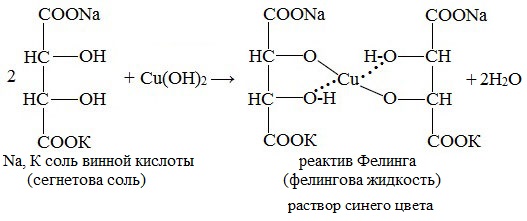
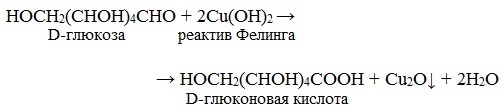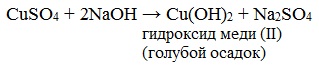Лабораторные органическая химия. Лабораторная работа 1 окси, оксокислоты гидроксикарбоновые кислоты опы Свойства молочной кислоты
| Название | Лабораторная работа 1 окси, оксокислоты гидроксикарбоновые кислоты опы Свойства молочной кислоты |
| Анкор | Лабораторные органическая химия .doc |
| Дата | 22.04.2017 |
| Размер | 0.81 Mb. |
| Формат файла |  |
| Имя файла | Лабораторные органическая химия .doc |
| Тип | Лабораторная работа #5376 |
| страница | 3 из 3 |
| Подборка по базе: Лабораторная работа-раб с вирт машинами.docx, курсовая работа.docx, Конттрольная работа по дисциплине Документирование.docx, Практическая работа.docx, Проектная работа.docx, ПРАКТИЧЕСКАЯ РАБОТА №1 ЗаданиеИностранный язык. Английский. Част, иностранный язык письменная работа.docx, Курсовая работаЭкономика организации.docx, Практическая работа Русский язык.docx, Лабораторная работа №1.pdf Опыт 27. Реакции на гидроксильные группы дисахаридов 27.2. Ацилирование дисахаридов (тяга). В сухой пробирке смешивают 0,5 г безводной лактозы и 0,5 г безводного ацетата натрия. К полученной смеси приливают 2,5 мл уксусного ангидрида, содержимое пробирки перемешивают и нагревают 5 мин при непрерывном встряхивании. Реакционную смесь охлаждают на воздухе и выливают в стакан с водой и льдом при тщательном перемешивании: По какому механизму идет эта реакция? Опыт 28. Реакции дисахаридов по карбонильной группе. Сравнение свойств восстанавливающих и невосстанавливающих дисахаридов Схема реакции окисления мальтозы реактивом Фелинга: Положительную реакцию с фелинговой жидкостью дают восстанавливающие дисахариды (мальтоза и лактоза), в водных растворах которых вследствие таутомерных переходов имеются свободные альдегидные группы. Раствор, содержащий сахарозу, при нагревании до начинающегося кипения не изменяет своей окраски, так как сахароза относится к невосстанавливающим дисахаридам и не окисляется реактивом Фелинга. Следует помнить, что длительное кипячение раствора сахарозы в щелочной среде приводит к ее расщеплению, и продукты гидролиза могут восстанавливать реактив Фелинга до оксида меди (I). Напишите уравнение реакции окисления лактозы реактивом Фелинга. 28.2. Получение фенилозазонов мальтозы и лактозы. В две сухие пробирки помещают по 100 мг (на кончике шпателя) смеси солянокислого фенилгидразина и безводного ацетата натрия (1:3). Затем в одну пробирку добавляют 1 мл 1%-ного раствора мальтозы, а в другую — 1 мл 1%-ного раствора лактозы при тщательном перемешивании. Пробирки помещают на кипящую водяную баню на 15—20 мин. При охлаждении на воздухе, а потом в стакане со льдом в реакционной смеси выпадают кристаллы фенилозазонов мальтозы и лактозы.
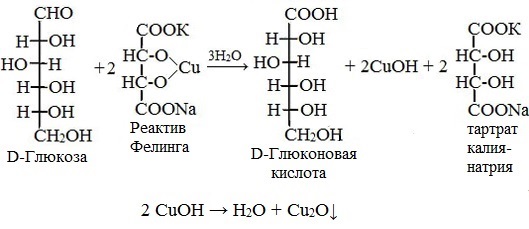
Напишите уравнение реакции образования фенилозазона лактозы. Кристаллы фенилозазонов мальтозы и лактозы рассматривают под микроскопом. Кристаллы озазона мальтозы имеют форму игл, частично образующих сферические скопления, а кристаллы фенилозазона лактозы — форму пластинок, образующих розетки. Зарисуйте кристаллы фенилозазонов мальтозы и лактозы в рабочий журнал. Опыт 29. Гидролиз (инверсия) сахарозы Для доказательства гидролитического расщепления сахарозы необходимо провести реакции, подтверждающие наличие в содержимом пробирки продуктов гидролиза. Для этого содержимое пробирки делят на две части. Первую часть раствора нейтрализуют 10%-ным раствором гидроксида натрия (контроль по универсальной индикаторной бумаге), а затем добавляют равный объем реактива Фелинга и нагревают верхнюю часть жидкости. Наблюдают образование красного осадка оксида меди (I). Для сравнения нагревают смесь исходного раствора сахарозы с равным объемом реактива Фелинга. Окраска раствора не изменяется. Этот опыт показывает, что в результате гидролиза сахарозы, не способной восстанавливать реактив Фелинга, образуется смесь моносахаридов, окисляющихся фелинговой жидкостью. Со второй частью гидролизата проводят реакцию Селиванова на наличие фруктозы, входящей в состав сахарозы (см. опыт 26.1). Опыт 30. Реакция сахарозы с сульфатами кобальта и никеля 3.3. ВЫСШИЕ ПОЛИСАХАРИДЫ В две пробирки наливают по 1 мл 1%-ных растворов полисаха-Ридов: в первую — крахмала, во вторую — гликогена. Затем добавляют равный объем реактива Фелинга. Жидкости тщательно перемешивают и нагревают верхнюю часть растворов до начинающегося кипения. Цвет растворов не изменяется. Молекулы полисахаридов содержат в своем составе большое число соединенных друг с другом при помощи гликозидных связей остатков моносахаридов. Молекулы крахмала (амилоза и амилопектин) содержат в среднем от 1000 до 300000 остатков D-глюкозы, в гликогене число остатков D-глюкозы доходит до нескольких миллионов. Однако в макромолекулах амилозы и амилопектина содержится всего по одному свободному гликозидному гидроксилу, который в растворе может дать альдегидную группу, поэтому концентрация альдегидных групп в растворе настолько мала, что крахмал не восстанавливает реактив Фелинга. В молекулах гликогена общее число глюкозных остатков выше, чем в молекулах амилопектина, поэтому он, как и крахмал, не обладает восстанавливающими свойствами. Опыт 32. Взаимодействие крахмала и гликогена с иодом Реакция крахмала и гликогена с иодом представляет собой сложный процесс. Синюю окраску с иодом дает амилоза — одна из фракций крахмала. Амилоза — полисахарид линейного строения, состоящий из остатков а, D-глюкопиранозы. Ее молекулы имеют структуру спирали, внутри которой есть свободный канал диаметром около 5 мкм, в него внедряются молекулы иода, образуя окрашенные комплексы («соединения включения») за счет взаимодействия с гидроксильными группами моносахаридных остатков. При нагревании молекулы амилозы теряют свою спиралевидную структуру, и окрашенные комплексы разрушаются, при охлаждении спиралевидная структура амилозы и, следовательно, окрашенные комплексы восстанавливаются. Для полисахаридов с разветвленными цепями (амилопектин и гликоген) наряду с процессами образования комплексов большое значение имеет процесс адсорбции иода на поверхности боковых цепей. Если боковые цепи в молекуле гликогена короткие, то развивается бурая окраска, если они длинные, то темно-красная. Опыт 33. Гидролиз крахмала Реактивы и оборудование: 1%-ный раствор крахмала, 10%-ный раствор серной кислоты, разбавленный раствор иода в иодиде калия (раствор Люголя), 10%-ный раствор гидроксида натрия, реактив Фелинга, универсальная индикаторная бумага; конические колбы на 100 мл, пипетки, мерные цилиндры на 50 и 10 мл, пробирки. Схема гидролиза крахмала: После того как реакционная смесь перестанет давать окраску с иодом, ее кипятят еще несколько минут, охлаждают и нейтрализуют 10%-ным раствором гидроксида натрия (контроль по универсальной индикаторной бумаге). Отливают в пробирку 1—2 мл гидролизата и добавляют равный объем реактива Фелинга. Верхнюю часть жидкости нагревают на пламени горелки до начинающегося кипения. Выпадает красный осадок оксида меди (I), что свидетельствует о наличии в растворе продуктов глубокого гидролиза крахмала — глюкозы и мальтозы. Напишите уравнения реакций окисления продуктов гидролиза крахмала фелинговой жидкостью. Опыт 34. Кислотный гидролиз клетчатки Реактивы и оборудование: концентрированная серная кислота, 10%-ный раствор гидроксида натрия, реактив Фелинга, универсальная индикаторная бумага; мелко нарезанная фильтровальная бумага, стеклянные палочки, водяные бани, пробирки. В сухую пробирку помещают несколько мелко нарезанных кусочков фильтровальной бумаги и приливают 1 мл концентрированной серной кислоты. Содержимое пробирки тщательно перемешивают стеклянной палочкой до полного разрушения бумаги и образования бесцветного вязкого раствора. После этого к нему осторожно при перемешивании по каплям добавляют 1 мл дистиллированной воды. Пробирку ставят на кипящую водяную баню. Смесь нагревают 10—15 мин при регулярном перемешивании. После охлаждения жидкость нейтрализуют 10%-ным раствором гидроксида натрия (контроль по универсальной индикаторной бумаге) и проводят с ней реакцию с фелинговой жидкостью (см. опыт 55.3) для обнаружения в продуктах гидролиза восстанавливающих Сахаров. Напишите уравнение реакции гидролиза целлюлозы и объясните опыт. Лабораторная работа №4 Опыт 35. Получение фурфурола и его свойства Фурфурол образуется из пентозанов, которые вместе с клетчаткой входят в состав древесины: С полученным раствором фурфурола проводят некоторые реакции. 35.2. На полоску фильтровальной бумаги наносят каплю анилина. В это же место добавляют каплю уксусной кислоты, а затем раствора фурфурола. Появляется пятно, окрашенное в красный цвет. 35.3. В пробирку наливают 1 мл аммиачного раствора гидроксида серебра (см. опыт 22.1) и добавляют 1—2 капли раствора фурфурола. Раствор нагревают на горячей водяной бане. Выпадает черный осадок металлического серебра. Напишите уравнение реакции взаимодействия фурфурола с аммиачным раствором гидроксида серебра. Подберите коэффициенты методом электронного баланса. Полоску белой хлопчатобумажной ткани смачивают водой, отжимают, а затем опускают в раствор «белого» индиго. Через несколько минут ткань вынимают, отжимают от избытка раствора и оставляют развешенной на воздухе. Постепенно «белое» индиго окисляется кислородом воздуха, и ткань окрашивается в синий цвет: К капле пиридина осторожно прибавляют концентрированную соляную кислоту. Реакционная смесь сильно разогревается, и выпадает белый осадок. К полученному осадку приливают воду. Наблюдают его растворение. Напишите уравнение реакции пиридина с соляной кислотой. 37.2. Образование солей пиридина. В две пробирки наливают по 1мл 2%-ных растворов хлорида железа (III) и сульфата меди и добавляют по 1—2 капли раствора пиридина, полученного в предыдущем опыте. В пробирке с хлоридом железа (III) выпадает осадок бурого цвета: В пробирке с сульфатом меди сначала выпадает голубой осадок В избытке пиридина осадок гидроксида меди (II) быстро ра- Опыт 38. Мочевая кислота Несколько кристаллов мочевой кислоты растворяют в 1—2 мл соляную кислоту. Сначала выпадают кристаллы малорастворимой Кристаллы мочевой кислоты имеют форму удлиненных призм. Во вторую пробирку добавляют равный объем фелинговой Реакция фелинга с мальтозой уравнение
Приготавливается непосредственно перед анализом путем смешения двух растворов. Применяется для качественного и количественного определения альдегидов жирного ряда и в особенности моносахаридов. Действие реактива Фелинга основано на восстановлении иона двухвалентной меди до одновалентной за счёт окисления альдегидных групп исследуемых соединений. При этом на холоде выпадает оранжево-жёлтый осадок гидроксида меди (I) СuОН, а при нагревании – красный осадок оксида меди (I) Сu2O. Впервые был предложен в 1850 году немецким химиком Г. Фелингом. Реакция на моносахаридыГлюкоза окисляется свежеосажденным гидроксидом меди (II) в щелочной среде до глюконовой кислоты, восстанавливая ионы Cu +2 до Cu +1 . Углеводы подобного типа называют восстанавливающими. Эта реакция применяется для количественного определения сахаров в пищевых продуктах. Реакция на альдегидыАльдегиды жирного ряда восстанавливают двухвалентную медь в одновалентную. Ароматические альдегиды эту реакцию не дают. Образование реактива ФелингаРеактив Фелинга используется как качественная реакция для определения альдегидной группы. Пищевая химия (стр. 3 )
При анализе сильнокислотных продуктов (виноград, яблоки, томаты, лимоны и др.) во избежание гидролиза полисахаридов производят нейтрализацию спирта, используемого для экстракции, мелом. При анализе продуктов, относительно богатых белками и фенольными веществами (виноград, лук, листовые овощи, свёкла), фильтрат дополнительно обрабатывают нейтральным ацетатом свинца, избыток которого удаляют. 2.1.2 Определение полисахаридов (крахмала и декстринов) Методы определения крахмала трудновоспроизводимы и плохо сопоставимы между собой. Стандартного метода определения крахмала нет. Существует два более или менее приемлемых варианта кислотного гидролиза – соляно-кислотный и гидролиз с хлорной кислотой. Все методы предусматривают следующие стадии: 1. Предварительное освобождение образцов от простых сахаров экстракцией 80 % об. спиртом. 2. Извлечение крахмала из продукта одним из способов: – растворение сначала в холодной, потом в горячей воде; – растворение в солевом растворе; – растворение в растворе хлорной кислоты; – гидролиз слабой кислотой; – частичное расщепление предварительно клейстеризованного крахмала амилазами растительного или животного происхождения. 3. Очистка раствора крахмала от белков. Обычно для этой цели используют фосфорно-вольфрамовую кислоту, ацетат цинка, жёлтую кровяную соль, урания ацетат или другие белковые осадители. 4. Непосредственное определение количества крахмала весовым методом осаждением 90 % об. этанолом с последующей промывкой 70 % об. этанолом или йодным раствором или химическим методом после кислотного или ферментативного гидролиза по содержанию редуцирующих веществ. 2.1.3 Определение содержания сахаров В молочных продуктах для определения содержания лактозы и сахарозы, кроме перечисленных арбитражных методов, используют рефрактометрические и поляриметрические методы. Однако их не применяют в случаях возникновения разногласий между сторонами. Метод рефрактометрии основан на определении показателя преломления (рефракции). Показатель преломления зависит от температуры, длины волны света, при которых производят измерение, и концентрации раствора. Каждое вещество в смеси сохраняет преломляющую способность, а показатель преломления смеси представляет сумму соответствующих показателей преломления всех входящих в смесь веществ. Определение содержания сахаров поляриметрированием. Асимметрический углеродный атом в сахарах делает их оптически активными, способными вращать плоскость поляризации. Это свойство является функцией концентрации водных растворов сахара, поэтому измеряя угол вращения L, можно определить содержание сахаров. Характерным показателем каждого оптически активного вещества является его удельное вращение [L]д – угол вращения плоскости поляризации при 20 °С для линии Д натриевого пламени раствором, содержащим 100 г вещества в 100 см, когда луч в этом растворе проходит путь, равный 100 см. Для сахарозы [L]д равен (+66,5°), лактозы моногидрат – (+52,5°), лактозы безводной – (+55,3°). Содержание вещества в 100 см раствора рассчитывается по формуле где L – угол вращения, град; [L]Д – удельное вращение анализируемого вещества при температуре 20 °С; l – длина поляризационной трубки, дм. 2.1.4 Определение пищевых волокон Из неусвояемых углеводов отдельно определяют пектин, гемицеллюлозу и клетчатку. Стандартного метода определения пектинов нет. Наиболее воспроизводимые методы определения пектинов включают следующие стадии: – предварительное освобождение образцов от простейших сахаров трёхкратной экстракцией 80 % об. этиловым спиртом; – извлечение пектинов из продуктов; Гемицеллюлозы по химическим свойствам весьма близки к пектинам. В их состав также входят пентозы и галактуроновая кислота, однако гидролизуются они труднее. Поэтому их определяют после удаления пектинов тёплой водой (после удаления простых сахаров). Гемицеллюлозы извлекают путём кислотного или щелочного гидролиза. Под пищевой, или сырой, клетчаткой понимают целлюлозу с небольшой примесью лигнина и гемицеллюлоз. Для пищевых продуктов наиболее приемлемым является следующий метод. Гидролизуют легкорастворимые углеводы смесью 80%-ной уксусной и концентрированной азотной кислот в соотношении 10:1 в течение 0,5…2 ч. Остаток фильтруют через предварительно взвешенный асбестовый фильтр, промывают, высушивают и взвешивают. Для ускорения гидролиза к вышеуказанной смеси кислот добавляют небольшое количество хлорной кислоты. Для количественного определения «пищевых волокон», т. е. суммы всех неусвояемых углеводов в основном используются ферментативные методы, основанные на гидролизе белков, а затем крахмала (или наоборот) с помощью ферментативных препаратов, имитирующих расщепление этих групп соединений в желудочно-кишечном тракте человека. Оставшийся «непереварившийся» остаток принимают за пищевые волокна. В свою очередь, их делят на нерастворимые в спирте (грубые) и растворимые в нём (неструктурированные, или мягкие) волокна. 2.2 Качественные реакции на углеводы Цель работы: изучение классификации, строения и свойств углеводов растительного сырья и продуктов. Освоение методов определения углеводов. Объекты исследования: сахар, мёд, сок, молоко, крахмал. 2.2.1 Качественные реакции моносахаридов Задание для выполнения: провести качественные реакции моносахаридов – реакцию Троммера; реакцию Фелинга; реакцию Барфеда; реакцию Селиванова. Моносахариды, благодаря наличию свободной кетонной или альдегидной группировки, способны окисляться до соответствующих кислот, одновременно восстанавливая соли металлов. Это свойство используется для ряда качественных и количественных реакций. Принцип реакции: растворы гексоз, например, глюкозы и фруктозы, в щелочной среде восстанавливают при нагревании оксид меди (II) в гемиоксид меди, а сами окисляются до альдоновых кислот. Эту реакцию для глюкозы в общем виде можно представить уравнениями: Материалы и реактивы: раствор глюкозы (5%-ный ), 5%-ный раствор гидроксида натрия, 5%-ный раствор сульфата меди. Оборудование: стеклянные палочки, пробирки, пипетки градуировочные, капельницы, штатив для пробирок, горелка. Порядок выполнения работы: в пробирку к 3 см3 раствора глюкозы (исследуемого вещества) добавляют растворы гидроксида натрия Принцип реакции: в реактиве Фелинга ионы меди (II) находятся в виде комплексного соединения с тартратами. Механизм реакции гексоз (и всех редуцирующих углеводов) с реактивом Фелинга такой же, как и в реакции Троммера. Преимуществом реактива Фелинга является то, что медь при избытке реактива не выпадает в виде окиси меди (II). Дисахариды и полисахариды взаимодействуют с реактивом Фелинга после кипячения с минеральными кислотами. Материалы и реактивы: раствор глюкозы (5%-ный); реактив Фелинга, который состоит из двух растворов. Для приготовления первого раствора 200 г сегнетовой соли и 150 г гидроксида натрия растворяют в дистиллированной воде и доводят объём до 1. Для приготовления второго раствора 40 г перекристаллизованного сульфида меди растворяют в дистиллированной воде до объёма 1. Равные объёмы первого и второго растворов смешивают перед работой. Оборудование: стеклянные палочки, пробирки, пипетки градуировочные, штатив для пробирок, горелка. Порядок проведения работы: в пробирку вносят 1 см3 раствора глюкозы и 1 см3 реактива Фелинга. Смесь перемешивают и нагревают в пламени горелки до кипения. Наблюдают образование красного осадка гемиоксида меди. 2.2.1.3 Реакция Барфеда (реакция с уксуснокислой медью) Принцип реакции: гексозы в реакции с ацетатом меди приводят к образованию гемиоксида меди. Суммарное уравнение реакции для глюкозы имеет вид: Эта реакция протекает в среде со значением рН, близким к нейтральному (7,0). В этих условиях редуцирующие дисахариды не окисляются, что дает возможность отличить их от моносахаридов. Материалы и реактивы: раствор глюкозы (5%-ный ), реактив Барфеда (13,3 г ацетата меди растворяют в 200 см3 горячей воды с температурой 70 °С. Смесь фильтруют и к фильтрату добавляют 1,9 см3 ледяной уксусной кислоты). Оборудование: стеклянные палочки, пипетки, штатив с пробирками, горелка. Порядок выполнения работы: в пробирку вносят 1 см3 раствора глюкозы и 1 см3 реактива Барфеда. Смесь перемешивают и осторожно нагревают в пламени горелки до кипения. Наблюдают образование красного осадка гемиоксида меди. 2.2.1.4 Реакция Селиванова на кетозы Принцип реакции: при нагревании фруктозы или других кетоз с соляной кислотой образуется оксиметилфурфурол. Уравнение реакции для фруктозы имеет вид: Оксиметилфурфурол с резорцином образуют соединение (продукт конденсации), окрашенное в вишнёво-красный цвет. Материалы и реактивы: кристаллический резорцин, 5%-ный раствор фруктозы, 25%-ный раствор соляной кислоты. Оборудование: стеклянные палочки, пробирки, пипетки градуировочные, штатив для пробирок, баня водяная, термометр лабораторный, лопаточка или шпатель, часы. Порядок проведения работы: в пробирку помещают 5 см3 раствора фруктозы, 1 см3 раствора соляной кислоты и несколько кристаллов резорцина. Смесь нагревают на водяной бане в течение 5…10 мин при температуре 80 °С до появления вишнёво-красного цвета. 2.2.2 Качественные реакции дисахаридов Задание для выполнения: определить восстанавливающую способность лактозы и мальтозы. Определить восстанавливающую способность у сахарозы и провести гидролиз сахарозы. Редуцирующие дисахариды (например, лактоза и мальтоза) способны окисляться до соответствующих кислот, восстанавливать соли металлов, участвуя в реакциях, характерных для моносахаридов. Однако нередуцирующие дисахариды (например, сахароза) в такие реакции не вступают. Наиболее широко для обнаружения подобных дисахаридов используют методы, в основе которых лежит гидролиз дисахаридов до моносахаридов с последующим обнаружением продуктов гидролиза – моносахаридов. 2.2.2.1 Восстанавливающая способность лактозы и мальтозы Принцип реакции: благодаря наличию свободной альдегидной группы в молекуле лактозы (в остатке глюкозы) и мальтозы (у второго остатка глюкозы) эти дисахариды обладают редуцирующими свойствами и способны участвовать в реакциях восстановления, в частности, мальтоза и лактоза дают положительную реакцию Троммера. Материалы и реактивы: растворы лактозы, мальтозы, гидроксида натрия и сульфата меди (5%-ные). Оборудование: стеклянные палочки, пипетки, капельницы, штатив с пробирками, горелка. Порядок выполнения работы: в одну пробирку наливают 2 см3 раствора лактозы, а в другую – 2 см3 раствора мальтозы. В обе пробирки затем вносят по 1 см3 раствора гидроксида натрия и по 5 капель раствора сульфата меди. Пробирки осторожно нагревают в пламени горелки. Наблюдают образование красного осадка закиси меди. 2.2.2.2 Определение восстанавливающей способности у сахарозы и гидролиз сахарозы Принцип реакции: в молекуле сахарозы связь между остатками глюкозы и фруктозы образуется за счёт двух гликозидных гидроксилов. Сахароза не обладает восстановительными свойствами и дает отрицательную реакцию Троммера. После гидролиза сахарозы (кипячение в присутствии концентрированной соляной кислоты) образуются моносахариды, которые можно обнаружить с помощью реакции Троммера, а фруктозу – и по реакции Селиванова (см. п. 2.2.1.4). Материалы и реактивы: концентрированная соляная кислота, 25%-ный раствор соляной кислоты, 5%-ные растворы сахарозы, гидроксида натрия и сульфата меди, кристаллический резорцин. Оборудование: стеклянные палочки, пробирки, пипетки градуировочные, капельницы, штатив для пробирок, водяная баня, термометр лабораторный, часы. Порядок проведения работы: в две пробирки наливают по 6 см3 раствора сахарозы. В одну из них добавляют также 2 капли концентрированной соляной кислоты и нагревают на кипящей водяной бане при температуре 100 °С в течение 15 мин. Вторая пробирка содержит контрольный раствор сахарозы. Затем берут ещё две пробирки и в одну из них вносят 3 см3 нейтрализованного гидролизата сахарозы, а в другую – 3 см3 контрольного раствора сахарозы. К содержимому этих пробирок добавляют по 1 см3 раствора гидроксида натрия и по 5 капель раствора сульфата меди. Затем нагревают на водяной бане до кипения (проводят реакцию Троммера). Отмечают образование красного осадка закиси меди в пробирке, содержащей гидролизат (положительная реакция Троммера), и отсутствие такового в контрольной пробе (отрицательная реакция Троммера). С оставшимися 3 см3 гидролизата сахарозы и контрольного раствора сахарозы проводят реакцию Селиванова на обнаружение фруктозы. С этой целью в обе пробирки добавляют по 1 см3 раствора соляной кислоты и несколько кристаллов резорцина. Содержимое пробирок нагревают на водяной бане в течение 5…10 мин при температуре 2.2.3 Качественные реакции полисахаридов Задание для выполнения: провести реакцию крахмала и гликогена с йодом. Провести гидролиз крахмала и целлюлозы. Полисахариды отличаются друг от друга химической природой повторяющихся моносахаридных единиц, степенью разветвления и длиной цепи. Полисахариды не содержат свободных редуцирующих групп, поэтому они не обладают восстанавливающей способностью. Полный гидролиз полисахаридов в присутствии кислот или специфических ферментов приводит к образованию моносахаридов, обладающих редуцирующими свойствами. 2.2.3.1 Реакция крахмала и гликогена с йодом Принцип реакции: при взаимодействии крахмала и гликогена с йодом образуются комплексные адсорбционные соединения, окрашенные в реакции с крахмалом в синий цвет, а с гликогеном – в красно-бурый цвет. Различие в цвете комплексов обусловлено химической структурой крахмала и гликогена. При нагревании окраска исчезает, но появляется опять при охлаждении, что свидетельствует об образовании нестойких комплексов крахмала и гликогена с йодом. Обесцвечивание происходит также при добавлении гидроксида натрия или калия. Исчезновение окраски при нагревании и добавлении щелочи обусловлено тем, что в образовании комплексов принимает участие молекулярный йод, а не иодит-ионы. Материалы и реактивы: реактив Люголя (1 г йода и 2 г йодистого калия растворяют в 15 см3 дистиллированной воды и затем разводят водой до объёма 300 см3), 0,1%-ные растворы крахмала и гликогена, 10%-ный раствор гидроксида натрия. Оборудование: стеклянные палочки, пробирки, пипетки, капельницы, штатив для пробирок, водяная баня. Порядок проведения работы: в одну пробирку помещают 2 см3 раствора крахмала, в другую – 2 см3 раствора гликогена. Затем в обе пробирки вносят по 1…2 капли раствора Люголя. Содержимое пробирок перемешивают. Наблюдают образование синего окрашивания в пробирке с крахмалом и красно-бурого – с гликогеном. Затем из каждой пробирки по 1 см3 жидкостей переносят в две другие пробирки, куда добавляют по 1 см3 раствора гидроксида натрия. Наблюдают обесцвечивание в каждой пробирке. Смеси, оставшиеся в пробирках, где первоначально возникла окраска, нагревают на водяной бане. Наблюдают исчезновение окрашивания, которое вновь появляется при охлаждении. 2.2.3.2 Гидролиз крахмала Принцип реакции: при нагревании раствора крахмала с минеральными кислотами происходит гидролиз крахмала с образованием глюкозы, которую можно обнаружить характерными реакциями на моносахариды, в частности, реакцией Троммера. Материалы и реактивы: концентрированная соляная кислота, 1%-ный раствор крахмала, 15%-ный раствор гидроксида натрия, Оборудование: стеклянные палочки, пробирки, пипетки градуировочные, капельницы, штатив для пробирок, водяная баня, часы. Порядок проведения работы: в две пробирки помещают по 5 см3 раствора крахмала. В одну из них вносят также 2…3 капли концентрированной соляной кислоты и кипятят на водяной бане 15 мин. Вторая пробирка является контрольной. Затем в обе пробирки приливают по 2 см3 15%-ного раствора гидроксида натрия и по 5 капель раствора сульфата меди и нагревают (проделывают реакцию Троммера). В пробирке, где проводился гидролиз крахмала соляной кислотой при нагревании, наблюдают образование красного осадка гемиоксида меди (реакция Троммера положительная), а в контрольной пробирке такой осадок не образуется (реакция Троммера отрицательная). 2.2.3.3 Гидролиз целлюлозы Принцип реакции: гидролиз клетчатки минеральными кислотами проходит значительно медленнее, чем крахмала. Если же клетчатку предварительно обработать 80%-ным раствором серной кислоты, то процесс гидролиза клетчатки значительно ускоряется. Материалы и реактивы: целлюлоза или вата (источник целлюлозы), 3%-ный и 80%-ный растворы серной кислоты, реактив Фелинга и Барфеда (см. п. 2.2.1). Оборудование: стеклянные палочки, пробирки, капельницы, пипетки градуировочные, водяная баня, часы. Порядок проведения работы: небольшое количество ваты (100…200 мг) помещают в пробирку, заливают 3%-ным раствором серной кислоты и кипятят на водяной бане 10 мин. После нейтрализации содержимое пробирки разделяют на две части. В другой пробирке то же количество ваты предварительно обрабатывают небольшим количеством (примерно 0,5 см3) 80%-ного раствора серной кислоты до полного растворения, затем разбавляют водой до объёма 1 см3 и кипятят на водяной бане в течение 5 мин. После нейтрализации содержимое пробирки делят также на две части. С одной частью смесей, содержащих обработанную и необработанную вату, проводят реакцию Фелинга (добавляют по 1 см3 раствора Фелинга и после перемешивания нагревают до кипения), а с другой частью этих смесей – реакцию Барфеда (добавляют по 1 см3 раствора Барфеда и после перемешивания нагревают до кипения). В пробирках, где находилась необработанная серной кислотой вата, наблюдается отсутствие осадка красного цвета (отрицательные реакции Фелинга и Барфеда). В пробирках, содержащих предварительно обработанную вату, возникает красный осадок гемиоксида меди (положительные реакции Фелинга и Барфеда), что свидетельствует об образовании глюкозы. 2.2.4 Обсуждение результатов работы Результаты исследования оформить по типу в таблицы 6. По полученным результатам экспериментов сделать вывод о содержании углеводов в исследуемых объектах. Таблица 6 – Содержание углеводов в пищевых продуктах источники: http://himija-online.ru/imennye-reakcii/reaktiv-felinga.html http://pandia.ru/text/77/498/2286-3.php |

















 Или
Или