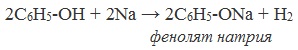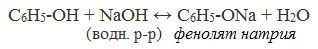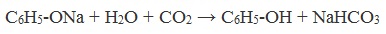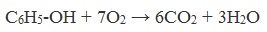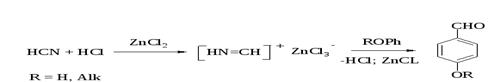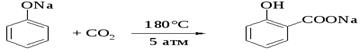Реакция фенола с азотистой кислотой уравнение
Химические свойства фенолов определяются наличием в молекуле гидроксильной группы и бензольного кольца.
I. Реакции с участием гидроксильной группы
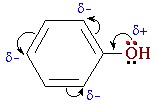
Фенолы являются более сильными кислотами, чем спирты и вода, т.к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается.
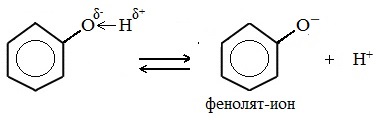
Фенолы в водных растворах диссоциируются по кислотному типу: на фенолят-ионы и ионы водорода:
Фенол диссоциирует обратимо, это слабая кислота. Однако его силы кислотных свойств достаточно, чтобы изменять окраску индикатора, имеющего в нейтральной среде фиолетовый цвет. В растворе фенола лакмус краснеет.
1) Взаимодействие с активными металлами с образованием фенолятов (сходство со спиртами)
Видеоопыт «Взаимодействие фенола с металлическим натрием»
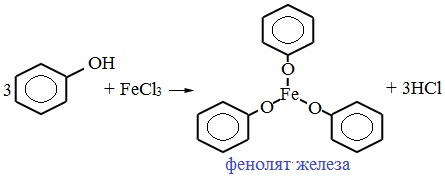
2) Взаимодействие со щелочами с образованием фенолятов (отличие от спиртов)
Видеоопыт «Взаимодействие фенола с раствором щелочи»
Образующиеся в результате реакций феноляты легко разлагаются при действии кислот. Даже такая слабая кислота, как угольная, вытесняет фенол из фенолятов. Следовательно, !Феноляты – соли слабой карболовой кислоты, разлагаются угольной кислотой:
По кислотным свойствам фенол превосходит этанол в 10 6 раз. При этом во столько же раз уступает уксусной кислоте. В отличие от карбоновых кислот, фенол не может вытеснить угольную кислоту из её солей
C6H5-OH + NaHCO3 = реакция не идёт – прекрасно растворяясь в водных растворах щелочей, он фактически не растворяется в водном растворе гидрокарбоната натрия.
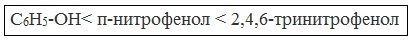
Кислотные свойства фенола усиливаются под влиянием связанных с бензольным кольцом электроноакцепторных групп (NO2 — , Br — )
2,4,6-тринитрофенол или пикриновая кислота сильнее угольной.
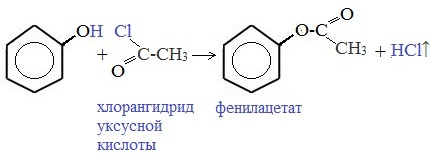
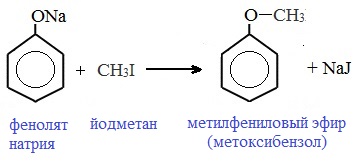
3) Образование сложных и простых эфиров
Как и спирты, фенолы могут образовывать простые и сложные эфиры. Фенолы не образуют сложные эфиры в реакциях с кислотами. Сложные эфиры образуются при взаимодействии фенола с ангидридами или хлорангидридами карбоновых кислот:
Простые эфиры образуются при взаимодействии фенолятов с алкилгалогенидами:
II . Реакции, с участием бензольного кольца
Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара- положениях (+ М -эффект ОН-группы):
Поэтому фенол значительно активнее бензола вступает в реакции электрофильного замещения в ароматическом кольце.
Реакции замещения
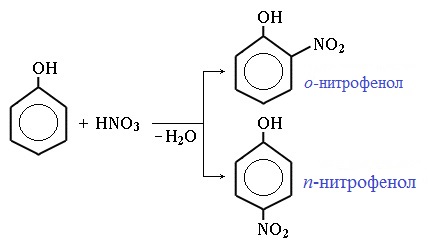
1) Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара- нитрофенолов:
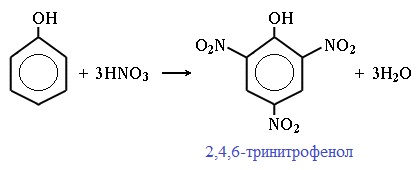
При использовании концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота):
У нее кислотные свойства выражены сильнее, чем у фенола, т.к. нитрогруппы оттягивают электронную плотность от бензольного кольца и делают связь О-Н еще более полярной.
Пикриновая кислоты является взрывчатым веществом, в чистом виде представляет собой желтые кристаллы.
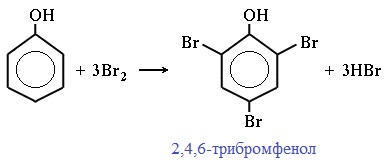
2) Галогенирование
Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола ( качественная реакция на фенол! ):
Образуется белый осадок трибромфенола.
Видеоопыт «Взаимодействие фенола с бромной водой»
3) Сульфирование
Соотношение о- и п-изомеров определяется температурой реакции: при комнатной температуре в основном образуется о-фенолсульфокислота, при t=1000С – пара-изомер: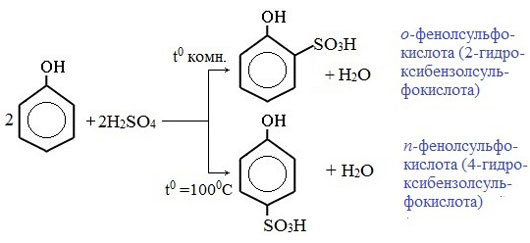
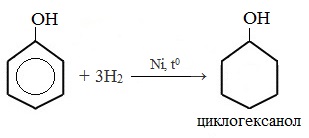
1) Гидрирование фенола
Эта реакция идет с разрушением ароматического кольца. Продукт реакции циклический одноатомный спирт — циклогексиловый спирт (циклогексанол).
2) Конденсация с альдегидами
При нагревании фенола с формальдегидом в присутствии кислотных или основных катализаторов происходит реакция поликонденсации и образуется фенолформальдегидная смола.
Данная реакция имеет большое практическое значение и используется при получении фенолформальдегидных смол.
III. Реакция окисления
Фенолы легко окисляются даже под действием кислорода воздуха. При стоянии на воздухе фенол постепенно окрашивается в розовато-красный цвет.
1) Горение (полное окисление)
Фенолы, как и большинство органических веществ, сгорают до углекислого газа и воды.
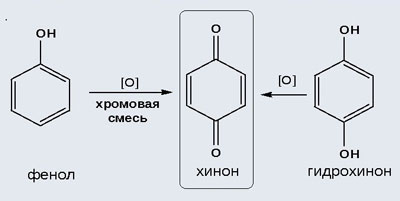
2) Окисление хромовой смесью
При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона также образуется хинон:
IV. Качественная реакция! — обнаружение фенола
Для обнаружения фенолов используется качественная реакция с хлоридом железа (III). Одноатомные фенолы дают устойчивое сине-фиолетовое окрашивание, что связано с образованием комплексных соединений железа.
Видеоопыт «Качественная реакция на фенол»
Образование фиолетового окрашивания при добавлении раствора FeCl3 служит качественной реакцией на фенол:
Для фенолов реакции по связям С-О не характерны, поскольку атом кислорода прочно связан с атомом углерода бензольного кольца за счет участия своей неподеленной электронной пары в системе сопряжения.
Химические свойства фенолов Кислотные свойства фенолов
Несмотря на то, что фенолы по строению подобны спиртам, они являются намного более сильными кислотами, чем спирты. Вместе с тем делокализация заряда в феноксид-ионе происходит в меньшей степени, чем в карбоксилат-ионе, соответственно фенолы более слабые кислоты по сравнению с карбоновыми кислотами. Фенолы растворяются в водном растворе гидроксида натрия, но они не реагируют c гидрокарбонатом натрия. Это простейший, хотя и не очень надежный тест, по которому можно различать фенолы и карбоновые кислоты, которые взаимодействуют c гидрокарбонатом натрия c выделением углекислого газа. Влияние заместителя в бензольном кольце на кислотность фенолов согласуется с представлениями об их электронных эффектах. Электронодонорные заместители понижают, a электроноакцепторные — усиливают кислотные свойства фенолов. Фенолы диссоциируют в водных растворах с образованием фенолят-ионов и ионов водорода:
В отличие от спиртов, фенолы реагируют не только с щелочными и щелочноземельными металлами, но и с растворами щелочей, образуя феноляты:
С увеличением длины углеводородного радикала скорость этой реакции замедляется. В присутствии следов влаги образующиеся алкоголяты разлагаются до исходных спиртов.
2.3 Этерификация фенолов
Ариловые эфиры карбоновых кислот получают ацилированием фенолов или их Na-, K-солей галогенангидридами или ангидридами кислот.
Реакции электрофильного замещения в ароматическом кольце
Гидроксильная группа относится к числу групп, активирующих электрофильное замещение в ароматическом кольце и направляющих заместитель в орто- и пара- положения. Активирующее влияние гидроксильной группы настолько сильно, что в отдельных случаях реакцию трудно остановить на стадии введения только одного заместителя. Фенолы вступают практически во все типичные реакции электрофильного замещения как с сильными, так и со слабыми электрофильными агентами.
Галогенирование фенолов не требует катализа кислотами Льюиса (FeCl3, FeBr3, AlCl3 и др.) и легко осуществляется под действием молекулярного галогена. Галогенирование фенола молекулярным бромом или хлором в полярной среде практически невозможно остановить на стадии моногалогенирования, поскольку реагирующей частицей здесь является фенолят-ион. Фенолят-ион содержит очень сильную активирующую группу — анион кислорода и скорость галогенирования фенолят-иона по крайней мере в тысячу раз выше, чем фенола. Галогензамещенный фенол является более сильной кислотой, чем фенол, он легче диссоциирует, что облегчает введение второго и третьего атома галогена в орто- и пара-положения.
Нитрование фенолов разбавленной 20-25%-ной азотной кислотой приводит к получению смеси орто- и пара-нитрофенолов.
Для получения 2,4,6-тринитрофенола (пикриновой кислоты) используют видоизмененный способ нитрования. Фенол первоначально сульфируют до 4-гидрокси-1,3-бензолдисульфокислоты, а затем нитруют азотной кислотой.
Вторая стадия по существу представляет собой электрофильное замещение сульфогруппы на нитрогруппу.
Для нитрования фенолов в качестве нитрующего агента кроме азотной кислоты можно использовать ацетилнитрат и N2O4, эти реагенты способствуют преимущественному нитрованию в орто-положение к гидроксильной группе.
Моносульфирование фенола серной кислотой приводит к образованию смеси орто- и пара-изомеров гидроксибензолсульфокислоты. При 20 о С в реакционной смеси содержится 49% орто-изомера и 51% пара-изомера, тогда как при 120 о С доля пара-изомера возрастает до 96%. Изменение в соотношении продуктов сульфирования обусловлено обратимостью реакций сульфирования, когда в равновесии преобладает термодинамически более стабильный пара-изомер. Сульфирование в орто-положение протекает с большей скоростью, но орто-гидроксибензолсульфокислота легко гидролизуется на исходные реагенты в отличие от пара-изомера, для которого скорость гидролиза мала.
Нитрозирование фенолов осуществляется с помощью азотистой кислоты в воде или уксусной кислоте. Эта реакция отличается очень высокой региоселективностью в пара-положение по отношению к гидроксильной группе. Типичное распределение орто- и пара-изомеров при нитрозировании можно проиллюстрировать на примере самого фенола.
Алкилирование и ацилирование по Фриделю-Крафтсу
Реакция Фриделя — Крафтса — способ алкилирования и ацилирования ароматических соединений в присутствии катализаторов кислотного характера. Так как фенолы взаимодействуют с галогенидами алюминия и другими кислотами Льюиса с образованием солей типа ArOAlCl2, прямое их алкилирование в условиях реакции Фриделя-Крафтса провести не удается. Фенолы алкилируют алкенами и спиртами в условиях кислотного катализа. В качестве катализаторов предпочитают использовать серную, фтористоводородную, фосфорную кислоты и катионообменные смолы. Таким образом, из крезола и изобутилена в промышленности получают пространственно затрудненный фенол — 2,6-ди-трет-бутил-4-метилфенол (ионол), который широко применяется для стабилизации полимеров.
Ацилирование фенолов в классических условиях реакции Фриделя-Крафтса комплексом ацилгалогенида и хлорида алюминия также приводит к неудовлетворительным результатам, так как ацилированию подвергается гидроксильная группа фенола. Более эффективна такая модификация этого метода, когда в качестве ацилирующего агента используется комплекс карбоновой кислоты и трехфтористого бора. Ацильная группа при этом вводится практически исключительно в пара-положение бензольного кольца. Так, например, фенол при взаимодействии с комплексом уксусной кислоты и BF3 дает пара-гидроксиацетофенон с 95%-ным выходом.
Формилирование — это введение формильной группы в ароматическое кольцо. Реакция Гаттермана. Попытки введения формильной группы в ароматическое кольцо фенолов, нафтолов и их простых эфиров с помощью СО и HCl (реакция Гаттермана-Коха) оказались безуспешными. Поэтому Гаттерман предложил метод введения альдегидной группы, в котором в качестве формилирующего агента использовалась смесь безводного HCN и газообразного хлористого водорода (катализатор ZnCl2). Формильная группировка вступает в пара-положение к ОН- и RO-группе фенолов или их простых эфиров.
Следует отметить, что истинная природа электрофильной частицы, принимающей участие при введении формильной группы с помощью HCN, HCl и кислоты Льюиса точно не установлена. Для того чтобы избежать применения ядовитой синильной кислоты, Р. Адамс модифицировал условия реакции, заменив ее цианидом цинка. Это позволило из цианида цинка и HCl получать непосредственно в реакционной смеси HCN и безводный хлористый цинк, играющий роль слабой кислоты Льюиса. Этот метод дает хорошие результаты при формилировании фенолов и их простых эфиров.
Конденсация фенолов с альдегидами и кетонами
Конденсация альдегидов и кетонов с фенолами идет с удалением карбонильного атома =О (в виде воды), а метиленовая группа СН2— или замещенная метиленовая группа (-СНR либо -СR2) встраивается между двумя молекулами фенола. Наиболее широко эту реакцию применяют для получения фенолоформальдегидных смол. Фенол конденсируется с ацетоном в кислой среде с образованием так называемого бисфенола А.
Оригинальный метод введения карбоксильной группы в ароматическое кольцо был открыт Г.Кольбе в 1860 году. При нагревании сухих фенолятов натрия или лития с СО2 при 150-180 о С и давлении 5 атм, образуются натриевые или литиевые соли салициловой кислоты. В аналогичных условиях из фенолятов калия, рубидия и цезия получаются только соли пара-гидроксибензойной кислоты.
Фенолы при взаимодействии с солями арендиазония в слабощелочной среде образуют арилазофенолы. Эта реакция получила название азосочетания. По своему механизму реакция азосочетания является реакцией электрофильного замещения, в которой соли арендиазония выступают в качестве электрофильных реагентов.
В 1912 году Л.Кляйзен открыл интересную и своеобразную перегруппировку аллиловых эфиров фенолов в аллилфенолы. Аллиловый эфир фенола при нагревании до 200-220 о С превращается в орто-аллилфенол, т.е. аллильная группа мигрирует в орто-положение бензольного кольца.
Если оба орто-положения заняты заместителями, то аллильная группа перемещается в пара-положение:
Окисление пространственно незатрудненных фенолов относится к числу сложных, многостадийных процессов, механизм которых мало изучен. Очевидно лишь то, что механизм окисления может сильно меняться в зависимости от природы одно- или двухэлектронного окислителя. Сам фенол при окислении двухэлектронным окислителем — бихроматом натрия или MnO2 в серной кислоте образует с удовлетворительным выходом пара-хинон.
Универсальным одноэлектронным окислителем фенолов является соль Фреми — нитрозодисульфонат калия — редкий пример стабильного неорганического нитроксильного свободного радикала, полученного впервые еще в 1845 году. Окисление фенолов солью Фреми идет в очень мягких условиях по радикальному механизму и приводит к пара-хинонам с выходами, близкими к количественному.
Самый простой и удобный способ получения орто- и пара-бензохинонов состоит в окислении соответственно пирокатехина и гидрохинона.
Нитрование фенолов
Вы будете перенаправлены на Автор24
В зависимости от концентрации азотной кислоты при нитровании фенола образуются различные производные. Нитрование фенолов по разному протекает при разных условиях реакции. Так выделяют:
- Нитрование фенолов разбавленной азотной кислотой;
- Нитрование фенолов концентрированной азотной кислотой;
- Нитрование фенолов другими нитрующими агентами;
- Замещение сульфогруппы нитрогруппой.
Нитрование фенолов разбавленной азотной кислотой
Фенол нитрируется разбавленной азотной кислотой даже при комнатной температуре. При этом образуется много побочных продуктов окисления кольца. Однако по этому методу можно получить орто-, так и пара-замещенные нитрофенолы:
Эти продукты легко разделяются вследствии меньшей растворимости о-нитрофенола и его лучшей летучести за счет внутримолекулярной водородной связи между гидроксильной и нитрогруппой:
Таким образом полученные изомеры легко разделяются перегонкой с водяным паром. При этом о-нитрофенол имеет большую летучесть (меньшую температуру кипения) вследствие образования внутримолекулярных водородных связей. Для п-изомера, в отличие от орто-, характерные межмолекулярные водородные связи с молекулами воды или между собой в зависимости от концентрации:
Готовые работы на аналогичную тему
Нитрование фенолов концентрированной азотной кислотой
При воздействии на фенол азотной кислотой средней концентрации образуется 2,4-динитрофенол. А при нитровании фенола концентрированной $HNO_3$ легко образует тринитрофенол (пикриновая кислота):
Пикриновую кислоту впервые получил П. Вульф 1771, а название ей дал Ж. Дюма.
Получение пикриновой кислоты при нитровании фенола сопровождается нежелательным окислениями и осмолениями. Поэтому в целях предотвращения таких побочных процессов сначала сульфируют фенол к образованию 4-гидрокси-1,3-бензолдисульфоновои кислоты, значительно более устойчивой к окислению при воздействии концентрированной $HNO_3$. При этом в дисульфоновой кислоте замещается не только атом водорода в о-положении, но и обе сульфогруппы и нитрогруппы (электрофильное замещение). Именно таким способом в промышленности получают пикриновую кислоту:
Нитрование фенолов другими нитрующими агентами
Для нитрования фенолов в качестве нитрующего агента кроме азотной кислоты можно использовать ацетилнитрат и $N_2O_4$, эти реагенты способствуют преимущественному нитрованию в орто-положение к гидроксильной группе.
Замещение сульфогруппы нитрогруппой
Как это показано выше — если обработать фенол последовательно серной, а затем азотной кислотой, то можно получить 2,4,6-тринитрофенол (пикратная кислота). Сначала за реакцией сульфирования образуется 4-гидроксибензол-1,3-дисульфокислота, которая нитрируется на холоде азотной кислотой в свободное opтo-положение. При повышении температуры сульфогруппы замещаются на две нитрогруппы:
Реакция, по которой сульфогруппы замещаются на нитро или другие группы, чаще всего встречается как побочный процесс. Ее механизм аналогичен электрофильному замещению протона с той разницей, что высвобождается другой катион. Лучше всего она проходит, когда в ядре присутствуют сильные орто-, пара-oриентанты, или такие группы, которые образуют относительно устойчивые молекулы. Сульфогруппа проявляет такую способность потому, что она выделяется в виде нейтральной молекулы $SO_3$, что связывается водой. Это пример так называемого шсо-замещения, когда электрофил атакует то же положение, в котором уже находится заместитель.
Обратную реакцию десульфирования — с заменой сульфогруппы на атом водорода можно осуществить нагревом аренсульфокислоты с разведенной серной кислотой при 180-200 $^\circ$С. Введение сульфогруппы можно использовать для временной блокировки определенных положений в ароматическом кольце объемным заместителем — сульфогруппой, которую затем можно заместить на другую группу ($NO_2$, $Cl$, $Br$) или атом водорода.
Первая стадия этого преобразования предусматривает сульфирование фенола. По этой реакции можно ввести только две сульфогруппы. Введение первой имеющейся в ядре гидроксильной группой направляется в паро-положение. Замещение в образовавшейся 4-фенолсульфокислоте проходит по второму положению согласно согласованной ориентацией гидроксильной и сульфогруппы, что направляет вторую сульфогруппу в пара-положение. Две сульфогруппы так дезактивируют дальнейшее замещение, что фенолдисульфокислота может быть выделена из реакционной смеси. Дальнейшее взаимодействие с азотной кислотой ведет к образованию пикратной кислоты.
Реакция, по которой сульфогруппы замещается нитро или другой группой, чаще всего встречается как побочный процесс. Ее механизм аналогичен электрофильному замещению протона с той разницей, что высвобождается другой катион. Лучше всего она проходит, когда в ядре присутствуют сильные орто-, пара-ориентанты, или такие группы, которые образуют относительно устойчивые молекулы. Сульфогруппа проявляет такую способность благодаря тому, что она выделяется в виде нейтральной молекулы $SO_3$, которая связывается водой. Это пример так называемого ипсо-замещения, когда электрофил атакует то же положение, в котором уже находится заместитель.
http://zdamsam.ru/b48347.html
http://spravochnick.ru/himiya/poluchenie_fenolov/nitrovanie_fenolov/