Реакция горения ацетилена протекает по уравнению С2Н2(г) + 2 5 О2 (г) = 2СО2(г) + Н2О(ж) Вычислите ∆G 0 298 и ∆S 0 298.
| 🎓 Заказ №: 22221 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Реакция горения ацетилена протекает по уравнению С2Н2(г) + 2 5 О2 (г) = 2СО2(г) + Н2О(ж) Вычислите ∆G 0 298 и ∆S 0 298. Объясните уменьшение энтропии в результате этой реакции.
Решение: Энергия Гиббса является функцией состояния, поэтому стандартное изменение энергии Гиббса реакции равно сумме стандартных энергий Гиббса продуктов реакции за вычетом суммы стандартных энергий Гиббса исходных веществ. При этом все суммирования производятся с учетом числа молей участвующих в реакции веществ. G Gпр Gисх G 2G298 (CO2(г) ) G298 (H2O(ж) ) G298 (C2H2(г) ) 5 2 G298 (O2(г) ) 2(394,38) (237,18) 209,20 5 2 0 1235,14 кДж Энтропия (S) также является функцией состояния, то есть её изменение (ΔS) является разностью конечного и начального состояния системы. Находим изменение энтропии данной реакции при стандартных условиях, используя табличные значения абсолютных энтропий веществ.
Научись сам решать задачи изучив химию на этой странице:
|
Услуги:
|
Готовые задачи по химии которые сегодня купили:




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Реакция горения ацетилена протекает по уравнению
Реакция горения ацетилена идет по уравнению:
C2H2(г) + 5/2O2(г) = 2CO2(г) + H2O(ж)
Вычислите ΔG°298 и ΔS°298. Объясните уменьшение энтропии в результате этой реакции.
`C_2H_»2(г)» + 5/2O_»2(г)» = 2CO_»2(г)» + H_2O_»(ж)»`
`ΔS_»298 (х.р.)»^0 = ΣS_»298 (прод.)»^0 — ΣS_»298 (исх.)»^0 = 2*213.65 + 69.94 — (200.82 + 5/2*205.03) = -216.16″ «(«Дж»)/(«моль»*»К»)`
`ΔG_»298 (х.р.)»^0 = ΣΔG_»298 (прод.)»^0 — ΣΔG_»298 (исх.)»^0 = 2*(-394.38) + (-237.19) — 209.2 = -1235.15″ кДж»`
Уменьшение количества моль газообразных веществ в ходе реакции всегда приводит к уменьшению энтропии в реакционной системе. До реакции было 3.5 моль газообразных веществ, после реакции 2 моль газообразных веществ.
Примеры решения задач. При решении задач этого раздела следует пользоваться табл
При решении задач этого раздела следует пользоваться табл. I приложения Б.
Пример 3.1.Вычислить тепловой эффект и написать термохимическое уравнение реакции горения ацетилена, в результате которой образуются пары воды и диоксид углерода. Сколько теплоты выделится при сгорании 10 л ацетилена (н.у.)?
Решение. Реакция горения ацетилена протекает по уравнению
Пользуясь следствием из закона Гесса и справочными данными из табл.I, вычисляем тепловой эффект реакции:
DH 0 х.р. = (2 


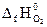
DH 0 х.р. = [2(-393,5) + (-241,8)] − (226,8 + 5½ ∙ 0) = -1255,6 кДж.
Термохимическими называются уравнения химических реакций, в которых указано изменение энтальпии. Изменение энтальпии (тепловой эффект) записывают в правой части уравнения после запятой.
Термохимическое уравнение реакции горения ацетилена имеет вид:
Тепловой эффект обычно относят к одному молю вещества. Следовательно, при сжигании 1 моль С2Н2 выделяется 1255,6 кДж. Однако по условию задачи сжигается 10 л ацетилена, что составляет 10 / 22,4 = 0,446 моль С2Н2, где 22,4 л/моль – мольный объем любого газа при нормальных условиях. Таким образом, при сгорании 0,446 моль (10 л) С2Н2 выделится 0,446×(1255,6) = 560 кДж теплоты.
Пример 3.2. Реакция идет по уравнению Fe2O3 + 2Al = 2Fe + Al2O3.
При восстановлении 48 г Fe2O3 выделяется 256,1 кДж теплоты. Вычислить тепловой эффект реакции и стандартную энтальпию образования Fe2O3.
Решение.Число молей Fe2O3, содержащихся в 48 г Fe2O3, составляет 48 / 160 = 0,3 моль, где 160 г/моль – молярная масса Fe2O3. Так как тепловой эффект относят к 1 моль вещества, то тепловой эффект данной реакции равен –256,1 / 0,3 = –853,7 кДж. Запишем термохимическое уравнение этой реакции:
Формула для расчета теплового эффекта данной реакции имеет вид
DH 0 х.р.= (2 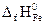

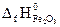
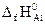
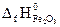
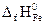

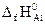

После подстановки справочных данных из табл.I получаем:
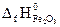
http://gomolog.ru/reshebniki/1-kurs/shimanovich-2014/104.html
http://helpiks.org/5-20585.html

