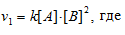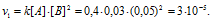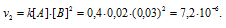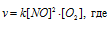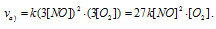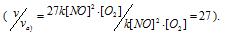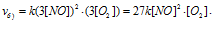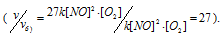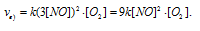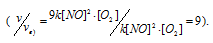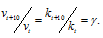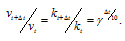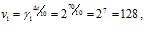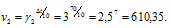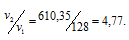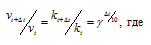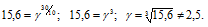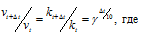Реакция протекает по уравнению А+В = 2С. Начальная концентрация вещества А равна 0,22 моль/л, а через 10 сек -0,215 моль/л. Вычислите среднюю
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,300
- гуманитарные 33,630
- юридические 17,900
- школьный раздел 607,261
- разное 16,836
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Расчеты изменения скорости реакции
Задача 331.
Реакция между веществами А и В выражается уравнением: А + 2В → С. Начальные концентрации составляют: [А]0 = 0,03 моль/л, [В]0 = 0,05 моль/л. Константа скорости реакции равна 0,4. Найти начальную скорость реакции и скорость реакции по истечении некоторого времени, когда концентрация вещества А уменьшится на 0,01 моль/л.
Решение:
До изменения концентрации скорость реакции можно выразить уравнением:
v — скорость реакции, k — константа скорости реакции, [А] и [В] – концентрации исходных веществ.
Для нахождения скорости реакции по истечении некоторого времени учтём, что на образование 1 моля вещества С затрачивается 1 моль вещества А и 2 моля вещества В, поэтому при уменьшении концентрации вещества А на 0,01 моль/л, концентрация вещества В уменьшится соответственно на 0,02 моль/л (2 . 0.01 = 0,02). Тогда оставшиеся концентрации веществ будут равны [A]ост. = 0.03 – 0,01 = 0,02 моль/л, [B]ост. = 0,05 – 0,02 = 0,03моль/л. Тогда скорость реакции по истечении некоторого времени будет составлять:
Ответ: v1 = 3 . 10 -5 ; v2 = 7,2 . 10 -6 .
Задача 332.
Как изменится скорость реакции 2NO (г.) + O2 (г.) → 2NO2 (г.), если: а) увеличить давление в системе в 3 раза; б) уменьшить объем системы в 3 раза; в) повысить концентрацию в 3 раза?
Решение:
До изменения объёма, давления и концентрации скорость реакции можно выразить уравнением:
а) Вследствие увеличения давления в системе в 3 раза, соответственно концентрация каждого из реагирующих веществ возрастёт в 3 раза. Следовательно, теперь скорость реакции будет равна:
Тогда, сравнивая выражения v и vа) , находим, что скорость реакции возрастает в 27 раз
б) при уменьшении объёма в 3 раза в системе концентрация каждого из реагирующих веществ возрастёт в 3 раза. Следовательно, теперь скорость реакции будет равна:
Тогда, сравнивая выражения v и vб), находим, что скорость реакции возрастает в 27 раз
в) При увеличении концентрации NO в 3 раза скорость реакции будет равна:
Cравнивая выражения v и vв), находим, что скорость реакции возрастает в 9 раз
Ответ: а) возрастёт в 27 раз; б) возрастёт в 27 раз; в) возрастёт в 9 раз.
Задача 333.
Две реакции протекают при 25 °С с одинаковой скоростью. Температурный коэффициент скорости первой реакции равен 2,0, а второй 2,5. Найти отношение скоростей этих реакций при 95°С.
Решение:
Зависимость скорости реакции (или константы скорости реакции) от температуры может быть выражена уравнением:
Здесь vt и kt — скорость и константа скорости реакции при температуре t °С; v(t + 10) и k(t + 10) те же величины при температуре (t + 10 °С); 
Поскольку 
Скорость второй реакции равна:
Найдём отношение этих скоростей:
Ответ:
Задача 334.
Чему равен температурный коэффициент скорости реакции, если при увеличении температуры на 30 градусов скорость реакции возрастает в 15,6 раза?
Решение:
Согласно правилу Вант Гоффа зависимость скорости реакции от температуры выражается уравнением:
vt и kt — скорость и константа скорости реакции при температуре t °С; v(t + 10) и k(t + 10) те же величины при температуре (t + 10 °С); 

Ответ: 2,5.
Задача 335.
Температурный коэффициент скорости некоторой реакции равен 2,3. Во сколько раз увеличится скорость этой реакции, если повысить температуру на 25 градусов?
Решение:
Согласно правилу Вант Гоффа зависимость скорости реакции от температуры выражается уравнением:
vt и kt — скорость и константа скорости реакции при температуре t °С; v(t + 10) и k(t + 10) те же величины при температуре (t + 10 °С); 

1) Реакция между веществами А и В выражается уравнением 2А + В 2C Начальная концентрация вещества А равна 0
1) Реакция между веществами А и В выражается уравнением
2А + В 2C
Начальная концентрация вещества А равна 0,3 моль*л-1
а вещества В – 0,5 моль*л-1. Константа скорости реакции равна
0,8 л2/моль2*мин
Рассчитайте начальную скорость прямой реакции и скорость по истечении некоторого времени, когда концентрация вещества А уменьшится на 0,1 моль
Выражение для скорости прямой реакции:
υ = k*[A]2*[В]
рассчитаем начальную скорость
υнач = 0,8 ∙ 0,32 ∙ 0,5 = 0,036 моль ∙ л-1 ∙ мин-1
После истечения некоторого времени концентрация вещества [А] уменьшилась на 0,1 и стала равна
[А]кон = [А]нач – [А]израсх
[А]кон = 0,3-0,1 = 0,2 моль/л
Определим конечную концентрацию вещества В.
По реакции на 2 моль вещества расходуется 1 моль вещества В
Значит если израсходовалось 0,1 моль вещества А, то вещества В израсходуется 0,05 моль
И тогда
[В]кон = [В]нач – [В]израсх
[В]кон = 0,5 – 0,05 = 0,45 моль/л
Рассчитаем скорость реакции при конечных концентрациях
υкон = 0,8 ∙ 0,22 ∙ 0,45 = 0,0144 моль ∙ л-1 ∙ мин-1
Часть выполненной работы
Пользуясь первым следствием из закона Гесса тепловой эффект реакции (∆Н0) вычисляется по теплотам образования реагирующих и образовавшихся веществ.
∆H0298 = ni ∆H0обр (продуктов реакции ) – ni ∆H0обр (исходных веществ)
∆H0298 = ∆H0(MeO) + ∆H0(CO2) – ∆H0(MeCO3)
Так же рассчитывается и ∆S0298
∆S0298 = ∆S0(MeO) + ∆S0(CO2) – ∆S0(MeCO3)
Используя уравнение Гиббса-Гельмгольца, находим изменение энергии Гиббса:
G=H0-TS
Выпишем стандартные значения энтропий и энтальпий
MgCO3 MgO
BaCO3 BaO
CaCO3 CaO
CO2
H0
кДж/моль -1113,0 -601,2 -1210,8 -548,1 -1206,0 -635,1 -393,5
S0
Дж/моль*К
65,7 26,9 112,1 72,0 92,3 29,7 +214,0
МgСОз(т)= МgО(т) + СО2(г)
∆H0298 = (-601,2) + (-393,5) – (-1113) = 118,3 кДж…
http://buzani.ru/zadachi/khimiya-glinka/1138
http://uchimatchast.ru/reshenie-zadach/1-reakcziya-mezhdu-veshhestvami-a-i-v-vyrazhaetsya-uravneniem-2a-v-2cnachalnaya-konczentracziya-veshhestva-a-ravna-0/