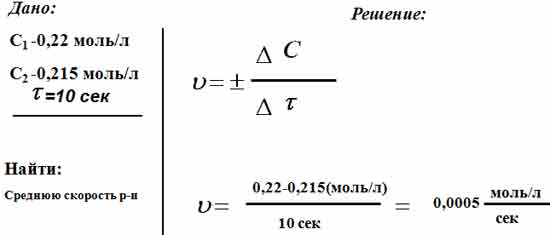
Реакция протекает по уравнению А+В = 2С. Начальная концентрация вещества А равна 0,22 моль/л, а через 10 сек -0,215 моль/л. Вычислите среднюю
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,298
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,232
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Определение константы равновесия реакции химической реакции
Задача 62.
Реакция идет по уравнению: А + 2В = С + D. К моменту равновесия прореагировало 25% вещества В. Чему равна константа равновесия, если исходные концентрации (моль/л) веществ А = 6,0;В = 8,0?
Решение:
Согласно условию, прореагировало 25% вещества (В). Это составило 8,0 . 0,25 = 2,0 моль. Исходя из стехиометрических коэффициентов, расходование 2,0 молей идет на получение по 1,0 молей веществ (С) и (D). Столько же израсходовано вещества (А). Если начальные концентрации веществ (А) и (В) 6,0 и 8,0 моль/л) соответственно, то равновесная их концентрация составила:
вещества (А) – 6 — 1,0 = 5,0 моль/л;
вещества (В) – 8 — 2,0 = 6,0 моль/л.
Выражение константы равновесия данной реакции имеет вид:
К = [С][D]/[А][В] 2 = [1,0][1,0]/[5,0][6,0] 2 = (1 . 1)/[5 . (6) 2 ] = 5,56 . 10 -3 моль/л.
Задача 63.
Составьте выражение для константы равновесия реакции,протекающей в закрытой системе (T=const):
2NH3(г) + 3Cl2(г) ⇆ N2(г) + 6НСl(г)
Укажите в сторону какой реакции сместится равновесие рреакции при следующий изменениях:
а) концентрация HCl уменьшена в 3 раз;
б) концентрация Сl2 увеличина в 3 раза;
в) концентрация NH3 и N2 увеличина в 2 раза.
Решение:
Запишем выражение для константы равновесия реакции, получим:
а) концентрация HCl уменьшена в 3 раза — при уменьшении концентрации одного из продуктов, (НСl) , равновесие смещается в сторону его образования, т.е. в сторону прямой реакции;
б) концентрация Сl2 увеличена в 3 раза — при увеличении концентрации одного из исходных веществ, (Сl2) , равновесие смещается в сторону его разрушения и образования продуктов, т.е. в сторону прямой реакции;
в) концентрация NH3 и N2 увеличена в 2 раза — так как одновременно изменены концентрации исходного вещества и продукта реакции, подставим в выражение для Кр:
Для уменьшения влияния этого воздействия равновесие в системе сместится в сторону образования продуктов, т.е. в сторону прямой реакции.
Задача 64.
Реакция образования фосгена протекает в закрытом сосуде по уравнению СО (г) + Cl2 (г) ⇔ СОCl2 (г). Исходные концентрации веществ равны (моль/л): [CO] = [Cl2] = 0,002 моль/л. Определите концентрации всех трех веществ и константу равновесия, зная, что в реакцию вступило 50 % СО.
Решение:
CO + Cl2 ⇔ COCl2
равновесные концентрации [CO] = 0.002 . 0,5 = 0,001 . [Cl2] = 0,002 . 0,5 = 0,001 моль/л.
Определим константу равновесия реакции, получим:
Kp = [COCl2]/([CO] . [Cl2]) = 0,001/(0,001 . 0,001) = 100.
Реакция протекает по уравнению А+В = 2С. Начальная концентрация вещества А равна 0,22 моль/л, а через 10 сек -0,215 моль/л. Вычислите среднюю скорость реакции
Из курса химии вам встретится задание такого содержания:
Реакция протекает по уравнению А+В = 2С. Начальная концентрация вещества А равна 0,22 моль/л, а через 10 сек -0,215 моль/л. Вычислите среднюю скорость реакции
Так выглядит правильное решение этой задачи:
Нам дано уравнение, согласно которому протекает реакция: А+В = 2С. По условии задачи, в начале реакции концентрация вещества A была равна 0,22 моль/л, но уже через 10 секунд она стала составлять -0,215 моль/литр. Нужно узнать скорость реакции. Для этого узнаем разницу концентрации вещества в начале реакции и в конце, а дальше разделим на указанное нам время. В итоге получим, что средняя скорость реакции составляет 0,0005 моль/л/секунд. Это и будет являться правильным ответом на вопрос.
http://buzani.ru/zadachi/obshchaya-khimiya/1596-konstanta-ravnovesiya-equilibrium-constant-reaktsii-zadachi-62-63
http://snorovka.com/himiya/1825