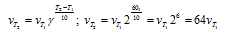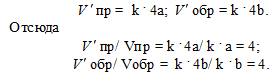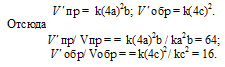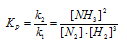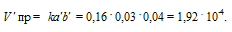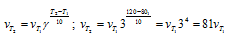Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e1aecd3f88f1490 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Вычисление концентрации веществ и скорости реакции
Скорость реакции
Задание 127.
Как изменится скорость реакции, протекающей в газовой фазе, при повышении температуры на 60 °С, если температурный коэффициент скорости данной реакции 2?
Решение:
Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле:
Следовательно, скорость реакции 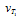
Задание 121.
Окисление серы и ее диоксида протекает по уравнениям:
а) S (к) + O2 = SO2 (г); б) 2SO2 (г) + O2 = 2SO3 (г).
Как изменится скорость этих реакций, если объемы каждой из систем уменьшить в четыре раза?
Решение:
а) S (к) + O2 = SO2 (г)
Обозначим концентрации газообразных реагирующих веществ: [O2] = a, [SO2] = b. Согласно закону действующих масс, скорости прямой и обратной реакций до изменения объёма соответственно равны:
Vпр = k . a; Vобр = k . b.
После уменьшения объёма гетерогенной системы в четыре раза концентрация газообразных веществ увеличится в четыре раза: [O2] = 4a, [SO2] = 4b. При новых концентрациях скорости прямой и обратной реакций будут равны
Следовательно, после уменьшения объёма в системе скорости прямой и обратной реакций увеличились в четыре раза. Равновесие системы не сместилось.
Обозначим концентрации реагирующих веществ: [O2] = a, [SO2] = b, [SO3] = с. Согласно закону действующих масс, скорости прямой и обратной реакций до изменения объёма соответственно равны:
Vпр = ka 2 b; Vо б р = kc 2 .
После уменьшения объёма гомогенной системы в четыре раза концентрация реагирующих веществ увеличится в четыре раза: [O2] = 4a, [SO2] = 4b, [SO3] = 4с При новых концентрациях скорости прямой и обратной реакций будут равны:
Следовательно, после уменьшения объёма в системе скорость прямой реакции возросла в 64 раза, а обратной – в 16. Равновесие системы при этом сместилось вправо, в строну уменьшения образования газообразных веществ.
Константы равновесия гомогенной системы
Задание 122.
Напишите выражение для константы равновесия гомогенной системы:
N2 + ЗН2 = 2NH3. Как изменится скорость прямой реакции образования аммиака, если увеличить концентрацию водорода в три раза?
Решение:
Уравнение реакции:
Выражение константы равновесия данной реакции имеет вид:
Обозначим концентрации газообразных реагирующих веществ: [N2] = a, [H2] = b. Согласно закону действующих масс, скорость прямой реакций до увеличения концентрации водорода равна: Vпр = kab 3 . После увеличения концентрации водорода в три раза концентрации исходных веществ будут равны: [N2] = a, [H2] = 3b. При новых концентрациях скорости прямой реакций будет равна:
Следовательно, после увеличения концентрации водорода в три раза скорость реакции возросла в 27 раз. Равновесие, согласно принципу Ле Шателье, сместилось в сторону уменьшения концентрации водорода, т. е. вправо.
Задание 123.
Реакция идет по уравнению N2 + O2 = 2NO. Концентрации исходных веществ до начала реакции были [N2] = 0,049 моль/л, [O2] = 0,01 моль/л. Вычислите концентрацию этих веществ, когда [NO] = 0,005 моль/л. Ответ: [N2] 0,0465 моль/л; [O2] = 0,0075 моль/л.
Решение:
Уравнение реакции имеет вид:
Из уравнения реакции следует, что на образование 2 моль NO расходуется по 1 моль N2 и О2, т. е. на образование NO требуется в два раза меньше N2 и О2. Исходя из сказанного, можно предположить, что на образование 0,005 моль NO затрачивается по 0,0025 моль N2 и О2. Тогда конечные концентрации исходных веществ будут равны:
[N2]конечн. = [N2]исх. – 0,0025 = 0,049 – 0,0025 = 0,0465 моль/л;
[O2]конечн. = [O2]исх. — 0,0025 = 0,01 – 0,0025 = 0,0075 моль/л.
Ответ: [N2]конечн. = 0,0465 моль/л; [O2]конечн. = 0,0075 моль/л.
Задание 124.
Реакция идет по уравнению N2 + ЗН2 = 2NH3. Концентрации участвующих в ней веществ (моль/л): [N2] = 0,80; [H2] = 1,5; [NH3] = 0,10. Вычислите концентрацию водорода и аммиака [N2] = 0,5 моль/л. Ответ: [NH3] = 0,70 моль/л; [Н2) = =0,60 моль/л.
Решение:
Уравнение реакции имеет вид:
Из уравнения следует, что из 1 моль N2 Образуется 2 моль NH3 и расходуется 3 моль Н2. Таким образом, при участии в реакции определённого количества азота образуется в два раза большее количество аммиака и прореагирует в три раза больше водорода. Рассчитаем количество азота, которое прореагировало: 0,80 – 0,50 = 0,30 моль. Рассчитаем количество аммиака, которое образовалось: 0,3 . 2 = 0,6 моль. Рассчитаем количество прореагировавшего водорода: 0,3 . 3 = 0,9 моль. Теперь рассчитаем конечные концентрации реагирующих веществ:
[NH3]конечн. = 0,10 + 0,60 = 0,70 моль;
[Н2]конечн. = 1,5 — 0,90 = 0,60 моль;
[N2]конечн. = 0,80 — 0,50 = 0,30 моль.
Ответ: [NH3] = 0,70 моль/л; [Н2) = =0,60 моль/л.
Скорость, температурный коэффициент скорости реакции
Задание 125.
Реакция идет по уравнению Н2 + I2 = 2НI. Константа скорости этой реакции при некоторой температуре равна 0,16. Исходные концентрации реагирующих веществ (моль/л): [Н2] = 0,04:
[I2] = 0,05. Вsчислите начальную скорость реакции и ее скорость при [H2] = 0,03 моль/л. Ответ: 3,2 . 10 -4 , 1,92 . 10 -4
Решение:
Уравнение реакции имеет вид:
При исходных концентрациях реагирующих веществ, согласно закону действующих масс, скорость реакции будет равна при обозначении концентраций исходных веществ: [Н2] = a, [I2] = b.
Vпр = kab = 0,16 . 0,04 . 0,05 = 3,2 . 10 -4 .
Рассчитаем количество водорода, которое вступило в реакцию, если концентрация его изменилась и стала 0,03 моль/л, получим: 0,04 — 0,03 = 0,01 моль. Из уравнения реакции следует, что водород и йод реагируют друг с другом в отношении 1 : 1, значит в реакцию вступило тоже 0,01 моль йода. Отсюда, конечная концентрация йода равна: 0,05 -0,01 = 0,04 моль. При новых концентрациях скорость прямой реакции будет равна:
Ответ: 3,2 . 10 -4 , 1,92 . 10 -4 .
Задание 126.
Вычислите, во сколько раз уменьшится скорость реакции, протекающей в газовой фазе, если понизить температуру от 120 до 80 °С. Температурный коэффициент скорости реакции З.
Решение:
Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле:
Следовательно, скорость реакции 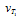
Реакция идёт по уравнению :H2 + Cl2 = 2HClкак измениться скорость прямой и обратной реакции , если увеличить давление в 3 раза?
Реакция идёт по уравнению :
как измениться скорость прямой и обратной реакции , если увеличить давление в 3 раза?
Пройдёт ли смещение равновесия?
Равновесие никак не изменится, смещение не произойдет, потому, парциальное давление в системе одинаковое
1(H2) + 1(Cl2) = 2(HCl)
Е. сумма коэфициентов слева и справа равно.
А для изменения равновесия по средствелством давления необходимо по правилу :
При изменении давления равновесие сместится туда, где объем газа наименьший.
У нас в системе, он одинаковый с обеих сторон.
Как изменится скорость реакции, если увеличить давление системы в 2 раза, в 4 раза?
Как изменится скорость реакции, если увеличить давление системы в 2 раза, в 4 раза?
Помогите, голова почти лопнула?
Помогите, голова почти лопнула!
Химическая реакция протекает по уравнению А + 2В = С.
Как изменится скорость прямой и обратной реакции, если объем реакционной смеси уменьшить в 2 раза?
В каком направлении сместится равновесие системы : WO2 + Cl2 = WO2Cl2, а также рассчитайте как изменятся скорости прямой и обратной реакции, если а) увеличить концентрацию Cl2 в 2 раза б) уменьшить ко?
В каком направлении сместится равновесие системы : WO2 + Cl2 = WO2Cl2, а также рассчитайте как изменятся скорости прямой и обратной реакции, если а) увеличить концентрацию Cl2 в 2 раза б) уменьшить концентрацию WO2Cl2 в 3 раза в) увеличить давление в системе в 2 раза.
Как изменится скорость реакции H2 + I2→2HI , если увеличить давление в системе в 2 раза?
Как изменится скорость реакции H2 + I2→2HI , если увеличить давление в системе в 2 раза?
В каком направлении произойдет смещение равновесия системы Н2 + S H2S , если : а) увеличить концентрацию водорода ; б) понизить концентрацию серово — дорода?
В каком направлении произойдет смещение равновесия системы Н2 + S H2S , если : а) увеличить концентрацию водорода ; б) понизить концентрацию серово — дорода?
Cоставьте выражения скорости прямой и обратной реакций.
Как изменится скорость прямой и обратной реакции Cк + H2O(г) = CO + H2 протекающей в закрытом сосуде, если увеличить давление в 4 раза?
Как изменится скорость прямой и обратной реакции Cк + H2O(г) = CO + H2 протекающей в закрытом сосуде, если увеличить давление в 4 раза.
В каком направлении сместится равновесие?
В реакции 2NO + O2 = 2NO2 уменьшили давление в 2 раза?
В реакции 2NO + O2 = 2NO2 уменьшили давление в 2 раза.
Как изменится скорость прямой реакции?
Во сколько раз изменится скорость прямой реакции, если повысить давление в системе в 2раза?
Во сколько раз изменится скорость прямой реакции, если повысить давление в системе в 2раза?
Куда при этом сместится равновесие в обратимой реакции?
2NO(г) + O2(г) = 2NO2(г).
Каким законом выражается зависимость скорости реакции от концентрации реагирующих веществ?
Каким законом выражается зависимость скорости реакции от концентрации реагирующих веществ?
Рассчитайте, как измениться скорость прямой реакции, протекающей по уравнению 2SO2 + O2 — — 2SO3?
Если увеличить давление в 2 раза?
Охарактеризуйте реакцию по тепловому эффекту?
Охарактеризуйте реакцию по тепловому эффекту.
Напишите уравнения для скорости прямой и обратной реакции, выражение для константы равновесия.
Укажите влияние температуры, концентрации исходных веществ и продуктов реакции, давления на смещение химического равновесия.
CS2(г) + O2(г) ⇆ CO2(г) + SO2(г) + Q.
Вы открыли страницу вопроса Реакция идёт по уравнению :H2 + Cl2 = 2HClкак измениться скорость прямой и обратной реакции , если увеличить давление в 3 раза?. Он относится к категории Химия. Уровень сложности вопроса – для учащихся студенческий. Удобный и простой интерфейс сайта поможет найти максимально исчерпывающие ответы по интересующей теме. Чтобы получить наиболее развернутый ответ, можно просмотреть другие, похожие вопросы в категории Химия, воспользовавшись поисковой системой, или ознакомиться с ответами других пользователей. Для расширения границ поиска создайте новый вопрос, используя ключевые слова. Введите его в строку, нажав кнопку вверху.
http://buzani.ru/zadachi/khimiya-shimanovich/918-skorost-khimicheskoj-reaktsii-zadacha-121-127
http://himia.my-dict.ru/q/8625367_reakcia-idet-po-uravneniu-h2-cl2/