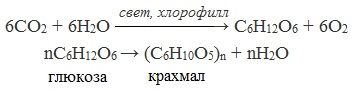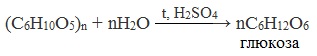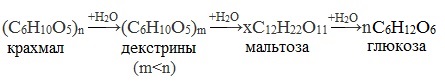Реакция крахмала с амилазой уравнение
Крахмал – ценный питательный продукт. Он входит в состав хлеба, картофеля, круп и наряду с сахарозой является важнейшим источником углеводов в человеческом организме.
Химическая формула крахмала (С6(Н2О)5) n .
Строение крахмала
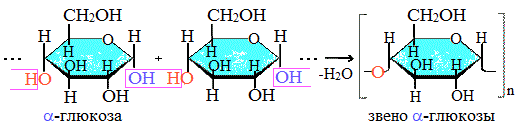
Крахмал состоит из 2 полисахаридов, построенных из остатков циклической a-глюкозы.
Как видно, соединение молекул глюкозы происходит с участием наиболее реакционноспособных гидроксильных групп, а исчезновение последних исключает возможность образования альдегидных групп, и они в молекуле крахмала отсутствуют. Поэтому крахмал не дает реакцию «серебряного зеркала».
Крахмал состоит не только из линейных молекул, но и из молекул разветвленной структуры. Этим объясняется зернистое строение крахмала.
В состав крахмала входят:
- амилоза (внутренняя часть крахмального зерна) — 10-20%;
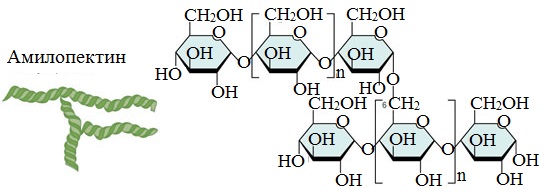
- амилопектин (оболочка крахмального зерна) — 80-90%.
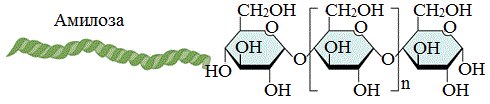
Амилоза
Амилоза растворима в воде и представляет собой линейный полимер, в котором остатки α–глюкозы связаны друг с другом через первый и четвертый атомы углерода (α-1,4-гликозидными связями).
Цепь амилозы включает 200 — 1000 остатков a-глюкозы (средняя мол. масса 160 000) .
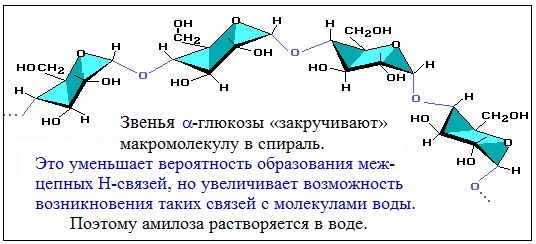
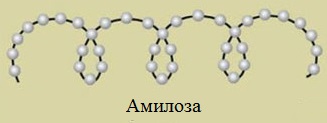
Макромолекула амилозы представляет собой спираль, каждый виток которой состоит из 6 звеньев a-глюкозы.
Амилопектин
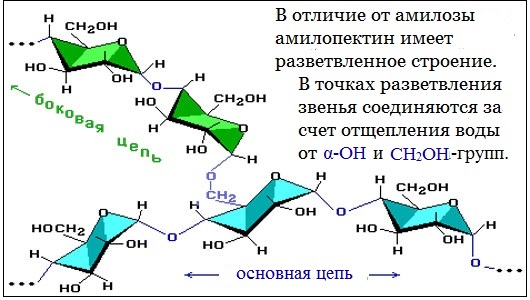
В отличие от амилозы, амилопектин не растворим в воде, и имеет разветвленное строение.
Подавляющее большинство глюкозных остатков в амилопектине связаны, как и в амилозе α-1,4-гликозидными связями. Однако в точках разветвлений цепи имеются α-1,6-гликозидные связи.
Молекулярная масса амилопектина достигает 1-6 млн.
Молекулы амилопектина также довольно компактны, так как имеют сферическую форму.
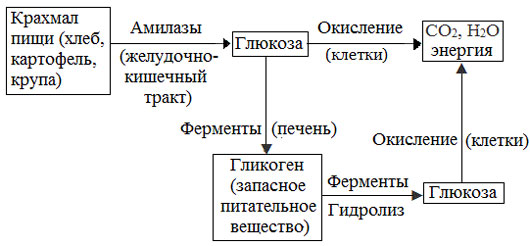
Биологическая роль крахмала. Гликоген
Крахмал – главное запасное питательное вещество растений, основной источник резервной энергии в растительных клетках.
Остатки глюкозы в молекулах крахмала соединены достаточно прочно и в то же время под действием ферментов легко могут отщепляться, как только возникает потребность в источнике энергии.
Амилоза и амилопектин гидролизуются под действием кислот или ферментов до глюкозы, которая служит непосредственным источником энергии для клеточных реакций, входит в состав крови и тканей, участвует в обменных процессах.
Гликоген (животный крахмал) – полисахарид, молекулы которого построены из большого числа остатков α–глюкозы. Он имеет сходное строение с амилопектином, но отличается от него большей разветвленностью цепей, а также большей молекулярной массой.
Содержится гликоген главным образом в печени и в мышцах.
Гликоген – белый аморфный порошок, хорошо растворяется даже в холодной воде, легко гидролизуется под действием кислот и ферментов, образуя в качестве промежуточных веществ декстрины, мальтозу и при полном гидролизе – глюкозу.
Превращение крахмала в организме человека и животных
Нахождение в природе
Крахмал широко распространен в природе. Он образуется в растениях в процессе фотосинтезе и накапливается в клубнях, корнях, семенах, а также в листьях и стеблях.
Крахмал содержится в растениях в виде крахмальных зерен. Наиболее богато крахмалом зерно злаков: риса (до 80%), пшеницы (до 70%), кукурузы (до 72%), а также клубни картофеля (до 25%). В клубнях картофеля крахмальные зерна плавают в клеточном соке, в злаках они плотно склеены белковым веществом клейковиной.
Физические свойства
Крахмал – белое аморфное вещество, без вкуса и запаха, нерастворимое в холодной воде, в горячей воде набухает и частично растворяется, образуя вязкий коллоидный раствор (крахмальный клейстер).
Крахмал существует в двух формах: амилоза – линейный полимер, растворимый в горячей воде, амилопектин – разветвлённый полимер, не растворимый в воде, лишь набухает.
Химические свойства крахмала
Химические свойства крахмала объясняются его строением.
Крахмал не дает реакцию «серебряного зеркала», однако ее дают продукты его гидролиза.
1. Гидролиз крахмала
При нагревании в кислой среде крахмал гидролизуется с разрывом связей между остатками α-глюкозы. При этом образуется ряд промежуточных продуктов, в частности мальтоза. Конечным продуктом гидролиза является глюкоза:
Процесс гидролиза протекает ступенчато, схематически его можно изобразить так:
Видеоопыт «Кислотный гидролиз крахмала»
Реакцию превращения крахмала в глюкозу при каталитическом действии серной кислоты открыл в 1811 г. русский ученый К.Кирхгоф (реакция Кирхгофа).
2. Качественная реакция на крахмал
Так как молекула амилозы представляет собой спираль, то при взаимодействии амилозы с йодом в водном растворе молекулы йода входят во внутренний канал спирали, образуя так называемое соединение включения.
Раствор иода окрашивает крахмал в синий цвет. При нагревании окрашивание исчезает (комплекс разрушается), при охлаждении появляется вновь.
Крахмал + J2 – синее окрашивание
Видеоопыт «Реакция крахмала с йодом»
Данная реакция используется в аналитических целях для обнаружения, как крахмала, так и йода (йодкрахмальная проба)
3. Большинство глюкозных остатков в молекулах крахмала имеют по 3 свободных гидроксила (у 2,3,6-го атомов углерода), в точках разветвления – у 2-го и 3-го атомов углерода.
Следовательно, для крахмала возможны реакции, характерные для многоатомных спиртов, в частности образование простых и сложных эфиров. Однако эфиры крахмала большого практического значения не имеют.
Качественную реакцию на многоатомные спирты крахмал не дает, так как плохо растворяется в воде.
Получение крахмала
Из растений извлекают крахмал, разрушая клетки и отмывая его водой. В промышленном масштабе его получают главным образом из клубней картофеля (в виде картофельной муки), а также кукурузы, в меньшей степени – из риса, пшеницы и других растений.
Получение крахмала из картофеля
Картофель моют, измельчают и промывают водой и перекачивают в большие сосуды, где происходит отстаивание. Вода извлекает из измельченного сырья крахмальные зерна, образуя так называемое «крахмальное молоко».
Полученный крахмал ещё раз промывают водой, отстаивают и сушат в струе теплого воздуха.
Получение крахмала из кукурузы
Зерна кукурузы замачивают в теплой воде разбавленной сернистой кислоты с целью размягчения зерна и удаления из него основной части растворимых веществ.
Набухшее зерно дробят для удаления ростков.
Ростки, после всплывания на поверхность воды, отделяют и используют в дальнейшем для получения кукурузного масла.
Кукурузную массу повторно измельчают, обрабатывают водой для вымывания крахмала, затем отделяют отстаиванием или с помощью центрифуги.
Применение крахмала
Крахмал широко применяется в различных отраслях промышленности (пищевой, фармацевтической, текстильной, бумажной и т.п.).
Он является основным углеводом пищи человека – хлеба, круп, картофеля.
В значительных количествах перерабатывается на декстрины, патоку и глюкозу, используемые в кондитерском производстве.
Из крахмала, содержащегося в картофеле и зерне злаков, получают этиловый, н-бутиловый спирты, ацетон, лимонную кислоту, глицерин.
Крахмал используется как клеящее средство, применяется для отделки тканей, крахмаления белья.
В медицине на основе крахмала готовятся мази, присыпки и т.д.
Несложный опыт с амилазой, слюной и крахмалом
Продолжаю «йодную» тематику. Уже рассказала про спиртовой раствор йода, про то, как правильно писать – йод или иод, а сегодня хочу предложить немного отдохнуть от теории и сделать небольшой и несложный опыт, в которой йод принимает самое непосредственное участие.
Небольшое вступление
И все равно не обойтись без небольшой теории. Коротко расскажу основные моменты, чтобы было понятно, о чем пойдет речь дальше и для чего вообще нужен опыт.
Опыт, который я предлагаю сделать, показывает, как фермент слюны амилаза инициирует расщепление крахмала и прочих полисахаридов.
Помню, еще в школе на уроках биологии наша незабвенная Светлана Филипповна любила задавать вопрос: где начинается пищеварение? За ответ «в желудке» шел удар указкой по столу, гневная тирада и «двойка» в дневник.
С тех пор я запомнила на всю жизнь, что пищеварение начинается во рту. Именно поэтому все врачи настоятельно рекомендуют очень тщательно прожевывать пищу, есть не спеша, а не на бегу, когда глотаешь не жуя.
Мне даже где-то попадалась информация, что на одно глотательное движение должно быть не менее тридцати жевательных. Только тогда процесс пищеварения будет эффективен. Честно скажу, когда-то давно, лет десять назад, наверное, я честно пыталась следовать этому совету, но быстро поняла, что в этом случае даже обычный завтрак затягивается почти на час, не говоря уже об обеде. А с современным темпом жизни это, увы, нереально.
Ну да это уже тема не этой статьи и даже не этого блога. Возвращаюсь к амилазе и пищеварению.
Итак, во рту начинается процесс переваривания пищи. Зубы измельчают еду, язык – перемешивает, а слюна – смачивает. Вместе со слюной в пищу попадает необходимый для переваривания фермент – амилаза, который действует на сложные углеводы, например, крахмал – расщепляет их на составные части, которые затем будут всасываться в кровь и давать энергию организму.
Вот сегодня на примере я покажу, как «работает» амилаза.
Как делаем опыт
- Приблизительно полчаса времени
- Картофельный крахмал – 1 чайная ложка без горки
- Спиртовой раствор йода
- Горячая и холодная вода
- Две мерные ложечки на 5 мл от любого лекарственного сиропа
- Стакан или чашка
- Небольшая кастрюлька с электроплитой (или газовой, не важно)
- Желательно – маркер, который пишет по стеклу
- Несколько стаканов или стеклянных баночек от детского питания
Поначалу, когда я планировала эксперимент, то насчитала, что мне понадобится 6 баночек. Однако, в ходе эксперимента выяснилось, что можно спокойно обойтись и тремя.
Начинаем с того что растворяем крахмал в минимальном объеме холодной воды, хорошенько размешиваем. Затем готовим коллоидный раствор крахмала. Не пугайтесь, это всего лишь кисель.
Для его приготовления стакан воды кипятим в кастрюльке, а потом при постоянном помешивании выливаем туда растворенный в холодной воде крахмал.
Перемешиваем, перемешиваем! Постоянно мешаем, чтобы не было комочков!
Варим на слабом огне минуты три-четыре. Затем отставляем остывать.
Запомните, чтобы опыт получился, все вещества должны быть комнатной температуры либо едва-едва теплыми!
Пока остывает, озадачиваем семью, друзей и родственников (а также собак, кошек, попугайчиков и рыбок), находящихся с вами в одной квартире, на предмет сбора слюны. Не смейтесь, на первый взгляд это легко, а попробуйте набрать и убедитесь, что не так все просто. Вам понадобится 10 мл – две ложечки по 5 мл. Больше – можно, меньше – нет.
Одну порцию выливаем в небольшой стакан или любую другую небольшую емкость и кипятим на водяной бане три-четыре минуты. Оставляем остывать.
Остывший крахмальный кисель разливаем по две чайных ложки по трем баночкам и подписываем маркером:
В первую баночку добавляем не подвергшуюся нагреванию порцию слюны и хорошенько перемешиваем.
Во вторую баночку добавляем прокипяченную слюну.
Третья будет контрольной. Туда добавляем 5 мл воды (столько же, сколько было слюны).
Теперь все активно мешаем-мешаем-мешаем, имитируя процесс пищеварения. Вот крахмал попал к вам в рот в виде хлеба, яблока, банана и т.д. Вот вы его измельчили зубами, а теперь перемешиваете языком, смачивая слюной, содержащей амилазу. Желательно перемешивать минут пять.
Обратите внимание, как в первой баночке изменится консистенция раствора. Вот что амилаза животворящая делает! А что во второй и третьей — с «убитым» кипячением ферментом и вообще без него?
Давайте проверим, что стало с крахмалом, который был во рту виртуального едока, то есть в баночках. Вспоминаем качественную реакцию на крахмал – появление синей окраски при взаимодействии с йодом.
Отбираем по небольшому объему из каждого образца. Можно отлить в отдельные емкости-баночки, но я сделала проще. Положила на стол кусок гладкого плотного целлофана и чайной ложкой выложила из каждой баночки на стол по небольшой пробе. Затем добавила в каждую пробу по 1 капле спиртового раствора йода.
Смотрите, в первом образце цвет йода не изменился, остался коричневым – крахмала там нет, весь переработан и расщеплен ферментом амилазой.
А в двух других умница-йод показал наличие крахмала, окрасив растворы в темно-синий цвет. Во втором образце фермент был подвергнут нагреванию, что изменило его свойства, сделало его «нерабочим, неактивным» — крахмал не расщепился на свои составляющие. В третьем, контрольном «рту» амилазы не было вообще, крахмал остался в первоначальном виде, его некому было расщепить.
Обсуждаем и ликвидируем последствия опыта
Вот вы и увидели, как начинается процесс пищеварения. Модель, конечно, очень условная и упрощенная, но, тем не менее, наглядная и работающая.
Опыт несложный в выполнении, не занимает много времени и не требует специального оборудования и реактивов. Как, впрочем, и все опыты, которые я провожу и записываю в рубрику «Похимичим».
Руки, посуду, квартиру и детей (насчет собаки и рыбок не знаю, не пробовала) отмыть от йода очень легко. Вам понадобится тиосульфат натрия, который продается в аптеке, стоит копейки и работает даже спустя год после окончания срока годности (у меня такой в шкафу лежит, выбросить жалко). Пары ампул вам хватит (конечно, в зависимости от масштабов проблемы).
Ну а я, пожалуй, я задумаюсь о пользе еды на бегу и второпях без тщательного пережевывания пищи. А вы что думаете по этому поводу?
KidsChemistry теперь есть и в социальных сетях. Присоединяйтесь прямо сейчас! Google+ , В контакте , Одноклассники , Facebook , Twitter
Гидролиз крахмала a-амилазами
a-Амилазы действуют на a-1,4 –гликозидные связи, расщепляют амилозу внутри её цепи, в результате чего с большой скоростью образуются низкомолекулярные продукты гидролиза – нормальные a-декстрины. Их дальнейший гидролиз даёт мальтозу, мальтотриозу и глюкозу. Было найдено, что расщепление a-1,4-глюкозидных связей в амилозе носит случайный характер иподчиняется закону статистического распределения продуктов реакции. Расщепление более мелких фракций на последнем этапе амилоза носит уже не случайный характер – действие фермента направлено лишь на определённые a-1,4-гликозидные связи. В конечном счёте a-амилазы превращают амилозу в мальтозу и глюкозу, хотя и отмечены некоторые несущественные различия в динамике гидролиза этими ферментами указанного субстрата.
Бендецкий, Яровенко по изменению вязкости и восстанавливающей способности гидролизатов крахмала оценивали действие (множественность атаки) a-амилазы Bac. Subtilis на растворимый крахмал. Авторы наблюдали существенное различие вязкость –восстанавливающая способность при кислотном и ферментативном гидролизе крахмала. Это дало основание сделать заключение, что при кислотном гидролизе деградация крахмала происходит беспорядочно, а при действии a-амилазы осуществляется множественная атака на субстрат, приводящая к образованию олигомеров на первой стадии деградации.
Разрыв цепей амилопектина осуществляется между a-1,6 — глюкозидными связями. Отщепление декстринов, содержащих 15 и более гликозидных остатков, идёт с большей скоростью, в то время как конечное осахаривание существенно замедляется. Продукты гидролиза, содержащие a-1,4 — глюкозидные связи, являются нормальными a-декстринами и состоят из 6-13 глюкозидных остатков. Остаточные декстрины, содержащие большое количество a-1,6-связей, обазначаются как аномальные конечные декстрины. Установлено, что a-1,6-связи не только не расщепляются a-амилазой, но и являются стерическим препятствием для гидролиза a-1,4-связей, находящихся в непосредственной близости к a-1,6-связям. Наименьшим предельным декстрином в конце гидролиза амилопектина амилазой слюны был найден тетрасахарид, солодовой амилазы – паноза, т. е устойчивым к расщеплению в первом случае были две a-1,4-глюкозидные связи, во втором – лишь одна.
На рис. Представлена схема действия a-амилаз на амилозу и амилопектин по Бернфельду.

Ход работы
Оборудование: электрическая плитка, химические стаканы, колбы, термостойкая колба, термометр, водяная баня, пипетка, мензурка.
Реактивы: крахмал, раствор йода.
Приготовление раствора крахмала:
В термостойкую колбу добавляем 200 мл воды. В неё же добавляем 2 г крахмала. Доводим смесь до кипения и кипятим несколько минут. Таким образом получаем 1% раствор крахмала.
Приготовление раствора слюны:
50 мл воды полощем во рту в течении 3-4 минут.
В три пробирки добавляем по 25 мл раствора крахмала и каплю йода. Раствор крахмала окрашивается в интенсивно синюю окраску. Нагреваем электрическую плитку и измеряем температуру водяной бани. В течении 8-10 минут даём время, чтобы температура водяной бани и температура раствора в пробирках уравнялась. Снова измеряем температуру водяной бани. Добавляем в раствор крахмала 5 мл раствора слюны и включаем секундомер. Отмечаем время исчезновения синей окраски. Затем в следующие три пробирки добавляем раствор крахмала и каплю раствора йода, охлаждаем водяную баню и повторяем процедуру при более низкой температуре.
Результаты эксперимента приведены в таблице:
| toC | |||||||
| t1 | 11 мин 17 с | 7 мин 5с | 3 мин 56 с | 3 мин 16 с | 4 мин 6 с | 5 мин 13 с | 6 мин 57 с |
| t2 | 11мин 22 с | 7 мин 13с | 4 мин 6 с | 3 мин 23 с | 4 мин 16 с | 5 мин 5 с | 6 мин 55 с |
| t3 | 11 мин 23 с | 7 мин 9с | 4 мин | 3 мин 21 с | 4 мин 8 с | 5 мин 11 с | 7 мин 3 с |
| tср. | 11 мин 21с | 7 мин 9 с | 4 мин 1 с | 3 мин 20 с | 4 мин 10 с | 5 мин 10 с | 6 мин 58 с |
| toC | |||||||
| 1/t мин-1 | 0.088 | 0.14 | 0.25 | 0.3 | 0.24 | 0. 195 | 0.143 |
Зависимость скорости расщепления крахмала от температуры.
Можно видеть, что кривая имеет колокообразный характер с максимумом при температуре 37оС. Это подтверждает белковое строение a-амилазы, так как при использовании неорганических катализаторов скорость при повышении температуры постоянно возрастает. Также можно видеть, что в нейтральной среде оптимальная работа фермента происходит при 37оС, что совпадает с температурой тела человека.
Литература
1. Алейникова Т.Л., Рубцова Г.В. «Руководство к практическим занятиям по биологической химии». М.: Высшая школа 1988 г.
2. Жеребцов Н.А. «Амилолитические ферменты в пищевой промышленности». М.: Лёгкая и пищевая промышленность 1984 г.
3. А. Ленинджер «Биохимия». 1976 г.
4. Лещук Р.И., Хило З.В. «Малый практикум по биохимии». Томск 1984 г.
5. Производство и применение амилолитических ферментов в пищевой промышленности. М.: Пищевая промышленность 1968 г.
6. Филиппович Ю.Б. «Основы биохимии». М.: Высшая школа 1985 г.
Благодарности
Выражаю благодарность учителю физики Барановой Елене Львовне за помощь в работе и за предоставленное оборудование, ученику 9б класса Косареву Славе за оформление плакатов и ученице 11а класса Овчаровой Наталье за помощь в работе.
http://kidschemistry.ru/opyt-kak-amilaza-v-slyune-rasshheplyaet-kraxmal.html
http://poisk-ru.ru/s31531t17.html