Медный купорос ГОСТ 19347-99
| Медный купорос | |
|---|---|
| Систематическое наименование | медный купорос |
| Традиционные названия | пентагидрат: сульфат меди (II), медь сернокислая техническая |
| Хим. формула | CuSO 4 |
| Состояние | кристаллическое |
| Молярная масса | 159,609 (сульфат) 249.685 (пентагидрат) г/моль |
| Плотность | 3,64 г/см³ |
| Твёрдость | 2,5 |
| Т. разл. | выше 650 °C |
| pKa | 5⋅10 −3 |
| Координационная геометрия | Октаэдрическая |
| Кристаллическая структура | безв. — ромбическая пентагидрат — триклинная пинакоидальная тригидрат — моноклинная |
| ГОСТ | ГОСТ 19347-99 |
| Рег. номер CAS | 7758-98-7 |
| PubChem | 24462 |
| Рег. номер EINECS | 231-847-6 |
| SMILES | |
| Кодекс Алиментариус | E519 |
| RTECS | GL8800000 |
| ChEBI | 23414 |
| ChemSpider | 22870 |
| ПДК | в воздухе: мр 0,009, сс 0,004; в воде: 0,001 |
| ЛД50 | крысы, орально: 612,9 мг/кг мыши, орально: 87 мг/кг |
| Токсичность | |
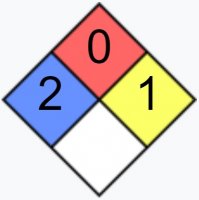
| NFPA 704 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Медный купорос (медь сернокислая, сульфат меди (II) ) — неорганическое соединение, медная соль серной кислоты с формулой CuSO 4. Нелетучее вещество, не имеет запаха. В безводном виде — белый порошок, очень гигроскопичное. В виде кристаллогидратов — прозрачные негигроскопичные кристаллы различных оттенков синего с горьковато-металлическим вяжущим вкусом, на воздухе постепенно выветриваются (теряют кристаллизационную воду).
Сульфат меди(II) хорошо растворим в воде. Из водных растворов кристаллизуется голубой пентагидрат CuSO4·5H2O — медный купорос. Токсичность медного купороса для теплокровных животных относительно невысока, в то же время, он высокотоксичен для рыб.
Обладает дезинфицирующими, антисептическими, вяжущими свойствами. Применяется в медицине, в растениеводстве как антисептик, фунгицид или медно-серное удобрение.
Реакция гидратации безводного сульфата меди (II) экзотермическая и проходит со значительным выделением тепла.
Содержание
- 1 Нахождение в природе
- 2 Получение
- 2.1 В промышленности
- 2.2 В лабораторных условиях
- 2.3 Очистка
- 2.3.1 Глубокая очистка
- 3 Физические свойства
- 3.1 Строение кристаллогидрата
- 3.2 Термическое воздействие
- 3.3 Растворимость
- 4 Химические свойства
- 4.1 Электролитическая диссоциация
- 4.2 Реакция замещения
- 4.3 Реакция с растворимыми основаниями (щелочами)
- 4.4 Сокращённое ионное уравнение (Правило Бертолле)
- 4.5 Реакция обмена с другими солями
- 4.6 Прочее
- 5 Производство и применение
- 6 Токсикология
Нахождение в природе
В природе встречается в виде минералов халькантита (CuSO4·5H2O), халькокианита (CuSO4), бонаттита (CuSO4·3H2O), бутита (CuSO4·7H2O) и в составе некоторых других минералов.
Получение
В промышленности
В промышленности загрязненный сульфат меди(II) получают растворением меди и медных отходов в разбавленной серной кислоте H2SO4 при продувании воздуха:
растворением оксида меди(II) CuO в H2SO4:
сульфатизирующим обжигом сульфидов меди и как побочный продукт электролитического рафинирования меди.
В лабораторных условиях
В лаборатории CuSO4 можно получить действием концентрированной серной кислоты на медь при нагревании:
температура не должна превышать 60 °С, при большей температуре в значительных количествах образуется побочный продукт — сульфид меди(I):
Также в лабораторных условиях сульфат меди (II) может быть получен реакцией нейтрализации гидроксида меди(II) серной кислотой, для получения сульфата меди высокой чистоты используют соответственно чистые реактивы:
Чистый сульфат меди может быть получен следующим образом. В фарфоровую чашку наливают 120 мл дистиллированной воды, прибавляют 46 мл химически чистой серной кислоты плотностью 1,8 г/см 3 и помещают в смесь 40 г чистой меди (например, электролитической). Затем нагревают до 70—80 °С и при этой температуре в течение часа постепенно, порциями по 1 мл, прибавляют 11 мл конц. азотной кислоты. Если медь покроется кристаллами, прибавить 10—20 мл воды. Когда реакция закончится (прекратится выделение пузырьков газа), остатки меди вынимают, а раствор упаривают до появления на поверхности пленки кристаллов и дают остыть. Выпавшие кристаллы следует 2—3 перекристаллизовать из дистиллированной воды и высушить.
Очистка
Очистить загрязненный или технический сульфат меди можно перекристаллизацией — вещество растворяется в кипящей дистиллированной воде до насыщения раствора, после чего охлаждается до приблизительно +5 °С. Полученный осадок кристаллов отфильтровывается. Однако даже многократная перекристаллизация не позволяет избавиться от примеси соединений железа, которые являются наиболее распространенной примесью в сульфате меди.
Для полной очистки медный купорос кипятят с диоксидом свинца PbO2 или пероксидом бария BaO2, пока отфильтрованная проба раствора не покажет отсутствия железа. Затем раствор фильтруют и упаривают до появления на поверхности пленки кристаллов, после чего охлаждают для кристаллизации.
По Н. Шоорлю очистить сульфат меди можно так: к горячему раствору CuSO4 прибавить небольшие количества пероксида водорода H2O2 и гидроксида натрия NaOH, прокипятить и отфильтровать осадок. Выпавшие из фильтрата кристаллы дважды подвергаются перекристаллизации. Полученное вещество имеет чистоту не ниже квалификации «ХЧ».
Глубокая очистка
Существует более сложный способ очистки, позволяющий получить сульфат меди особой чистоты, с содержанием примесей около 2·10 -4 %.
Для этого готовится водный, насыщенный при 20°С раствор сульфата меди (вода используются только бидистиллированная). В него добавляют перекись водорода в количестве 2-3 мл 30 % раствора на 1 литр, перемешивают, вносят свежеосаждённый основной карбонат меди в количестве 3-5 грамм, нагревают и кипятят 10 минут для разложения H2O2.
Затем раствор охлаждают до 30—35 °С, фильтруют и приливают 15 мл 3%-ного раствора диэтилдитиокарбамата натрия и выдерживают в мешалке три-четыре часа не понижая температуры. Далее раствор быстро процеживают от крупных хлопьев комплексов и вносят активированный уголь БАУ-А на полчаса при перемешивании. Затем раствор следует отфильтровать вакуумным методом.
Дальше в раствор CuSO4 приливают на 1 л около 200 мл насыщенного раствора NaCl квалификации «Ч» и вносят чистый алюминий в проволоке или обрезках до полного прохождения реакции, выделения меди и просветления раствора (при этом выделяется водород). Выделенную медь отделяют от алюминия взбалтыванием, осадок промывают декантацией сперва водой затем заливают горячим 5—10 % раствором соляной кислоты ХЧ при взбалтывании в течение часа и постоянным подогревом до 70—80 °С, затем промывают водой и заливают 10—15%-ной серной кислотой (ОСЧ 20-4) на час с подогревом при том же интервале температур. От степени и тщательности промывания кислотами, а также квалификации применяемых далее реактивов зависит чистота дальнейших продуктов.
После промывки кислотами медь снова моют водой и растворяют в 15—20%-ной серной кислоте (ОСЧ 20-4) без её большого избытка с добавлением перекиси водорода (ОСЧ 15-3). После прохождения реакции полученный кислый раствор сульфата меди кипятят для разложения избытка перекиси и нейтрализуют до полного растворения вначале выпавшего осадка перегнанным 25%-ным раствором аммиака (ОСЧ 25-5) или приливают раствор карбоната аммония, очищенного комплексно-адсорбционным методом до особо чистого.
После выстаивания в течение суток раствор медленно фильтруют. В фильтрат добавляют серную кислоту (ОСЧ) до полного выпадения голубовато-зелёного осадка и выдерживают до укрупнения и перехода в зелёный основной сульфат меди. Зелёный осадок выстаивают до компактности и тщательно промывают водой до полного удаления растворимых примесей. Затем осадок растворяют в серной кислоте, фильтруют, устанавливают рН=2,5—3,0 и перекристаллизовывают два раза при быстром охлаждении, причем при охлаждении раствор каждый раз перемешивают для получения более мелких кристаллов сульфата меди. Выпавшие кристаллы переносят на воронку Бюхнера и удаляют остатки маточного раствора с помощью водоструйного насоса. Третья кристаллизация проводится без подкисления раствора с получением чуть более крупных и оформленных кристаллов.
Физические свойства
Пентагидрат сульфата меди (II) (медный купорос) — синие прозрачные кристаллы триклинной сингонии. Плотность 2,284 г/см 3 . При температуре 110 °С отщепляется 4 молекулы воды, при 150 °С происходит полное обезвоживание.
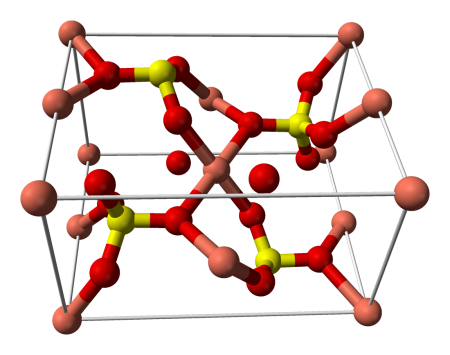
Строение кристаллогидрата
Структура медного купороса приведена на рисунке. Как видно, вокруг иона меди координированы два аниона SO4 2− по осям и четыре молекулы воды (в плоскости), а пятая молекула воды играет роль мостиков, которые при помощи водородных связей объединяют молекулы воды из плоскости и сульфатную группу.
Термическое воздействие
При нагревании пентагидрат последовательно отщепляет две молекулы воды, переходя в тригидрат CuSO4·3H2O (этот процесс, выветривание, медленно идёт и при более низких температурах [в том числе при 20—25 °С]), затем в моногидрат (при 110 °С) CuSO4·H2O, и выше 258 °C образуется безводная соль.
Выше 650 °C становится интенсивным пиролиз безводного сульфата по реакции:
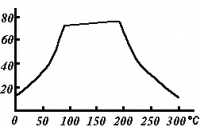
Растворимость
Растворимость сульфата меди (II) по мере роста температуры проходит через плоский максимум, в течение которого растворимость соли почти не меняется (в интервале 80—200 °C). (см. рис.)
Как и все соли, образованные ионами слабого основания и сильной кислоты, сульфат меди (II) гидролизуется, (степень гидролиза в 0,01 М растворе при 15 °C составляет 0,05 %) и даёт кислую среду (pH указанного раствора 4,2). Константа диссоциации составляет 5⋅10 −3 .
Химические свойства
Электролитическая диссоциация
CuSO4 — хорошо растворимая в воде соль и сильный электролит, в растворах сульфат меди(II) так же, как и все растворимые соли, диссоциирует в одну стадию:
Реакция замещения
Реакция замещения возможна в водных растворах сульфата меди с использованием металлов активнее меди, стоящих левее меди в электрохимическом ряду напряжения металлов:
Реакция с растворимыми основаниями (щелочами)
Сульфат меди(II) реагирует с щелочами с образованием осадка гидроксида меди(II) голубого цвета:
Сокращённое ионное уравнение (Правило Бертолле)
Реакция обмена с другими солями
Сульфат меди вступает также в обменные реакции по ионам Cu 2+ и SO4 2-
Прочее
С сульфатами щелочных металлов и аммония образует комплексные соли, например, Na2[Cu(SO4)2]·6H2O.
Подборка простых опытов с медным купоросом в домашних условиях
В прошлой статье я рассказывала про медный купорос, что это такое, где применяется и даже как некоторые им лечатся (вот только не знаю, вылечиваются ли?), а сегодня предлагаю поделать опыты с медным купоросом в домашних условиях.
Обо всех этих экспериментах я уже рассказывала в рубрике «Похимичим», так что сейчас, по сути, просто собираю их все вместе, так как они раскиданы по разным статьям.
В начале, как обычно предупреждаю о соблюдении правил техники безопасности!
Напоминаю, что практически все опыты (кроме одного) мы будем делать с раствором медного купороса. Чтобы его получить, растворите половину чайной ложки в стакане воды – этого вполне хватит на все сегодняшние эксперименты. Предлагаю начать с самого простого и похимичить гвоздем.
Опыт с медным купоросом и железным гвоздем
Все очень просто – в раствор купороса опускаете чистый (имеется ввиду без ржавчины и масла) железный гвоздь и ждете. Химическая реакция пройдет сама, без вашего дальнейшего участия. Первые результаты будут видны уже через несколько минут. Ну а самым терпеливым советую «забыть» про происходящее на пару недель. Будет очень интересно.
Подробнее читайте вот в этой статье.
Взаимодействие с аммиаком
В светло-голубой раствор капаем немного аммиака. Вуаля! Готов ярко-фиолетовый раствор аммиаката меди. Не забивайте голову названием, просто наслаждайтесь красивым зрелищем.
Взаимодействие с гидроксидом натрия
Добавляем немного гидроксида натрия. Получается красивый голубой осадок гидроксида меди. Не выливайте его, он нам пригодится в следующем опыте.
Красивые превращения глюкозы
Вам понадобится аптечный раствор чистой глюкозы. Приливаем ее к осадку, полученному в предыдущем опыте, и аккуратно нагреваем. Ярко-голубой осадок постепенно превратится сначала в желтый раствор, затем – в красный.
Делать все нужно достаточно внимательно и аккуратно, поэтому посмотрите, как я делала.
Опыты с яйцом
Денатурация (разрушение) белка
Берем сырое яйцо и отделяем белок от желтка. Белок помещаем в стакан, добавляем немного воды,перемешиваем и делим на две части, то есть на два эксперимента. К первой части приливаем немного медного купороса. После перемешивания получаем вот такую невразумительную массу:
Биуретовая реакция
Ко второй части белка добавляем немного гидроксида натрия, а потом – несколько капель купороса. Получаем ярко-фиолетовую окраску раствора.
Подробно об этих реакциях можно прочитать вот здесь.
Взаимодействие с поваренной солью
Разводим в стакане с водой немного обычной поваренной соли и смешиваем с раствором медного купороса. Любуемся изумрудно-зеленой окраской получившегося раствора.
Желающих продолжить этот опыт дальше отсылаю к статье «Цветные реакции». В ней вы найдете много интересного.
Забавный химический фокус
Он потребует от вас некоторых приготовлений (минут на пять), но оно того стоит. Нужна всего лишь старая сковородка и кристаллический (не раствор!) медный купорос. Будем с помощью воды превращать белое вещество в синее. Подробная инструкция здесь.
Морозные узоры на стекле
Хоть сейчас и лето, но вы легко можете создать на стекле самые настоящие морозные узоры.
Выращиваем химический сад
Еще один очень простой опыт. Единственное, что от вас потребуется, это, как и в случае с гвоздем, терпение. Ну и немного обычного канцелярского силикатного клея. Подробности в статье «Химические водоросли».
Непослушная пена
Ну и под занавес, эффектный опыт по получению пены. Его можно делать в двух вариантах – с медным купоросом либо с марганцовкой. По сути, процессы идут одинаковые и результат также практически одинаковый. Правда, придется побегать по аптекам в поисках гидроперита. Если вам улыбнется удача и вы его купите, то внимательно читайте вот эту статью и химичьте в свое удовольствие!
Вот и все на сегодня. Надеюсь, эта подборка домашних опытов с медным купоросом вам пригодится. Может, у вас есть какие-то идеи, что еще можно сделать? Пишите в комментариях, делитесь опытом.
Всем хорошего настроения!
P.S. Я совсем забыла про самый распространенный опыт — выращивание красивых синих кристаллов. Обещаю исправиться и в ближайшее время показать вам его
KidsChemistry теперь есть и в социальных сетях. Присоединяйтесь прямо сейчас! Google+ , В контакте , Одноклассники , Facebook , Twitter
Медный купорос: полная характеристика вещества
Медный купорос является кристаллогидратом сульфата меди, то есть в структуру данного вещества входят еще и молекулы воды. Он обладает теми основными свойствами, которые характерны для обыкновенного купрум сульфата. Следует сказать, что это соль, поэтому для нее характерно химическое поведение, которым отличаются многие другие вещества данной группы.
Физические свойства
Медный купорос представляет собой твердое кристаллическое вещество синего цвета. Оно растворимо в воде. На одну молекулу сульфата купрума в структуре вещества приходится пять молекул воды. Безводный же он не обладает каким-либо цветом. В природе его можно встретить в виде некоторых минералов, таких как халькантит. Данный камень мало кому известен и редко используется.
Химические свойства сульфата меди (медного купороса)
Как и любой другой сульфат, медный может разлагаться под воздействием высоких температур. При такого рода реакции образуется оксид купрума, диоксид серы и кислород. Также сульфат меди, как и другие соли, может быть участником реакции замещения. При такого рода взаимодействии более активный металл, который стоит левее купрума в электрохимическом ряду активности, вытесняет атом меди из соединения и занимает его место. К примеру, добавив натрий к рассматриваемому веществу, можно получить сульфат натрия и медь, которая выпадет в осадок. Кроме того, данное вещество способно реагировать с основными и кислотными гидроксидами, а также другими солями. Для примера можно привести реакцию купрум сульфата с гидроксидом кальция — основанием. В результате этого взаимодействия выделяется гидроксид меди и сульфат кальция. В качестве примера реакции этой соли с кислотой можно взять взаимодействие ее с фосфорной, в результате которого образуется фосфат меди и сульфатная кислота. При смешивании сульфата меди с раствором другой соли происходит реакция обмена. То есть, если добавить к нему, к примеру, хлорид бария, то можно получить хлорид меди и сульфат бария, выпадающий в осадок (если один из продуктов не является осадком, газом или водой, реакция не сможет осуществиться).
Получение данного вещества
Медный купорос можно получить с помощью двух основных способов. Первый — это взаимодействие гидроксида меди с концентрированной сульфатной кислотой. При этом выделяется также значительное количество воды, часть которой идет на гидратацию. Второй метод получения данного вещества — взаимодействие концентрированной серной кислоты непосредственно с медью. Такого рода реакция может осуществиться только при специфических условиях в виде повышенной температуры. Также возможно осуществить реакцию между оксидом меди и сульфатной кислотой, в результате которой также образуется нужное вещество и вода. Кроме того, медный купорос получают посредством обжига сульфитов меди.
Применение медного купороса
Данное вещество нашло свое основное применение в садоводческой сфере — оно используется для защиты растений от болезней и вредителей благодаря своим антисептическим и дезинфицирующим средствам. Также данное вещество широко применяется в сельском хозяйстве, так как с его помощью можно повысить морозоустойчивость и иммунитет растений к грибкам. Кроме того, медный купорос используют в металлургии, а также в строительстве. Им пропитывают древесину для придания ей огнеупорных свойств. В пищевой промышленности его часто используют как консервант. Кроме всего перечисленного выше, медный купорос применяют для изготовления красок, для проведения качественных реакций на катионы цинка, марганца и магния.
Кристаллы из медного купороса
Интересным и увлекательным для детей занятием является выращивание кристаллов из разнообразных веществ. Сырьем для такого занимательного эксперимента может послужить много разных соединений, в том числе кухонная соль, а также медный купорос. Свойства данного вещества позволяют вырастить из его порошка, купленного в любом магазине для садоводов, большой кристалл. Для этого не нужно будет прилагать слишком много усилий. Чтобы вырастить кристалл медного купороса, нужно взять любую емкость. В нее следует налить воду и засыпать сам порошок, при этом нагревая жидкость, чтобы способствовать более быстрому растворению в ней вещества. Добавлять медный купорос нужно, покуда возможно его растворение в воде. Таким образом мы получаем очень насыщенный раствор. Затем можно оставить его так, просто накрыв чем-либо, а можно закрепить на крышке с внутренней стороны нитку с подвешенной на ней бусиной или пуговицей, чтобы она ровно висела — таким образом кристаллы будут расти на нитке, а не на дне емкости. Нужно следить за тем, чтобы ее не передвигали с места на место, иначе ничего не получится. Каждый день или раз в несколько дней нужно понемногу добавлять в раствор медный купорос для поддержания высокой насыщенности, чтобы кристаллы не начали снова растворяться в воде. Примерно после двух недель подобных манипуляций, если сделать все правильно, можно получить довольно большой кристалл.
Медный купорос. Качественные реакции, проводимые с его помощью
С помощью данного вещества можно определить наличие катионов цинка. Если добавить в раствор медный купорос, и при этом выпадет мутный осадок, значит, там содержатся соединения цинка. Также с помощью рассматриваемого вещества можно определить наличие катионов магния. В этом случае в растворе также выпадет осадок.
Как определить, что в растворе есть медный купорос?
Самой распространенной качественной реакцией, которую возможно провести в домашних условиях, является взаимодействие раствора с железом. Можно взять любое железное изделие. Если, опустив его на некоторое время в раствор, вы увидите на нем красноватый налет, значит, медный купорос присутствует. Данный налет представляет собой медь, которая осела на железном изделии. Сульфат железа, который также выделяется вследствие данной реакции замещения, уходит в тестируемый раствор. Еще одним, уже менее доступным вариантом для определения наличия данного вещества в растворе является реакция с любой растворимой солью бария. При этом сульфат бария выпадет в осадок. Также можно провести тест с помощью любого алюминиевого изделия по тому же принципу, что и первая описанная реакция. В этом случае также должен образоваться налет красноватого цвета, который свидетельствует о замещении атомами алюминия атомов купрума и образовании сульфата алюминия и чистой меди.
Заключение
Если кратко подвести итог всему написанному выше, можно сказать, что медный купорос является очень широко распространенным и всем известным веществом, которое применяется во многих сферах человеческой жизни. Он может находить свое применение как в разнообразных отраслях промышленности, так и в домашних условиях: в развлекательных целях или для ухода за растениями. Также данное вещество пользуется популярностью у тех людей, кто разводит рыбок, — оно предохраняет аквариум от загрязнения микроводорослями. Сульфат купрума легко получить в лабораторных условиях. Он имеет невысокую себестоимость, вследствие чего он и получил такое широкое распространение и применяется в самых различных целях.
http://kidschemistry.ru/prostye-opyty-s-mednym-kuporosom-v-domashnix-usloviyax.html
http://www.syl.ru/article/141986/mod_mednyiy-kuporos-polnaya-harakteristika-veschestva