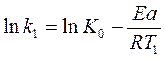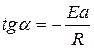Реакция омыления уксусноэтилового эфира идет по уравнению
Цель работы:
1. Определить константы скорости реакции взаимодействия уксусноэтилового (уксуснобутилового) эфира со щёлочью методом объёмного титрования при заданной температуре;
2. Рассчитать энергию активации реакции.
Теоретическая часть
Реакция уксусноэтилового эфира со щёлочью протекает в водном растворе по уравнению:
и является реакцией второго порядка.
Порядок реакции определяется экспериментальным кинетическим уравнением реакции и равен сумме показателей степеней при концентрациях в этом уравнении.
Кинетическим называют уравнение, описывающее зависимость скорости реакции V от концентрации С реагирующих веществ.
Например, для реакции nA + mB = pC
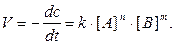
Коэффициент пропорциональности k называют константой скорости реакции, которая численно равна скорости реакции реагирующих веществ, равных единице.
Константа скорости реакции зависит от природы реагирующих веществ, природы растворителя, температуры, присутствия катализаторов, являясь, таким образом, характерной величиной для данной реакции.
Константу скорости реакции вычисляют из опытных данных с помощью кинетического уравнения.
Для реакции изучаемой в работе, кинетическое уравнение вид:
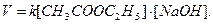
Обозначив начальные числа молей через a и b, а убыль числа молей к моменту времени t через x, после разделения переменных и интегрирования получим:
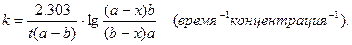
Из уравнения (3) видно, что значение константы скорости реакции второго порядка зависит от способа выражения концентрации.
Если начальные концентрации веществ равны (a=b), то кинетическое уравнение имеет вид: 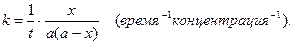
Для вычисления константы скорости реакции взаимодействия уксусноэтилового эфира со щёлочью по уравнению (3) количества реагентов определяют методом титрования одинаковых объёмов проб (по 10 мл) раствором кислоты с точно установленной концентрацией Ск, моль/л. Пробы отбирают в различные моменты времени. Для вычисления значений а, b, x используют величины V0, Vt, V∞, объёмы кислоты, идущей на нейтрализацию щёлочи в пробе до начала реакции, в момент времени t и по окончании реакции соответственно. После соответствующих преобразований получают уравнение для расчёта К:
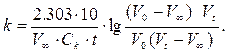
Скорость и константа скорости реакции зависят от температуры. Эта зависимость выражается уравнением Аррениуса:
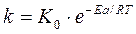
где k— константа скорости реакции;
К0 -предэкспотенциальный множитель, зависящий от природы реакции;
Еа – энергия активации реакции;
R — универсальная газовая постоянная;
Т – абсолютная температура.
Энергия активации – это минимальная энергия, которой должны обладать молекулы реагирующих частиц, чтобы соударения между ними привели к реакции. Размерность энергии активации в системе СИ – Дж/моль.
Уравнение Аррениуса содержит две постоянные для данной реакции величины К0 и Еа. Их можно определить, если экспериментально найти константы k 1 и k 2 при Т1 и Т2. Расчёт Еа можно произвести двумя методами: аналитическим и графическим.
1. Аналитический метод.
После логарифмирования уравнения Аррениуса (6) получим:
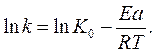
Решая систему двух уравнений:
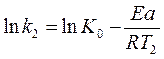
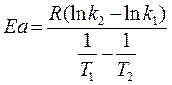
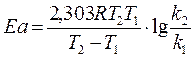
Подставляя R=8,31 дж/(моль·град), получим:
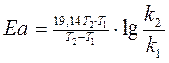
2. Графический метод.
Строят график зависимости lgk от 1/Т

Рисунок. 1. График зависимости lgkот 1/Т.
Отрезок, отсекаемый на оси ординат, равен lgК0, тангенсу угла наклона прямой
Экспериментальная часть
Оборудование и реактивы
Для выполнения работы требуется следующее оборудование и реактивы:
1) термостат или водяная баня, в которой поддерживается постоянная температура;
2) мерные колбы на 50 и 100 мл;
3) конические колбы на 100 мл;
4) пипетки на 5, 10 мл;
5)мерный цилиндр на 25 мл;
6) бюретки на 25 мл;
7) обратный холодильник;
8) 0,19 н. спиртовой раствор уксусноэтилового (уксуснобутилового) эфира;
9) 0,2 н. раствор NaOH;
10) 0,025 н. раствор HCl;
11) раствор фенолфталеина;
12) дистиллированная вода.
Методика выполнения работы
В мерную колбу на 100 мл наливают 50 мл 0,025 н. раствора щелочи NaOH. В мерную колбу на 50 мл наливают 5 мл 0,19 н. спиртового раствора уксусноэтилового (или уксуснобутилового) эфира и доводят дистиллированной водой до метки. Во избежание взаимодействия щёлочи с двуокисью углерода и испарения эфира колбы тщательно закрывают пробками. Обе колбы устанавливают в термостат и выдерживают там при температуре опыта (по заданию преподавателя) 15-20 мин. После этого содержимое второй колбочки переливают в первую и взбалтывают. Момент сливания растворов является моментом начала реакции. Сразу после смешивания реактивов отбирают пробу (10 мл раствора) в коническую колбу для титрования, в которую предварительно было налито 25 мл прокипячённой и охлаждённой до 0º – +2ºС дистиллированной воды, необходимой для торможения реакции в пробе. Мерную колбу с реакционной смесью устанавливают обратно в термостат. Отобранную пробу титруют 0,01 н. раствором HCl в присутствии индикатора фенолфталеина. Все эти действия производят аккуратно и по возможности быстро. Полученный результат соответствует V0.
Затем через 5, 10, 15, 20, 30, 45, 60 минут от начала опыта отбирают пробы и оттитровывают их кислотой, как указано выше. Количество кислоты, пошедшее на титрование (Vt), записывают в таблицу против соответствующего времени, считая от начала опыта.
Реакция омыления уксусноэтилового (уксуснобутилового) эфира заканчивается при комнатной температуре примерно за сутки. Чтобы довести её до конца за более короткий срок, оставшуюся после взятия последней пробы реакционную смесь нагревают на водяной бане (60-80ºС) с обратным холодильником в течение 30-40 минут. После этого смесь охлаждают до температуры опыта, отбирая пробу (10 мл) и титруют раствором кислоты. Количество, пошедшее на титрование, в этом случае соответствует V ∞ .
Результаты эксперимента
Время от начала опыта, мин
Температура Т = ºС
По полученным экспериментальным данным необходимо:
1) построить кинетическую кривую Vt = f ( t ) (зависимость концентрации щелочи от времени протекания реакции)
2) вычислить значение константы скорости реакции для каждого момента времени по уравнению (5) и занести в таблицу 1.
3) рассчитать среднее значение константы скорости при данной температуре и занести в таблицу 1.
4) Используя средние значения констант скорости реакции взаимодействия уксусноэтилового (уксуснобутилового) эфира со щёлочью при двух температурах вычислить величину энергии активации реакции аналитическим методом.
Вопросы для контроля
1.Что называется химической кинетикой?
2. Сформулируйте основной закон химической кинетики.
3. Каков физический смысл константы скорости реакции?
4. От каких факторов зависит и не зависит константа скорости реакции?
5. Изменится ли константа скорости реакции в лабораторной работе, если вместо NaOH взять КОН?
6. Изменится ли константа скорости реакции если изменить эфир?
7. Какую роль выполняет индикатор в работе?
8. Что такое энергия активации реакции? Какая нужна информация для расчёта энергии активации в работе?
9.Что такое энергия активации?
10. Расчёт энергии активации реакции аналитическим и графическим методом.
Вывод:__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Оценка________________
Подпись преподавателя___________________
Помогите срочно дою 70б1) Реакция омыления уксусноэтилового эфира идет по уравнениюСН3СООС2Н5 + NаОН = СН3СОONа + С2Н5ОН?
Химия | 10 — 11 классы
Помогите срочно дою 70б
1) Реакция омыления уксусноэтилового эфира идет по уравнению
СН3СООС2Н5 + NаОН = СН3СОONа + С2Н5ОН.
Исходные концентрации реагирующих веществ до начала реакции были : [СН3СООС2Н5] = 0, 50 моль / л ; [NаОН] = 0, 25 моль / л.
Вычислить концентрации всех участвующих в реакции веществ в момент, когда [СН3СООС2Н5] стала 0, 30 моль / л.
Реакция протекает по схеме 2SO3(г) = 2SO2(г) + O2(г)?
Реакция протекает по схеме 2SO3(г) = 2SO2(г) + O2(г).
Концентрация SO3 до начала реакции составляла 0, 8 моль \ л.
Вычислите конецентрацию всех веществ в момент когда концентрация SO2 составит 0, 3 моль \ л.
В некоторый момент концентрация первого реагирующего вещества была 0, 1 моль / л, второго – 0, 06 моль / л, а продукта реакции – 0, 02 моль / л?
В некоторый момент концентрация первого реагирующего вещества была 0, 1 моль / л, второго – 0, 06 моль / л, а продукта реакции – 0, 02 моль / л.
Найдите концентрации всех веществ, в момент, когда концен — трация первого вещества уменьшится на 0, 02 моль / л для реакции : O2(г) + 2NO(г) = 2NO2(г).
Концентрация вещества за 15с изменилась с 1, 2 моль / л до 0, 6 моль / л?
Концентрация вещества за 15с изменилась с 1, 2 моль / л до 0, 6 моль / л.
Вычислите скорость реакции.
Пожалуйста, помогите решить : Реакция протекает по уравнению 2SO2 + O2 ↔ 2SO3?
Пожалуйста, помогите решить : Реакция протекает по уравнению 2SO2 + O2 ↔ 2SO3.
Вычислить константу равновесия и исходные концентрации сернистого газа и кислорода, если концентрации всех веществ в момент равновесия были равны : [SO2] = 5 моль / л, [O2] = 1, 3 моль / л, [SO3] = 4 моль / л.
Химическая реакция протекает в растворе согласно уравнению А + В = С?
Химическая реакция протекает в растворе согласно уравнению А + В = С.
Начальная концентрация вещества А составляла 0, 80 моль / л, а вещества В — 1, 00 моль / л.
Спустя 20 с концентрация А снизилась до 0, 78 моль / л.
Определите среднюю скорость реакции и концентрацию вещества В в этот момент времени.
В реакционном сосуде началась реакция a + 2b — 3d ?
В реакционном сосуде началась реакция a + 2b — 3d .
Через некоторое время концентрация веществ А и Д были соответственно равны 0.
Вычислите исходную концентрацию вещества А.
Найдите среднюю скорость химической реакции, если начальная концентрации одного из реагирующих веществ была 0, 8 моль / л?
Найдите среднюю скорость химической реакции, если начальная концентрации одного из реагирующих веществ была 0, 8 моль / л.
А через 2 с стала 0, 6 моль / л.
Уравнение реакции А + В = Сисходная концентрация А = 0, 80 моль / л , В = 1 моль / л?
Уравнение реакции А + В = С
исходная концентрация А = 0, 80 моль / л , В = 1 моль / л.
Через 20 мин концентрация А стала равной 0, 74 моль / л.
Найдите среднюю скорость реакции и концентрацию В через 20 мин.
Концентрация вещества за 15с изменилась с 1, 2 моль / л до 0, 6 моль / л?
Концентрация вещества за 15с изменилась с 1, 2 моль / л до 0, 6 моль / л.
Вычислите скорость реакции.
СРОЧНО?
Определите исходную концентрацию вещества если через 10 минут после начала реакции оно составило 0, 02 моль / л, а скорость реакции 0, 008моль / л сек.
Вы перешли к вопросу Помогите срочно дою 70б1) Реакция омыления уксусноэтилового эфира идет по уравнениюСН3СООС2Н5 + NаОН = СН3СОONа + С2Н5ОН?. Он относится к категории Химия, для 10 — 11 классов. Здесь размещен ответ по заданным параметрам. Если этот вариант ответа не полностью вас удовлетворяет, то с помощью автоматического умного поиска можно найти другие вопросы по этой же теме, в категории Химия. В случае если ответы на похожие вопросы не раскрывают в полном объеме необходимую информацию, то воспользуйтесь кнопкой в верхней части сайта и сформулируйте свой вопрос иначе. Также на этой странице вы сможете ознакомиться с вариантами ответов пользователей.
С + 2H2 — > CH4 2CH4 — > CH = — CH + 3H2 ( t = 1500) CH = — CH + H2 — > CH2 = CH2 (t, kat) CH2 = CH2 + H2O — > CH3 — CH2 — OH (kat) C6H6 + HONO2 — > C6H5NO2 + H2O ( t, H2SO4) C6H5NO2 + 3H2 — > C6H5NH2 + 2H2O.
Вот снизу должна быть указа формула на фото.
Mr(CH4) = 12 + 4 * 1 = 16 W(H) = 4 / 16 = 0. 25 = 25% Mr(C2H2) = 2 * 12 + 2 * 1 = 26 W(H) = 2 / 26 = 0. 08 = 8% Mr(C2H4) = 2 * 12 + 4 * 1 = 28 W(H) = 4 / 28 = 0. 14 = 14% Ответ : C2H2, C2H4, CH4.
Решение задачи находится на фото.
Марганец масса 54, 93 а валентность 2 ; 4 ; 7.
Дано : m(Cu) = 6. 4г Найти : V(SO2) — ? Решение : 6. 4г. Xл Cu + 2H2SO4 = SO2 + 2H2O + CuSO4 64г. 22. 4л X = 6. 4г×22. 4л : 64г = 2. 24л Ответ : выделился оксид серы (IV) массой 2. 24л.
Вода – слабый электролит, диссоциирующий на ионы H + и OH — — анионы. Этому процессу соответствует константа диссоциации воды : д * [H2O] = К H2O = [H + ] [OH — ] – ионное произведение воды, К H2O = 1 * 10 — 14 (при 25° С) К H2O – величина постоянна..
1. Литий — Li + 3 Li )2ē )1ē ē = 3, p = 3, n = 4 Находится в I группе, А подгруппе, II периоде. 2. Металл 3. Li Be 5. Высший оксид — Li2O — основный 6. Высший гидроксид — LiOH — щелочь 7. Летучего водородного соединения не образует..
Нет, там за каждый элемент ставится определенное кол — во баллов. На Решу ОГЭ вариант открой, после внизу страницы нажми «сохранить», далее будет написано, как оценивается каждое задание из 2 части.
2. Дано : ω(Е) = 91, 18% Знайти : Е — ? Ω(Н) = 100% — 91, 18% = 8, 82% Загальна формула сполуки ЕН3 Мг(ЕН3) = 3 / 0, 0882 = 34 Аг(Е) = 34 — 3 = 31⇒Р — Фосфор 2. Дано : m(Me(NO3)3 = 42. 6 r m(Me(OH)3 = 15. 6 r Знайти : Ме — ? Формула солі — ? 42..
Лабораторные работы по физической химии. Часть 2 (стр. 8 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 7 8 9 |
Выливают реакционную смесь из колбы для титрования, ополаскивают ее. Через 10 мин от момента добавления KI колбу для титрования вновь заполняют охлажденной дистиллированной водой (20 мл). Отбирают следующую пробу и титрованием определяют в ней концентрацию йода и т. д. Со второй, третьей и четвертой реакционными смесями проделывают те же операции, результаты фиксируют в таблицах типа (2). Для экономии времени рекомендуется все четыре эксперимента вести параллельно. Число бюреток для титрования при необходимости может быть увеличено. Строят зависимость C(I2) от времени для всех четырех изученных систем. Анализируют результаты, формулируют выводы, оформляют работу.
Основные понятия и предмет кинетики. Скорость химической реакции. Факторы, влияющие на скорость химической реакции. Закон действующих масс для скоростей реакции. Константа скорости химической реакции и период полупревращения. Почему в кинетических методах наиболее часто используют каталитические реакции, в которых определяемое вещество является катализатором? Общие представления о каталитических реакциях. Особенности катализа. Способы ускорения реакций. Кинетика каталитических реакций. Уравнение Михаэлиса-Ментен.
Лабораторная работа № 14
Изучение кинетики гидролиза уксусно-этилового эфира в кислой среде
Установить кинетический порядок процесса гидролиза уксуcно-этилового эфира в кислой среде при избытке воды. Определить константу скорости реакции.
Оборудование, материалы: лед, пипетки на 2 и 5 мл мерный цилиндр, две конические колбы на 100 — 200 мл, колба на 500 мл, колба для титрования, термометр. Растворы: этилацетат, 0,5 М и 1,0 М НС1; 0,5 М NaOH, фенолфталеин.
Краткие теоретические сведения:
Гидролиз сложного эфира, например этилацетата, является бимолекулярной гомогенно-каталитической реакцией, ускоряемой ионами гидроксония
СН3СООС2Н5 + Н2О (кат. Н3О+) → СН3СООН + С2Н5ОН (5)
Однако в избытке воды этот процесс описывается кинетическим уравнением реакции псевдо-первого порядка
— dCэф(t)/dt = k1 Ч Cэф(t) (6)
которое после интегрирования имеет вид:
k1= 1/t Ч ln(Cэф(0)/ Cэф(t)) (7)
В (6) и (7) Cэф(0) и Cэф(t) — исходная и текущая молярные концентрации эфира. За ходом реакции (5) удобно следить по накоплению в среде уксусной кислоты, оттитровывая ее щелочью. При этом:
Cэф(0) = б Ч [V∞ – V(0)] (8)
Cэф(t) = б Ч [V∞ – V(t)] (9)
Здесь V(0), V(t) и V∞,- объем щелочи, пошедшей на титрование пробы в начальный момент времени, в процессе гидролиза и после его полного завершения, а б — некий коэффициент пропорциональности. С учетом (8) и (9) уравнение (7) легко преобразуется к виду:
ln((V∞ – V(0))/ (V∞ – V(t)) = k1 Ч t (10)
Заполнить колбу на 500 мл дистиллированной водой, поставить ее на лед для охлаждения. В две колбы на 100-200 мл залить по 50 мл раствора соляной кислоты с концентрациями 0,5 и 1,0 М соответственно. Измерить температуру растворов. Опыты можно вести и при более высокой, чем комнатная, температуре, однако это требует наличия термостата (или водяной бани) и обратного холодильника. С помощью мерной пипетки вводят 2 мл эфира в одну из колб с кислотой, встряхивают и закрывают пробкой. Момент вливания эфира принимают за время начала реакции гидролиза. Спустя какое-то время вводят 2 мл эфира в другую колбу с соляной кислотой, также фиксируют момент начала реакции. Поочередно, в среднем через каждые 10 минут, отбирают пипеткой из каждой колбы с реакционной смесью пробы по 5 мл и выливают их в колбы для титрования. В них предварительно заливают 20 см3 охлажденной дистиллированной воды для того, чтобы максимально затормозить процесс гидролиза. Колбу с реакционной смесью после отбора пробы следует сразу же закрыть пробкой. Момент t вливания пробы в колбу для титрования фиксируют. Титрование проводят в присутствии фенолфталеина (1-2 капли). Объем щелочи V, пошедший на нейтрализацию кислоты, заносят в табл. 3.
Опыты по гидролизу эфира с разной концентрацией катализатора
(0,5 и l,0 M HC1) ведутся параллельно, поэтому данные опытов заносят в две разные таблицы. В них естественно следует указывать истинное время, прошедшее от начала каждого опыта до взятия пробы, которое может не совпадать с приведенным в таблице для ориентировки.
5. Для установления V∞ оставляют закрытые колбы с реакционной смесью до следующего занятия. Можно принудительно ускорить процесс гидролиза, нагревая колбы по завершению опыта до 50-60 °С в течение 30 минут, после чего провести отбор пробы с последующим титрованием.
6. Для определения V(0) наливают в две колбы по 50 мл 0,5 и 1,0 М раствора НС1, но добавляют в них, вместо эфира, по 2 мл дистиллированной воды. Отбирая пробы по 5 мл, вводят их в колбы для титрования с 20 мл дистиллированной воды и титруют щелочью.
7.После заполнения обеих таблиц строят зависимости
ln <[(V∞ - V(0))] / [V∞- V(t)]>от t. Определяют степень их линейности, что является критерием порядка реакции. Из наклона линейного участка определяют величину константы скорости гидролиза kI эфира при данной концентрации катализатора.
8. Анализируют результаты, формулируют выводы, оформляют работу.
Какие физико-химические методы чаще всего применяют для регистрации скорости индикаторных реакций и почему? Необратимые реакции нулевого и первого порядка. Обратимые реакции первого порядка. Необратимые реакции второго порядка. Необратимые реакции третьего порядка. Две параллельные реакции первого порядка. Две последовательные реакции первого порядка. Зависимость скорости последовательных реакций от величины константы скорости реакции.
Лабораторная работа № 15
Изучение кинетики омыления уксусноэтилового эфира в щелочной среде
Оборудование, материалы: лед, пипетка на 2 мл, мерный цилиндр, две конические колбы на 100 мл и одна на 250 мл, бюретка, химический стакан, термометр. Растворы: CH3COOC2H5 (0,02 M); NaOH (0,05 М); НС1 (0,1 М), фенолфталеин. Для приготовления одного литра раствора этилацетата нужной концентрации необходимо 2 мл эфира растворить в 100 мл этилового спирта, а затем довести объем до 1000 мл дистиллированной водой.
Краткие теоретические сведения:
Омыление сложного эфира, например, этилацетата, является бимолекулярной необратимой реакцией:
CH3COOC2H5 + NaOH → CH3COONa + С2Н5ОН (11)
За ее скоростью удобно следить по изменению концентрации исходных веществ во времени. При этом процесс описывается кинетическим уравнением реакции II порядка:
— dCщ(t)/dt = kII Ч Cэф(t) Ч Cщ(t), (12)
в котором Cэф(t) и Cщ(t) — текущие концентрации эфира и щелочи. Если концентрации щелочи Cщ(0) и эфира Cэф(0) в момент начала реакции различны, причем Cщ(0) > Cэф(0), то после интегрирования (12) приобретает вид:

Подчеркнем, что Cщ(0) ≠ Cэф0, а Cэф(0) ≠ Cэф0, где Cэф0 и Cщ0 — исходные концентрации реагентов. Последние при образовании реакционной смеси меняются. Пусть V(0), V(t), V∞ — объемы кислоты с исходной концентрацией Cк°, которые пошли на титрование щелочи в пробе объемом Vnp соответственно в момент начала реакции (11), в ходе процесса и по его полному завершению. Тогда из условия эквивалентности следует, что:
Сщ(0) = Ско Ч V(0)/Vпр; Сщ(t) = Ско Ч V(t)/Vпр; Сщ(∞) = Ско Ч V(∞)/Vпр (14)
Концентрация эфира в пробе в момент начала реакции определяется соотношением:
Cэф(0) = Ско Ч (V(0) — V∞)/ Vпр, (15)
Подставляя (14) и (15) в (13), приходим к выражению:

Для графической обработки экспериментальных данных (16) удобнее представить в виде:

Видно, что если расчет kII по (16) требует знания V∞, V(t) и V(0), то при определении kII из графика зависимости ln(V(t)/[V(t)-V∞]) от t необходимо знать лишь V∞ и V(t).
Заполнить колбу на 250 мл дистиллированной водой и поставить на лед для охлаждения. В одну из колб на 100 мл ввести 20-25 мл раствора этилацетата (0,02 М), в другую — точно такое же количество раствора щелочи (0,05 М). Измерить температуру растворов, после чего закрыть колбы стеклянными или корковыми пробками. Эксперимент можно вести и при температуре, отличной от комнатной, но это потребует использования термостата или водяной бани. В стаканчик для титрования наливают 20 мл Н2О и вводят пробу щелочи объемом 2 мл. Титрованием соляной кислотой с концентрацией Ск° = 0,1М в присутствии фенолфталеина уточняют истинную исходную концентрацию щелочи Сщ°. В ходе приготовления реакционной смеси исходная концентрация щелочи снижается, поэтому
Сщ(0) = 1/2ЧСщ0. Привлекая первое из соотношений (14), по значениям Ск°, Сщ(0) и Vnp находят расчетным путем V(0). Вливают раствор щелочи в эфир, отмечая время вливания. Этот момент принимают за начало реакции омыления. Реакционная смесь должна быть постоянно закрыта пробкой, что в какой-то мере предотвращает испарение эфира. Спустя примерно 10 минут после начала реакции быстро отбирают пипеткой пробу объемом в 2 мл реакционной смеси и вводят ее в стаканчик для титрования, куда предварительно налито 20 мл охлажденной дистиллированной воды. Момент вливания t точно фиксируют; титрованием находят объем кислоты V(t), затраченной на нейтрализацию щелочи. Повторяют определение текущей концентрации щелочи в смеси, отбирая для титрования пробы по 20 мл с периодичностью 10-15 минут в течение 1,5 — 2 часов. Данные заносят в табл. 4.
http://himia.my-dict.ru/q/6983252_pomogite-srocno-dou-70b1-reakcia-omylenia/
http://pandia.ru/text/80/683/10104-8.php