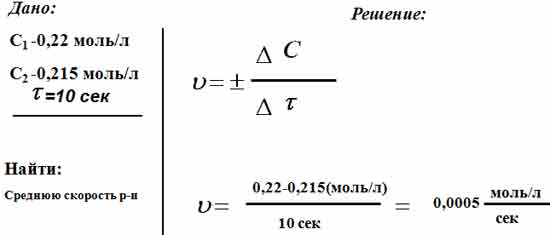
Реакция протекает по уравнению А+В = 2С. Начальная концентрация вещества А равна 0,22 моль/л, а через 10 сек -0,215 моль/л. Вычислите среднюю
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,299
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,247
- разное 16,834
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Урок №75. Скорость химической реакции. Закон действующих масс
Образцы решений задач по теме «Скорость химической реакции»
Задача №1
Реакция протекает по уравнению А+В = 2С. Начальная концентрация вещества А равна 0,22 моль/л, а через 10 с — 0,215 моль/л. Вычислите среднюю скорость реакции.
Используем формулу для расчёта
υ = ± ΔС/Δτ = ± (0,215-0,22)/(10-0) = 0,0005 моль/л ∙ с
Задача №2
Вычислите, во сколько раз увеличится скорость реакции при повышении температуры от 30 до 70 ∘ С, если температурный коэффициент скорости равен 2.
По правилу Вант-Гоффа
υ=υ 0 ·γ (t2-t1)/10
По условию задачи требуется определить υ/υ 0 :
υ/υ 0 =2 (70-30)/10 = 2 4 = 16
Задача №3
Запишите кинетическое уравнение для следующих уравнений реакций:
А) S(тв) + O 2 (г) = SO 2 (г)
Б) 2SO 2 (г) + O 2 (г) = 2SO 3 (ж)
Согласно закону действующих масс, который действует для газов и жидкостей:
υ = к 2 C 2 (SO 2 )·C (O 2 )
Задача №4
Как изменится скорость реакции:
S (тв) + O 2 (г) = SO 2 (г)
при увеличении давления в системе в 4 раза?
Запишем кинетическое уравнение для реакции до повышения давления в системе. Обозначим концентрацию кислорода
С(О 2 ) = а, концентрация серы — твёрдого вещества не учитывается.
При повышении давления в 4 раза, объём уменьшается в 4 раза, следовательно концентрация газа кислорода увеличится в 4 раза и кинетическое уравнение примет вид:
Определяем, во сколько раз возрастёт скорость реакции:
υ ‘ /υ = к 1 4а / к 1 а = 4
Следовательно, при повышении давления в 4 раза, скорость данной реакции увеличится в 4 раза.
Задача №5
Как изменится скорость реакции:
2SО 2 (г) + O 2 (г) = 2SO 3 (г)
при увеличении давления в системе в 2 раза?
Запишем кинетическое уравнение для реакции до повышения давления в системе. Обозначим концентрацию SO 2
С(SО 2 ) = а, концентрация кислорода C(O 2 ) = b.
При повышении давления в 2 раза, объём уменьшается в 2 раза, следовательно концентрация газа кислорода и SO 2 увеличится в 2 раза и кинетическое уравнение примет вид:
υ ‘ = к 1 (2а) 2 ·2b = к 1 4а 2 ·2b= к 1 8а 2 ·b
Определяем, во сколько раз возрастёт скорость реакции:
υ ‘ /υ = к 1 8а 2 ·b / к 1 а 2 ·b =8
Следовательно, при повышении давления в 2 раза, скорость данной реакции увеличится в 8 раз.
Задача №6
При температуре 10 ºС реакция протекает за 5 мин, при 20ºС – за 1 мин. Рассчитайте температурный коэффициент скорости реакции.
1) При условии, что концентрация вещества (С), вступившего в реакцию, постоянна:
При температуре 10 ºС скорость реакции равна υ 0 =∆C/∆τ 0 ,
При температуре 30 ºС скорость реакции равна υ=∆C/∆τ,
υ=∆C/60, ∆C= 60υ. Следовательно, 300υ 0 =60υ, а υ/υ 0 =300/60=5.
2) По правилу Вант Гоффа: υ = υ 0 γ ∆t/10 , υ/υ 0 = γ ∆t/10
3) Согласно рассуждениям (1) и (2), получим γ (20-10)/10 = γ=5
Реакция протекает по уравнению А+В = 2С. Начальная концентрация вещества А равна 0,22 моль/л, а через 10 сек -0,215 моль/л. Вычислите среднюю скорость реакции
Из курса химии вам встретится задание такого содержания:
Реакция протекает по уравнению А+В = 2С. Начальная концентрация вещества А равна 0,22 моль/л, а через 10 сек -0,215 моль/л. Вычислите среднюю скорость реакции
Так выглядит правильное решение этой задачи:
Нам дано уравнение, согласно которому протекает реакция: А+В = 2С. По условии задачи, в начале реакции концентрация вещества A была равна 0,22 моль/л, но уже через 10 секунд она стала составлять -0,215 моль/литр. Нужно узнать скорость реакции. Для этого узнаем разницу концентрации вещества в начале реакции и в конце, а дальше разделим на указанное нам время. В итоге получим, что средняя скорость реакции составляет 0,0005 моль/л/секунд. Это и будет являться правильным ответом на вопрос.
http://www.sites.google.com/site/himulacom/%D0%B7%D0%B2%D0%BE%D0%BD%D0%BE%D0%BA-%D0%BD%D0%B0-%D1%83%D1%80%D0%BE%D0%BA/11-%D0%BA%D0%BB%D0%B0%D1%81%D1%81-%D1%87%D0%B5%D1%82%D0%B2%D1%91%D1%80%D1%82%D1%8B%D0%B9-%D0%B3%D0%BE%D0%B4-%D0%BE%D0%B1%D1%83%D1%87%D0%B5%D0%BD%D0%B8%D1%8F/%D1%83%D1%80%D0%BE%D0%BA-75-%D1%81%D0%BA%D0%BE%D1%80%D0%BE%D1%81%D1%82%D1%8C-%D1%85%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%BE%D0%B9-%D1%80%D0%B5%D0%B0%D0%BA%D1%86%D0%B8%D0%B8-%D0%B7%D0%B0%D0%BA%D0%BE%D0%BD-%D0%B4%D0%B5%D0%B9%D1%81%D1%82%D0%B2%D1%83%D1%8E%D1%89%D0%B8%D1%85-%D0%BC%D0%B0%D1%81%D1%81
http://snorovka.com/himiya/1825