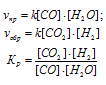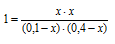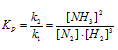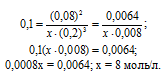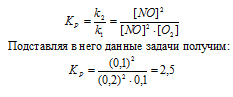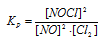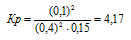Вычисление константы равновесия системы
Константа равновесия для гомогенной реакции
Задание 135.
Вычислите константу равновесия для гомогенной системы:
СО (г) + Н2О (г) ↔ СО2 (г) + Н2 (г)
если равновесные концентрации реагирующих веществ (молы/л):
[СО]р = 0,004; [Н2О]р = 0,064; [СО2]р = 0,016; [Н2]р = 0,016,
Чему равны исходные концентрации воды и СО? Ответ: Кр = 1; [H2O]исх = 0,08 моль/л; [СО]исх =0, 02 моль/л.
Решение:
Уравнение реакции имеет вид:
Kp = [CO2] . [H2]/ [CO] . [H2O]
Подставляя в выражение данные задачи получим:
Кр = (0,016 . 0,016)/(0,004 . 0,064) = 1.
Для нахождения исходных концентраций веществ Н2О и СО учтём, что согласно уравнению реакции из 1 моль СО и 1 моль Н2О образуется 1 моль СО2 и 1 моль Н2. Поскольку по условию задачи в каждом литре системы образовалось 0,016 моль СО2 и 0,016 моль Н2, то при этом было израсходовано по 0,016 моль СО и Н2О. Таким образом, искомые исходные концентрации равны:
Ответ: Кp = 1; [H2O]исх = 0,08 моль/л; [СО]исх =0, 02 моль/л.
Задание 136.
Константа равновесия гомогенной системы:
СО (г) + Н2О (г) ⇔ СО2 (г) + Н2 (г)
при некоторой температуре равна 1,00. Вычислите равновесные концентрации всех реагирующих веществ, если исходные концентрации равны (молы/л): [СО]исх = 0,10; [Н2О]исх = 0,40.
Ответ: [СО2]Р = [Н2]Р = 0,08; [СO]P= 0,02; [Н2O]P = 0,32.
Решение:
Уравнение реакции имеет вид:
При равновесии скорости прямой и обратной реакций равны, а отношение констант этих скоростей постоянно и называется константой равновесия данной системы:
Обозначаем за «х» моль/л равновесную концентрацию одного из продуктов реакции, тогда равновесная концентрация другого будет также х моль/л так как они оба образуются в одинаковом количестве. Равновесные концентрации исходных веществ будут:
[СО]исх = 0,10 – х моль/л; [Н2О]исх = 0,40 — х моль/л. (так как на образование х моль/л продукта реакции расходуется соответственно по х моль/л СО и Н2О. В момент равновесия концентрация всех веществ будет (моль/л): [СО2]Р = [Н2]Р = х; [СO]P= 0,10 — х; [Н2O]P = 0,4 – х.
Подставляем эти значения в выражение константы равновесия:
Решая уравнение, находим х = 0,08. Отсюда равновесные концентрации (моль/л):
Задание 137.
Константа равновесия гомогенной системы N2 + ЗН2 = 2NH3 при некоторой температуре равна 0,1. Равновесные концентрации водорода и аммиака соответственно равны 0,2 и 0,08 моль/л. Вычислите равновесную и исходную концентрации азота. Ответ: [N2]P = 8 молы/л; [N2]исх = 8,04 моль/л.
Решение:
Уравнение реакции имеет вид:
Обозначим равновесную концентрацию N2 через х моль/л. Выражение константы равновесия данной реакции имеет вид:
Подставим в выражение константы равновесия данные задачи и найдём концентрацию N2
Для нахождения исходной концентрации N2, учтём, что, согласно уравнению реакции на образование 1 моль NH3 затрачивается ½ моль N2. Поскольку по условию задачи в каждом литре системы образовалось 0,08 моль NH3, то при этом было израсходовано 0,08 . 1/2 = 0,04 моль N2. Таким образом, искомая исходная концентрация N2 равна:
Задание 138.
При некоторой температуре равновесие гомогенной системы
2NО + O2 ↔ 2NO2 установилось при следующих концентрациях реагирующих веществ (молы/л): [NО]p = 0,2; [О2]р = 0,1; [NO2]р = 0,1. Вычислите константу равновесия и исходную концентрацию NO и O2. Ответ: К = 2,5; [NО]исх = 0,3 молы/л; [О2]исх = 0,15 моль/л.
Решение:
Уравнение реакции:
Для нахождения исходных концентраций NO и O2 учтём, что согласно уравнению реакции, из 2 моль NO и 1 моль О2 образуется 2 моль NO2, то при этом было затрачено 0,1 моль NO и 0,05 моль О2. Таким образом, исходные концентрации NO и О2 равны:
Ответ: Кp = 2,5; [NО]исх = 0,3 молы/л; [О2]исх = 0,15 моль/л.
Смещение равновесия схимической системы
Задание 139.
Почему при изменении давления смещается равновесие системы:
N2 + 3Н2 ↔ 2NH3 и, не смещается равновесие системы N2 + O2 ↔ 2NO? Ответ мотивируйте на основании расчета скорости прямой и обратной реакций в этих системах до и после изменения давления. Напишите выражения для констант равновесия каждой из данных систем.
Решение:
а) Уравнение реакции:
Из уравнения реакции следует, что реакция протекает с уменьшением объёма в системе (из 4 моль газообразных веществ образуется 2 моль газообразного вещества). Поэтому при изменении давления в системе будут наблюдаться смещение равновесия. Если повысить давление в данной системе, то, согласно принципу Ле Шателье, равновесие сместится вправо, в сторону уменьшения объёма. При смещении равновесия в системе вправо скорость прямой реакции будет больше скорости обратной реакции:




Если же давление в системе уменьшить, то равновесие системы сместится влево, в сторону увеличения объёма, то при смещении равновесия влево скорость прямой реакции будет меньше, чем скорость прямой:

б) Уравнение реакции:
Из уравнения реакции следует, что при протекании реакции не сопровождается изменением объёма, реакция протекает без изменения числа молей газообразных веществ. Поэ му изменение давления в системе не приведёт к смещению равновесия, поэтому скорости прямой и обратной реакции будут равны:




Задание 140.
Исходные концентрации [NО]исх и [С12]исх в гомогенной системе
2NO + Сl2 ↔ 2NOС1 составляют соответственно 0,5 и 0,2 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20% NО. Ответ: 0,417.
Решение:
Уравнение реакции имеет вид: 2NO + Сl2 ↔ 2NOС1
Согласно условию задачи в реакцию вступило 20% NO, что составляет 0,5 . 0,2 = 0,1 моль, а не прореагировало 0,5 – 0,1 = 0,4 моль NO. Из уравнения реакции следует, что на каждые 2 моль NO расходуется 1 моль Cl2, при этом образуется 2 моль NOCl. Следовательно, c 0,1 моль NO в реакцию вступило 0,05 моль Cl2 и образовалось 0,1 моль NOCl. Осталось не израсходованным 0,15 моль Cl2 (0,2 – 0,05 = 0,15). Таким образом, равновесные концентрации, участвующих веществ равны (моль/л):
Подставляя в данное выражение равновесные концентрации веществ, получим:
Ответ: Кр = 4,17.
Реакция протекает по уравнению H2(г) + CO2(г) = CO(г) + H2O(ж) . энтальпии и энтропии
Реакция протекает по уравнению H2(г) + CO2(г) = CO(г) + H2O(ж) . Определить изменение стандартной энтальпии и энтропии данной реакции.
Вы хотите, чтобы вам нашли в справочнике стандартные энтропии веществ и энтальпии (теплоты образования) . Сделайте это сами. А далее чистая арифметика. (Все величины даны там на моль и при стандартных условиях. )
Энтропия Н2О (ж) + энтропия СО — энтропия СО2 — энтропия Н2 = изменение стандартной энтропии для реакции.
Такое же действие надо проделать с энтальпиями (теплотами образования веществ и получить стандартное изменение энтальпии (тепловой эффект) для реакции.
Надо также иметь в виду, что результат получается не на моль. Например, если теплота образования дана в кДж/моль для каждого вещества, то тепловой эффект реакции получится в кДж, потому что при расчете мы умножаем мольную энтальпию вещества на число молей этого вещества (коэффициент в уравнении реакции, который в вашем случае у всех веществ равен 1, т. е. 1 моль).
Взаимодействие углекислого газа с веществами и его химические свойства
Общие химические свойства углекислого газа: CO2 инертен, то есть химически не активен; при попадании в водный раствор легко вступает в реакции.
Большинство кислотных оксидов устойчивы к высоким температурам, но углекислота при их воздействии восстанавливается.
Взаимодействие с другими веществами:
1) Углекислота относится к кислотным оксидам, то есть в сочетании с водой образуется кислота. Однако угольная кислота неустойчива и распадается сразу. Эта реакция имеет обратимый характер:
Диоксид углерода + вода ↔ угольная кислота

2) При взаимодействии углекислого газа и соединений азота с водородом (аммиаком) в водном растворе происходит разложение до углеаммонийной соли.
Аммиак + углекислота = гидрокарбонат аммония

Полученное вещество часто используется в приготовлении хлеба и различных кондитерских изделий.
3) Ход некоторых реакций должен поддерживаться высокими температурами. Примером является производство мочевины при 130 °C и давлении 200 атм., схематически изображаемое так:
Аммиак + диоксид углерода → карбамид + вода
Также под воздействием температуры около 800 градусов протекает реакция образования оксида цинка:
Цинк + двуокись углерода → оксид цинка + оксид углерода
4) Возможно уравнение с гидроксидом бария, при котором выделяется средняя соль.
Гидроксид бария + углекислота = карбонат бария + оксид водорода.
Применяется для регулировки калориметров по теплоемкости. Также вещество используют в промышленности для производства красных кирпичей, синтетических тканей, фейерверков, гончарных изделий, плитки для ванн и туалетов.
5) Углекислый газ выделяется при реакциях горения.
Метан + кислород = углекислота + вода (в газообразном состоянии) + энергия
Этилен + кислород = диоксид углерода + оксид водорода + энергия
Этан + кислород = двуокись углерода + вода + энергия
Этанол + кислород = вода + углекислота + энергия
6) Газ не поддерживает горения, этот процесс возможен только с некоторыми активными металлами, например, магнием.
Магний + углекислота = углерод + оксид магния.
MgO активно применяется при производстве косметических средств. Вещество используют в пищевой промышленности как пищевую добавку.
7) Двуокись углерода реагирует с гидроксидами с получением солей, которые существуют в двух формах, как карбонаты и бикарбонаты. Например, углекислый газ и гидроксид натрия, согласно формуле, образуют гидрокарбонат Na:
диоксид углерода + гидроксид натрия → гидрокарбонат натрия.
Или же при большем количестве NaOH образуется карбонат Na с образованием воды:
Диоксид углерода + гидроксид натрия → карбонат натрия + вода
Кислотно-щелочные реакции углекислоты используются на протяжении веков для затвердевания известкового раствора, что может быть выражено простым уравнением:
Гидроксид кальция + двуокись углерода → карбонат кальция + оксид водорода

Диоксид углерода + вода → глюкоза + кислород.
9) Химические свойства углекислоты используются в промышленности при производстве соды, суть этого процесса можно выразить суммарным уравнением:
Хлорид натрия + Диоксид углерода + аммиак + вода → гидрокарбонат натрия + хлорид аммония
10) Фенолят Na разлагается при взаимодействии с углекислым газом, при этом малорастворимый фенол выпадает в осадок:
Фенолят натрия + двуокись углерода + оксид водорода = фенол + гидрокарбонат натрия
11) Пероксид натрия и углекислый газ, взаимодействуя, образуют среднюю соль карбоната Na с выделением кислорода.
Пероксид натрия + углекислота → карбонат натрия + кислород

Образование углекислоты происходит при растворении в воде кальцинированной соды (стиральной соды).
Гидрокарбонат натрия + вода → углекислота + вода + гидроксид натрия
При этой реакции (гидролиз по катиону) образуется сильнощелочная среда.
12) CO2 вступает в реакцию с гидроксидом калия, последний образуется путем электролиза хлористого калия.
Гидроксид калия + углекислота → карбонат калия + вода
13) Газ в силу своего строения не реагирует с благородными газами, то есть гелием, неоном, аргоном, криптоном, ксеноном, радоном, оганесоном.
Заключение
Мы привели большую часть химических реакций, в которых участвует CO2. Ученые всего мира пытаются решить проблему увеличения концентрации углекислоты в воздухе, не без помощи реакций с другими веществами, которые известны химикам. А какие химические формулы взаимодействия углекислого газа знаете вы?
Спасибо, что указали на ошибку. Исправили.
Скажите пожалуйста На производстве углекислоты мы заменили на комрессорном агрегате старый охладитель углекислого газа с трубками из нержавейки на новый, с латунными трубками. То есть в начале этих трубок охладителя Углекислый газ будет под давлением 16 бар и температурой 130 градусов, на выходе + 10 градусов, всё это с выделением конденсата. Не будет ли какой-то непредвиденной реакции в зоне взаимодействия уг. газа, латуни и воды? Охладитель работает хорошо, но не разрушаться ли трубки от коррозии?
Необходимо определиться для начала, откуда поступает к вам углекислый газ, какие еще газы поступают вместе с углекислым газом в охладитель. У нас, в энергетическом производстве, на определенном участке пароводяного тракта установлены латунные трубки, в которых происходит нагрев теплоносителя. Мы производим замеры растворенного кислорода в конденсате перед подачей его на подогреватели с трубками из латуни. В нашем случае большая концентрация кислорода в воде, при нагревании последней, приводит к коррозии латунных трубок.
Здравствуйте Вячеслав. Углекислый газ поступает с брожения пивного сусла. Углекислый газ (у.г.) сжимается компрессором и при t 130* подаётся на теплообменник (т.о.). хладоносителем t -4*. На латунных стенках т.о. образуется конденсат который отделяется от у.г. в конденсатоотводчике. Содержание кислорода в конденсате не должно быть большим, если вообще не минимальное. После установки нового т.о. конденсатоотводчик стал забиваться непонятной серой массой похожей на мокрый графит. Компрессор разбирали — проблема не в нём (думали одно из графитовых колец размолотило). Разбирать и осматривать т.о. более трудоёмкий процесс.
Затрудняюсь вам ответить на этот вопрос, надо изучать состав газа на входе в теплообменник. Возможно образование угольной кислоты в теплообменнике. А при наличии кислорода кислота может вызывать коррозию, но это не точно.
http://sprashivalka.com/tqa/q/21504086
http://uglekislygaz.ru/dioksid-ugleroda/himicheskie-svojstva-co2/